Katherine Tech 1.2, Timothy R. Gershon 2,3,4
Cuvinte cheie: Medulloblastom; glicoliză; lipogeneza; factorul de alungire eucariotă 2 kinază (eEF2K)
Trimis 02 decembrie 2014. Acceptat pentru publicare 27 ianuarie 2015.
Introducere
Terapiile direcționate metabolic au promisiunea de a oferi un tratament nou eficient și mai puțin toxic pentru meduloblastom, cea mai frecventă tumoare cerebrală malignă din copilărie. Terapia actuală se bazează pe sensibilitatea medulloblastomului la deteriorarea ADN-ului care a fost descoperită acum mai bine de 50 de ani. Radioterapia cranio-spinală, implementată pentru prima dată în anii 1950, a schimbat meduloblastomul dintr-o boală fatală în mod uniform într-un cancer tratabil cu 60% supraviețuire pe termen lung (1). De atunci, decenii de studii clinice au produs îmbunătățiri incrementale ale rezultatelor prin adăugarea chimioterapiei, 80% dintre pacienții cu risc standard și 70% dintre pacienții cu risc crescut au supraviețuit mai mult de 5 ani (2-6). Cu toate acestea, succesul radiațiilor și chimioterapiei are un cost semnificativ, deoarece supraviețuitorii trebuie să trăiască cu efecte nefavorabile ale tratamentului, inclusiv demență, accidente vasculare cerebrale timpurii, afectarea creșterii și pierderea auzului (7-14). Supraviețuitorii rămân, de asemenea, expuși riscului de recurență, care este în prezent incurabil, iar 20-30% dintre pacienții cu meduloblastom mor în cele din urmă de boală (2,15,16). Găsirea de noi vulnerabilități specifice tumorii pentru a completa sensibilitatea la deteriorarea ADN-ului poate permite noi abordări ale terapiei. Investigațiile recente sugerează că programul metabolic al meduloblastomului poate fi o vulnerabilitate netestată anterior.
Aici, examinăm caracteristicile specifice ale metabolismului medulloblastomului care pot fi vizate terapeutic. Unele procese metabolice tipice medulloblastomului, inclusiv lipogeneza crescută și glicoliza aerobă, derivă din dezvoltarea neuronală. Alte procese metabolice, inclusiv inhibarea globală a traducerii proteinelor, pot să nu aibă un corelat clar de dezvoltare, ci mai degrabă pot fi caracteristici comune ale cancerului. Propunem că aceste diverse procese metabolice sunt corelate, așa cum se arată în Figurile 1,2, și pot fi vizate în comun pentru a maximiza potențialul efect antitumoral.
Progenitorii neuronali și celulele meduloblastomului au nevoi metabolice distincte
Medulloblastomul este un set de tumori heterogene din punct de vedere molecular care apar din cerebel, împărtășesc modele histologice comune, dar apar din diferite seturi de progenitori neuronali. Două subgrupuri moleculare de meduloblastom au fost legate de căile de semnalizare a dezvoltării hiperactivării, în special Sonic Hedgehog (Shh) și WNT. Urmărirea descendenței la șoarecii transgenici demonstrează că activarea acestor căi transformă seturi distincte, dar legate de progenitori neuronali. Hiperactivarea Shh determină formarea medulloblastomului în mod specific în progenitorii neuronilor granulelor cerebeloase (CGNP), o populație care derivă din buza rombică superioară (17,18). Activarea căii WNT, combinată cu deleția p53, determină formarea meduloblastomului de la progenitorii trunchiului cerebral care derivă din buza rombică inferioară (19). Efectul mitotic al Shh asupra CGNP-urilor și efectul oncogen al hiperstimulării căii Shh oferă o platformă experimentală ideală pentru a studia tiparele metabolice pe măsură ce progenitorii neuronali proliferează și dau naștere tumorilor derivate din progenitori.
Atât progenitorii neuronali, cât și celulele tumorale se confruntă cu provocări metabolice care îi disting de alte celule din creier. Toate celulele consumă energie pe măsură ce mențin homeostazia și toate celulele din creier produc energie din glucoză, cetone și aminoacizi. Neuronii, care sunt celule post-mitotice, sunt cei mai mari consumatori de energie din creier, cheltuind energie pentru a menține activitatea electrică și comunicarea intercelulară (20,21). Eficiența generării de ATP poate fi, prin urmare, de o importanță capitală. Cu toate acestea, necesitatea unei generări eficiente de ATP în celulele proliferante din creier poate fi echilibrată de nevoi metabolice suplimentare.
Spre deosebire de neuronii post-mitotici, celulele proliferative nu trebuie doar să extragă energie din substraturi, ci și să metabolizeze aceste substraturi în acizi nucleici, proteine și lipide pentru descendenții lor (22). În primele 2 săptămâni postnatale la șoareci și în primul an de viață la om, cerebelul este locul proliferării rapide, deoarece CGNP-urile se divid ca răspuns la semnalizarea Shh. Proliferarea CGNP generează cea mai mare populație de neuroni din creier. Pentru CGNP-uri extrem de proliferative, generarea de intermediari pentru sinteza lipidelor, acizilor nucleici și proteinelor poate concura pentru prioritate cu generația din aval de ATP. Celulele tumorilor de grad înalt, inclusiv meduloblastomul și glioblastomul, trebuie să echilibreze în mod similar metabolismul energetic cu necesitatea de a sintetiza macromoleculele esențiale pentru creșterea tumorii. În schimb, tumorile de grad inferior pot să nu necesite acumularea constantă de biomasă și, prin urmare, pot acorda prioritate producției de ATP. Diferitele nevoi metabolice ale populațiilor de celule proliferative și neproliferative se potrivesc cu diferențe profunde în mecanismele lor de metabolism al nutrienților.
Celulele progenitoare neuronale configurează metabolismul pentru a susține lipogeneza
În concordanță cu inducerea proliferării, Shh induce lipogeneza în CGNP printr-un mecanism care se păstrează în meduloblastom (23-25). La nivelul reglării transcripționale, activarea căii Shh reglează în sus proteinele necesare pentru sinteza lipidelor, incluzând sintaza fazei de acid gras (FASN) și acetil-CoA carboxilaza 1 (ACC1) și reglează în jos enzimele catabolismului acizilor grași, inclusiv acil-CoA oxidaza. 1 (ACOX1) și acil-CoA dehidrogenază cu lanț mediu (MCAD). Aceste modificări transcripționale sunt reflectate de modificările activității metabolice a CGNP-urilor, demonstrate in vitro unde Shh scade oxidarea CGNP a acizilor grași (24). Reglarea transcripțională a enzimelor metabolismului lipidic în CGNP este coordonată prin activarea dependentă de Shh a E2F1 prin modulația Rb (24). Prin acest sistem, Shh induce atât ciclul celular crescut, cât și creșterea lipogenezei, asigurând astfel că biosinteza macromoleculelor este cuplată cu proliferarea. De asemenea, Shh induce în continuare modificări ale metabolismului glucozei pentru a sprijini biosinteza.
Glicoliza aerobă permite progenitorilor neuronali să echilibreze cerințele de energie și biosinteză
Glucoza este sursa primară de energie din creier. Prin fosforilarea oxidativă, glucoza poate fi metabolizată în H2O și CO2 pentru a genera 38 ATP pe moleculă. Alternativ, glucoza poate fi metabolizată în piruvat prin glicoliză, generând în cele din urmă lactat și 2 ATP. Glicoliza aerobă este metabolismul glucozei în lactat, în ciuda prezenței suficientului oxigen necesar fosforilării oxidative. Celulele cu cerințe mari de ATP sunt probabil dezavantajate de glicoliza aerobă, deoarece glicoliza generează mai puțin ATP pe moleculă de glucoză decât fosforilarea oxidativă. Cu toate acestea, celulele proliferante pot utiliza glicoliza aerobă pentru a satisface nevoile concurente atât pentru generarea de energie, cât și pentru acumularea de biomasă (Figura 1). Spre deosebire de fosforilarea oxidativă, care transformă glucoza în H2O și CO2, glicoliza aerobă generează, de asemenea, intermediari metabolici care pot fi utilizați pentru biosinteza lipidelor și a acidului nucleic (26). În concordanță cu diferitele lor cerințe energetice, neuronii și progenitorii neuronali utilizează seturi specifice de enzime metabolizatoare ale glucozei care promovează fie fosforilarea oxidativă, fie glicoliza aerobă.
Neuronii diferențiați și progenitorii neuronali metabolizează glucoza folosind seturi distincte de enzime glicolitice. Hexokinazele catalizează fosforilarea glucozei, prima modificare a glucozei la intrarea în celulă. Există patru gene de mamifere care codifică hexokinazele (Hk1-4). Hk1 este exprimat de neuroni și glia în tot creierul, dar este exclus din regiunile progenitorilor neuronali (27). În schimb, semnalizarea Shh induce expresia Hk2 în CGNP (27). Mai departe în aval în calea glicolitică, Shh induce îmbinarea enzimei piruvat kinazei în izoforma M2 (PkM2) (23,28).
În diverse tipuri de celule, Hk2 și PkM2 sunt asociate cu glicoliza aerobă, iar analiza metabolomică demonstrează că Shh induce glicoliza aerobă în CGNP (23,27). Absorbția de glucoză cerebelară și generarea de lactat sunt crescute în mod specific în perioada neurogenezei cerebeloase postnatale, iar CGNP cultivate în prezența Shh cresc absorbția de glucoză și generarea de lactat, fără a crește consumul de oxigen (27). Ștergerea genetică a Hk2 în CGNP a blocat glicoliza aerobă indusă de Shh, demonstrând rolul central al Hk2 în configurarea CGNPmetabolismului ca răspuns la semnalizarea Shh.
Creșterea lipogenezei și glicolizei aerobe în meduloblastom
Celulele tumorale maligne ale creierului, precum progenitorii neuronali, sunt extrem de proliferative și trebuie să satisfacă nevoile concurente de a genera energie prin catabolismul nutrienților și de a transforma nutrienții în macromolecule necesare creșterii. Regulatorii transcripționali și enzimele care mediază creșterea lipogenezei și glicolizei aerobe în CGNP stimulate de Shh controlează, de asemenea, metabolismul celulelor tumorale la modelele de șoarece de meduloblastom condus de Shh. Liniile de șoarece ND2: SmoA1 și SmoM2 exprimă alele diferite, constitutiv active ale efectorului Shh Smoothened și dezvoltă meduloblastoame spontane. Aceste tumori demonstrează reglarea în sus a activării FASN, E2F1 și depunerea picăturilor de lipide, indicând o rată ridicată de sinteză a lipidelor (24) și reglarea în sus a Hk2 și PkM2, în concordanță cu creșterea glicolizei aerobe (23,27). Metabolismul glicolitic al medulloblastomului este demonstrat în continuare de 18 studii FDG PET care arată o aviditate intensă a glucozei medulloblastoamelor atât la șoareci, cât și la oameni, chiar și în comparație cu absorbția de glucoză a creierului (27,37).
Glicoliza aerobică și lipogeneza ca trăsături comune în toate tipurile de tumori cerebrale
Întreruperea lipogenezei sau glicolizei restricționează creșterea tumorilor cerebrale
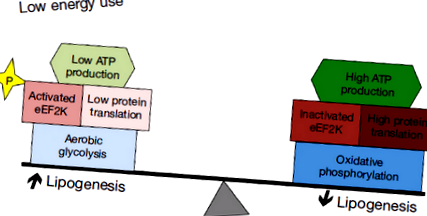
Restricționarea cheltuielilor de energie în medulloblastom permite metabolismul tumorii
Mecanismele care limitează consumul de energie permit tumorilor să maximizeze lipogeneza și să beneficieze în mod optim de glicoliza aerobă. În timp ce metabolizarea glucozei prin glicoliză susține canalizarea nutrienților în biosinteză, producția ineficientă de ATP prezintă un risc dacă disponibilitatea nutrienților este compromisă. Minimizarea consumului de energie tumorală poate atenua acest risc. Conversia netă a glucozei în lipide este, de asemenea, o obligație, cu excepția cazului în care necesitățile energetice pot fi diminuate. Un mecanism pentru limitarea cheltuielilor de energie tumorală prin inhibarea traducerii ARNm a fost recent descris și s-a constatat că este activ în meduloblastom (49). Acest mecanism poate fi esențial pentru a permite celulelor tumorale să se angajeze pe deplin în mecanismele lipogene și glicolitice ale progenitorilor neuronali fără răspunderea deficitului de energie (Figura 1).
Factorul de alungire eucariotă Factorul de alungire eucariotă 2 (eEF2) joacă un rol esențial în traducere prin promovarea translocării dependente de GTP a lanțului peptidic în creștere de-a lungul ribozomului (50). Activitatea eEF2 este reglată în jos prin fosforilare prin factorul de alungire eucariotă 2 kinază (eEF2K) (51). La rândul său, eEF2K este activat de senzorul de energie AMPK (52.53). Exprimarea eEF2K se corelează negativ cu supraviețuirea pacientului atât în medulloblastom cât și în glioblastom, sugerând că reducerea activității eEF2 favorizează creșterea tumorii (49). În concordanță cu această interpretare, întreruperea expresiei eEF2K în liniile celulare xenogrefate a sensibilizat tumorile la privarea de nutrienți, determinând creșterea tumorilor la șoarecii alimentați cu diete cu restricție calorică mai lent și cu moartea crescută a celulelor tumorale.
Țintirea combinatorie a metabolismului tumoral
În mod curios, proteina senzorului de energie intracelular AMPK reprezintă un punct de convergență între aceste procese diferite (Figura 2). AMPK exercită un efect homeostatic prin integrarea lipogenezei, producției de energie și traducerea proteinelor. Țintirea AMPK poate fi totuși problematică, deoarece activarea și inhibarea AMPK au potențialul de efecte mixte asupra creșterii. Activarea AMPK inhibă lipogeneza prin inhibitori de fosforilare a ACC1 (59-61), care poate restricționa creșterea tumorii. În concordanță cu un efect supresiv al tumorii, ștergerea Hk2 a produs activarea AMPK în GFAP-cre: meduloblastoame SmoM2 în timp ce încetinește creșterea tumorii (27). Cu toate acestea, activarea AMPK fosforilează eEF2K, care poate promova creșterea prin limitarea cheltuielilor de energie (51,62). Pentru a întrerupe efectul homeostatic al integrării mediate de AMPK, poate fi cel mai eficient să vizeze simultan lipogeneza, eEF2K și glicoliza aerobă. O dietă ketogenică combinată cu inhibitori specifici ai Hk2 și/sau eEF2K poate atinge acest obiectiv și poate viza în mod optim metabolismul tumorii.
Mulțumiri
Finanțare: Timothy R. Gershon este susținut de subvenții de la National Institutes of Health (NIH; 1K08NS077978-01), St. Fundația Baldrick și Institutul American pentru Cercetarea Cancerului.
Notă de subsol
Conflictele de interese: Autorii nu au conflicte de interese de declarat.
- Metabolismul energetic și compoziția corpului în cercetarea nutrițională și a sănătății - Vlag Graduate School
- Cheltuieli de energie în timpul supraalimentării Nutriție; Text integral cu metabolism
- Departamentul de endocrinologie, diabet și metabolism al pediatriei
- Efectul dietelor ultraprocesate versus dietele neprocesate asupra consumului de energie - Vizualizare text complet
- Supraalimentarea cu fructoză la rudele de gradul I ale pacienților cu diabet zaharat de tip 2 are impact asupra energiei