1 Departamentul de nutriție, științe alimentare și fiziologie, Universitatea din Navarra, C/Irunlarrea 1, 31008 Pamplona, Spania
2 Departamentul de Fiziologie și Biofizică, Institutul de Științe Biomedice, Universitatea din São Paulo, Avenue Professor Lineu Prestes, 1524, 05508-900 São Paulo, SP, Brazilia
3 CIBER Fiziopatologia obezității și nutriției (CIBERobn), Instituto de Salud Carlos III, 28029 Madrid, Spania
Abstract
1. Introducere
Prin urmare, scopul prezentului studiu a fost de a testa ipoteza dacă suplimentarea cu ulei de pește într-un tratament dietetic cu restricție de energie afectează modelul de metilare a ADN-ului genelor care sunt reglementate în jos de n-3 Suplimentarea PUFA în PBMC, cum ar fi receptorii de acizi grași CD36 și FFAR3, enzimele FADS1 și PDK4, și antigenul de suprafață CD14.
2. Metode
2.1. Proiectare de încercare și participanți
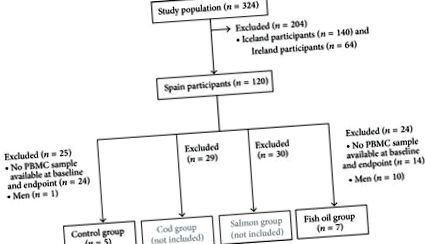
Studiul primar s-a bazat pe un studiu randomizat de 8 săptămâni de intervenție cu patru diete izocalorice, conceput pentru a investiga efectele specifice ale consumului de pește sau suplimentarea cu ulei de pește asupra pierderii în greutate la adulții tineri supraponderali (înregistrarea studiului: ClinicalTrials.gov NCT00315770) [18 ]. În acest studiu clinic, au fost incluși un total de 324 de indivizi supraponderali (140 din Islanda, 120 din Spania și 64 din Irlanda) și repartizați aleatoriu în patru grupuri de diete (capsule de control, cod, somon și ulei de pește) [18]. Descrierea detaliată a protocolului, recrutarea și înscrierea participanților, precum și criteriile de includere și excludere sunt descrise în altă parte [18, 19]. Pe scurt, criteriile inițiale de includere au fost indicele de masă corporală (IMC) 27,5-32,5 kg/m 2, vârsta cuprinsă între 20 și 40 de ani și circumferința taliei ≥94 cm și respectiv ≥80 cm pentru bărbați și femei. Criteriile de excludere au fost schimbarea în greutate datorită dietei de slăbit în termen de 3 luni înainte de începerea studiului, utilizarea suplimentelor care conțin n-3 acizi grași, calciu sau vitamina D în ultimele 3 luni, tratamente medicamentoase pentru diabetul zaharat, hipertensiune arterială sau hiperlipidemie și sarcina sau alăptarea femeilor.
). Pentru a reduce variabilitatea, subiecții aparținând grupurilor de cod și somon nu au fost analizați, deoarece dacă s-ar observa modificări ale metilării ADN în aceste grupuri, ar fi imposibil să se găsească agenții responsabili din cauza diferențelor mari de macronutrienți și micronutrienți dintre ambele specii de pești. Studiul a fost aprobat de Comitetul Etic al Universității din Navarra și a urmat liniile directoare de la Helsinki. Toți participanții și-au dat consimțământul în scris după ce au fost informați despre scopul naturii și posibilele riscuri ale studiului. Acest studiu a fost efectuat la Universitatea din Navarra din Pamplona, Spania, iar recrutarea a fost efectuată în 2004 și 2005.
2.2. Intervenție dietetică
2.3. Măsurători antropometrice și metabolice
Măsurătorile parametrilor antropometrici și colectarea probelor de sânge au fost efectuate la momentul inițial și după perioada de suplimentare (punct final), așa cum s-a descris anterior [24]. Nivelurile plasmatice de glucoză, colesterol total și triacilgliceroli au fost măsurate prin teste colorimetrice specifice (Horiba ABX Diagnostics, Montpellier, Franța) utilizând un sistem automat (COBAS MIRA, Roche, Basel, Elveția), în timp ce nivelurile de insulină circulante au fost determinate de ELISA, AB, Uppsala, Suedia). Indicele de evaluare a modelului de homeostazie (HOMA-IR) a fost calculat conform lui Matthews și colab. [25] pentru a evalua rezistența la insulină.
2.4. Izolarea PBMC, extracția ADN și conversia bisulfitului
PBMC-urile au fost izolate prin centrifugare diferențială folosind Polymorphprep (Axis Shield PoC AS, Oslo, Norvegia), așa cum s-a descris anterior [26], și stocate la -80 ° C. ADN-ul a fost extras folosind Mini-Kit AllPrep ADN/ARN (Qiagen, Hilden, Germania). Concentrația ADN-ului a fost cuantificată cu kitul de analiză Quant-iT PicoGreen dsDNA (Invitrogen, Carlsbad, CA, SUA) și ADN genomic (2 μg) a fost transformat în bisulfit cu trusa de bisulfit EpiTect (Qiagen, Valencia, CA, SUA).
2.5. Profil de metilare determinat prin spectrometrie de masă MALDI-TOF
Profilurile de metilare a ADN-ului a cinci gene au fost analizate în PBMC: CD36, CD14, FADS1, PDK4, și FFAR3. Secvențele genomice studiate sunt prezentate în Tabelul 1S în materiale suplimentare disponibile online la http://dx.doi.org/10.1155/2014/675021.
În primul rând, a fost aleasă o regiune care acoperă 3 kb (2.000 de perechi de baze în amonte până la 1.000 de perechi de baze în aval de locul de pornire transcripțional) de la Gene Bank (http://www.ncbi.nlm.nih.gov/gene) pentru fiecare genă. Insulele CpG au fost identificate utilizând software-ul MethPrimer (http://www.urogene.org/methprimer/) [27]. În timp ce trei gene au arătat insulele CpG (CD14, PDK4, și FADS1), nici unul FFAR3 nici CD36 au arătat aceste regiuni bogate în dinucleotide CpG. Site-urile de legare a factorului de transcripție prevăzute au fost identificate cu software-ul AliBaba2 (http://www.gene-regulation.com/pub/programs/alibaba2/index.html) cu o omologie de 75%. Apoi, a fost aleasă o regiune de 300 până la 500 pb într-o insulă CpG și/sau bogată în factori de transcripție preziși pentru fiecare genă (Tabelul 1). Profilul de metilare al acestor gene a fost determinat de tehnologia MassARRAY EpiTyper de la Sequenom (Sequenom, San Diego, CA, SUA), care se bazează pe scindarea specifică bazei urmată de spectrometria de masă MALDI-TOF așa cum s-a descris anterior [28]. Primerii utilizați sunt raportați în Tabelul 1. Valorile metilării ADN-ului unor site-uri CpG nu au putut fi măsurate independent. Acesta este cazul siturilor CpG din apropiere și a siturilor CpG incluse în fragmente chimice similare după defalcarea enzimatică. Deci, au fost grupați împreună și au fost considerați ca un site CpG independent atunci când au fost analizați.
2.6. Analize statistice
Datele sunt prezentate ca medie ± SD și au fost analizate folosind SPSS 15.0 pentru Windows (SPSS, Chicago, IL, SUA). Un model liniar general cu măsuri repetate a fost realizat pentru a evalua impactul suplimentării orale (martor sau ulei de pește) asupra metilării ADN a CD36, FFAR3, CD14, PDK4, și FADS1 prin tratamentul de slăbire (linia de bază și punctul final). Pentru site-ul CpG +477 din gena CD36, am emis ipoteza că diferențele în greutatea corporală inițială pot afecta analiza statistică. Pentru a controla efectul greutății corporale, s-au efectuat analize statistice cu greutatea corporală de bază ca o covariabilă. Nivelul de semnificație a fost stabilit la
3. Rezultate
3.1. Profil de bază de metilare a ADN-ului
Recrutarea a fost efectuată în 2004 și 2005. Un total de 12 femei au fost selectate pentru prezentul studiu (Figura 1). Diferite tipare de metilare au fost găsite în genele studiate în PBMC (Figura 2). Au fost observate niveluri scăzute de metilare (mai puțin de 25% [29]) la genele care codifică molecula superficială CD14 iar enzimele metabolice PDK4 și FADS1, deși un CpG de PDK4 (-229-227) a fost puternic metilat (peste 75% [29]). CD36 regiunea studiată a fost foarte metilată, în timp ce FFAR3 au prezentat două regiuni distincte: o regiune foarte metilată apropiată de locul de început al transcripției (situsuri CpG -18, +33 și +77) și o regiune scăzută metilată între CpGs -53 și -202.
3.2. Tratamentul pierderii în greutate și efectele suplimentării cu ulei de pește asupra profilului de metilare a ADN-ului
Ambele grupuri experimentale (martor și ulei de pește) au răspuns similar tratamentului pentru scăderea în greutate (Tabelul 2), prezentând reduceri similare ale greutății corporale, ale IMC și ale nivelului seric de leptină (), dar fără efecte asupra altor parametri metabolici.
Scăderea în greutate indusă de dieta hipocalorică a afectat metilarea ADN în CD36 genă, reducând procentul de metilare a CpG +477 (Figura 3 (a)). Acest CpG se află într-un site de legare presupus pentru factorii de transcripție CREB și CRE-BP1 (Figura 2 (a), CpG +477). Cu toate acestea, suplimentarea cu ulei de pește nu a modificat modelul de metilare a ADN-ului CD36 genă, cu reduceri de 11,8% în metilarea CpG +477 în grupul martor și 7,3% în grupul cu ulei de pește. Pentru a controla efectul greutății corporale, starea de metilare a fost ajustată la greutatea corporală inițială. În acest caz, metilarea CpG +477 a fost mai mică () în grupul cu ulei de pește (6,7%) decât în grupul martor (12,7%).
). Metilarea ADN-ului a fost determinată la probele inițiale și finale de către MassARRAY EpiTyper în triplicat. Un model liniar general cu măsuri repetate a fost utilizat pentru a evalua impactul suplimentării orale asupra metilării ADN-ului (între subiecți) pe parcursul tratamentului de slăbire (la subiecți).
, diferențe datorate pierderii în greutate (valoarea inițială față de punctul final);
Restricția energetică a afectat și metilarea ADN-ului în CD14 (Figura 3 (c)), dar numai cu o creștere foarte ușoară de 0,3% și 0,6% la CpGs + 765 + 773 în grupele de control și, respectiv, cu ulei de pește. Aceste CpG sunt incluse într-un situs de legare presupus pentru factorii de transcripție USF și Sp1 (Figura 2 (c)).
Modificări semnificative statistic (deși mici) au fost, de asemenea, induse de pierderea în greutate indusă de dieta hipocalorică la promotorii de PDK4 și FADS1 gene (CpGs −254 și −25−22−20, respectiv, în figurile 3 (d) și 3 (e)). În plus, singurele CpG care au prezentat diferențe semnificative de metilare între grupurile martor și ulei de pește se află în aceste gene. Astfel, procentul de metilare a PDK4 Site-uri CpG −222 și −50 și FADS1 CpG −25−22−20 au fost reduse în grupul martor și crescute cu ulei de pește, în timp ce reducerea observată în PDK4 CpG -254 la controale a fost mai mare decât la grupul cu ulei de pește. Interesant, PDK4 CpGs -254 și -50 se află în site-uri de legare putative pentru factorul de transcripție Sp1 (Figura 2 (d)). Cu toate acestea, deși semnificative statistic, aceste diferențe au fost atât de mici încât probabil că nu influențează expresia genelor.
4. Discutie
Deși există dovezi puternice ale efectelor modulatorii ale n-3 PUFA asupra exprimării genelor la mai multe tipuri de celule la om, nu se știe dacă acestea ar putea acționa asupra expresiei genice prin modificarea mecanismului epigenetic al metilării ADN-ului. Aici am căutat să determinăm profilurile de metilare ale CD36, FFAR3, CD14, PDK4, și FADS1 în PBMC și dacă această metilare este afectată de o intervenție nutrițională de scădere în greutate (restricție de energie) cu sau fără supliment de ulei de pește la femeile tinere supraponderale. Așa cum era de așteptat, modificările fenotipice datorate restricției de energie au dus la o reducere a greutății corporale. La om, dietele cu restricție de energie modifică metilarea ADN-ului în PBMC [28]. Rezultatele noastre confirmă aceste constatări, sugerând că tratamentul de scădere în greutate induce mici modificări ale profilului de metilare a genelor specifice din celulele sanguine (adică., CD36, CD14, PDK4, și FADS1).
- JURNALUL UNUI SUPRAPONDERE - Obțineți un blog de dietă gratuit la
- Epidural la fel de eficient pentru femeile supraponderale
- Efectele clorhidratului de betahistină la femeile supraponderale - Vizualizare text complet
- A fi supraponderal vă face să arătați mai tânăr (pierderea în greutate, pierderea, pierderea) - Dieta și pierderea în greutate
- Exercițiu înainte de fertilizarea asistată la femeile supraponderale și obeze (FertilEX) protocolul de studiu