Alsu I. Zamaleeva
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Paris F-75005, Franța; E-mailuri: [email protected] (A.I.Z.); [email protected] (C.L.)
Guillaume Despras
2 Departamentul de chimie, École Normale Supérieure-PSL Research University, CNRS UMR 7203 LBM, 24, rue Lhomond, and Sorbonne University, UPMC Univ Paris 06 LBM, 4 place Jussieu, Paris F-75005, France; E-mailuri: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Camilla Luccardini
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Paris F-75005, Franța; E-mailuri: [email protected] (A.I.Z.); [email protected] (C.L.)
Mayeul Collot
2 Departamentul de chimie, École Normale Supérieure-PSL Research University, CNRS UMR 7203 LBM, 24, rue Lhomond, and Sorbonne University, UPMC Univ Paris 06 LBM, 4 place Jussieu, Paris F-75005, France; E-mailuri: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Michel de Waard
3 Inserm U836, Grenoble Neuroscience Institute, Research Group 3, LabEx Ion Channel Science and Therapeutics, Universitatea Joseph Fourier, BP170, Grenoble Cedex 09 38042, Franța; E-mail: [email protected]
Martin Oheim
4 Laborator de fiziologie a creierului, CNRS UMR 8118, Faculté des Sciences Fondamentales et Biomédicales, Fédération de Neurosciences FR3636, Paris Descartes University, PRES Sorbonne Paris Cité, Paris F-75006, France; E-mail: [email protected]
Jean-Maurice Mallet
2 Departamentul de chimie, École Normale Supérieure-PSL Research University, CNRS UMR 7203 LBM, 24, rue Lhomond, and Sorbonne University, UPMC Univ Paris 06 LBM, 4 place Jussieu, Paris F-75005, France; E-mailuri: ed.leik-inu.co@sarpsedg (G.D.); [email protected] (M.C.); [email protected] (J.-M.M.)
Anne Feltz
1 Ecole Normale Supérieure, Institut de Biologie de l'ENS (IBENS), Inserm U1024, CNRS UMR 8197, Paris F-75005, Franța; E-mailuri: [email protected] (A.I.Z.); [email protected] (C.L.)
Date asociate
Abstract
1. Introducere
Pentru a îndeplini mai bine condițiile de detectare a microdomeniului ionic, propunem aici utilizarea unei nanoparticule fluorescente și multifuncționalizate, care transportă mai multe molecule senzorice de ioni, precum și peptide cu penetrare celulară (CPP) pentru a facilita livrarea citoplasmatică a acestuia. Am folosit un punct cuantic comercial (QD), adică o particulă fluorescentă coloidală anorganică ca schelă centrală pentru biosenzorul nostru. Spectrul larg de absorbție, spectrul de emisie simetric bine definit și luminozitatea mare și rezistența ridicată la albire fotocalică în comparație cu fluoroforii organici cu molecule mici fac din QD donatori de energie buni pentru transferul de energie prin rezonanță de fluorescență (FRET) și facilitează detectarea QD-urilor unice în interior celule. Câteva molecule indicator ionice organice legate de suprafața QD acționează ca acceptori de energie fluorescentă. Eficiența FRET a acestui ansamblu este dată de suprapunerea spectrului de emisie al QD cu spectrul de absorbanță al indicatorului de ioni fluorescenți, precum și de numărul, orientarea și proximitatea acestora cu suprafața QD.
Raportăm aici sinteza, caracterizarea și validarea unei perechi de FRET pe bază de rubin QD/Ca (H) și demonstrăm că Rubinul Ca (H) legat titrează împotriva Ca 2+/protonii ca vopsea liberă în soluție. În cele din urmă, validăm atât in vitro, cât și in situ, o celulă bazată pe FRET care pătrunde nanobiosenzorul Ca 2+, precum și un nanobiosensor H + înghițit de calea endocitotică.
1.1. Material si metode
Chimia compușilor CaRuby1 și HRubies va fi găsită în [17] și, respectiv, [19]. Chimia CaRuby2 este descrisă în Informații suplimentare și documentată cu Schema S1 pentru strategia sintetică și Figurile S1 - S46 pentru caracterizarea intermediarilor de sinteză și a compușilor finali.
Majoritatea protocoalelor utilizate aici (pentru chimia suprafeței QD-urilor, condițiile pentru menținerea liniei celulare BHK care exprimă stabil NR2A-NMDAR și utilizarea lor pentru microscopia TIRF) au fost descrise anterior în Informațiile de susținere ale Zamaleeva și colab., 2014 [8] până la care se va referi la sinteza QD-urilor acoperite cu peptide, funcționalizarea QD-urilor și purificarea lor, cultura celulară a liniei celulare BHK care exprimă NR2-NMDAR și imagistica în celule a particulelor individuale utilizând microscopia TIRF. În principal descriem aici protocoalele relevante pentru studiul nanosenzorilor de pH pe bază de HRu-PiAC.
1.2. PEGilarea coloranților
PEGilarea CaRubies utilizând lanțul lateral pentru chimia clicurilor a fost detaliată de [8]. Aceeași procedură de PEGilare a fost urmată pentru HRu-PiAC.
1.3. Fluorimetre
Metodele utilizate pentru CaRubies2 au fost publicate anterior [18]. Pe scurt, intervalul dinamic CaRuby pentru detectarea Ca 2+ a fost estimat din vârful PL de CaRuby măsurat într-o soluție conținând (în mM) 100 KCl, 30 MOPS, unde [Ca 2+] a fost ajustat folosind kitul Invitrogen Ca Buffer (Life Technologies, ref: C-3008MP). Pentru titrarea HR-PiAC am utilizat tamponul universal de pH, vezi Suplimentarul 3, p. 830 în [20] care are o forță ionică aproape constantă în intervalul de 2 până la 12 pH. Curbele de fluorescență sunt corectate pentru sensibilitatea la pH a fluorescenței QD (a se vedea figura S3 pentru detalii). Spectrele de fluorescență FRET (500-700 nm) au fost obținute prin lumină de excitație la 407 nm, iar spectrele de emisie directă (550-700 nm) au fost obținute prin excitație la 545 nm. Toate valorile pentru perechile FRET au fost calculate, după amestecarea liniară spectrală, prin potrivirea la spectrele QD și Ca/HRuby (instrumentul de montare a curbei MatLab).
Microscopie confocală: Celulele placate au fost incubate cu nanosenzori de pH (la 100 nM QDs în mediu nutritiv DMEM fără ser) timp de 2 ore și apoi timp de 30 de minute cu 500 nM Lysotracker Green. După ce au fost spălate de două ori cu soluție salină tamponată cu fosfat (PBS) singură (Invitrogen, Cergy Pontoise, Franța), în cele din urmă a fost reintrodus un mediu DMEM tamponat HEPES. Celulele vii au fost apoi analizate imediat prin microscopie confocală cu scanare laser folosind un sistem de operare Zeiss LSM. Sondele de pH (561 nm) și verde Lysotracker (488 nm) au fost simultan excitate și a fost colectată fluorescența de emisie.
1.4. Calibrarea intracelulară a senzorilor de pH prin citometrie de flux
Calibrarea intracelulară a senzorilor de pH a fost efectuată utilizând linia celulară BHK-21. Celulele BHK confluente 80% placate au fost incubate cu 100 nM QDs timp de 1 oră în mediu fără antibiotice sau ser fetal de vițel, iar apoi celulele au fost lăsate să se odihnească într-un incubator (5% CO2, 37 ° C). După 2 ore, celulele au fost recoltate folosind enzima TrypLE TM Express (Gibco, Waltham, MA, SUA) și resuspendate într-un mediu independent de CO2 (Gibco, Marea Britanie).
Nigericina ionoforă K +/H + a fost utilizată pentru calibrarea intracelulară a senzorilor de pH. Împreună cu o concentrație ridicată de potasiu în tampon, egalizează pH-ul intracelular și extracelular. Celulele care conțin senzori de pH internalizați au fost resuspendate în tampoane conținând 143 mM KCl, 1,17 mM MgCl2, 1,3 mM CaCl2, 5 mM glucoză și 10 µM nigericină cu tampoane de pH definite variind de la pH 4,0 la pH 8,0 cu 0,5 increment. Apoi, acid citric 20 mM a fost utilizat pentru un domeniu tampon de pH 4,0–6,5 și 20 mM (acid 4- (2-hidroxietil) -1-piperazin etansulfonic) (HEPES) pentru tampoane în intervalul pH 7,0–8,0. S-a adăugat DAPI (4 ', 6-diamidino-2-fenilindol; 0,05 μM) pentru a exclude celulele moarte. După incubare timp de 5 minute la temperatura camerei probele au fost analizate printr-un citometru de flux (BD LSR Fortessa, BD Biosciences). Pentru achiziție, au fost utilizate lasere cu lungime de undă de 532 nm sau 405 nm pentru excitația directă H-Ruby sau respectiv FRET, iar fluorescența sa de emisie a fost colectată într-un canal de detectare spectrală de 610 ± 20 nm. De fiecare dată au fost achiziționate 10.000 de evenimente. Pentru analiză a fost utilizat un software FlowJo vX.0.7. S-a făcut mai întâi închiderea celulelor prin împrăștiere laterală/laterală, apoi s-a selectat o populație de celule vii și s-a determinat intensitatea medie a fluorescenței H-Rubin pentru fiecare probă.
2. Rezultate
2.1. De la principiu la un set de instrumente modular: construirea senzorilor de ioni pe bază de FRET
2.1.1. Principiu
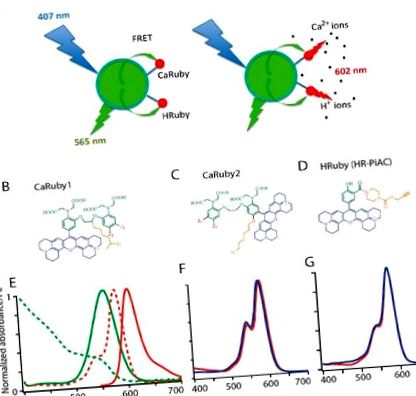
Am construit nanobiosenzori pe bază de FRET dintr-un donator central QD (D) și 1 până la 10 molecule de colorant acceptor (A) sensibil la ioni (Figura 1 A). Pentru acesta din urmă, am folosit membri ai familiei noastre personalizate de senzori Ca 2+ și H + Ruby cu spectre de absorbție și emisie care se potrivesc cu cele ale unui donator QD disponibil comercial, CANdot ® 565 și care conduc la o rază calculată de Förster de aproximativ 4,5. nm (presupunând cuplarea dipol - dipol și orientarea izotropă) indicând astfel un FRET eficient. Acceptorul fluorescent combină un fluorofor de rodamină extins, o grupă de chelare specifică ionului și un braț de legătură care permite conjugarea acestuia cu suprafața QD (Figura 1 B - D).
În sondele Rubin de calciu, în timp ce randamentul cuantic al fluorescenței ΦF crește la legarea Ca 2+, absorbanța sa rămâne neschimbată, astfel încât FRET între donator și acceptor este independent de legarea analitului și doar relatează excitația, ducând la o schimbare aparent mare a lui Stokes de 40 nm când este excitat în albastru (la 405-407 nm). Cu toate acestea, ΦF se schimbă de la o stare stinsă la o concentrație scăzută de analit, la o emisie sensibilă de un roșu intens aprins la o concentrație mai mare de analit. Eficiența FRET crește odată cu creșterea raportului A: D, așa cum era de așteptat pentru FRET multi-acceptor care oferă mai multe căi de deexcitație non-radiante și orientări acceptor pentru donatorul QD. Ca rezultat, la concentrații scăzute ale acceptorului, nanobiosenzorul poate fi localizat la excitația albastră și la detectarea emisiilor de QD verde/galben, iar concentrația analitului poate fi monitorizată peste 600 nm fie prin FRET, fie prin excitația directă a rubinilor de aproape 560 nm. Pentru un sistem multi-acceptor (cu A/D> 5), nanoparticulele sunt doar un purtător pentru concentrarea în sus a senzorului de ioni, iar fluorescența donatorului este atât de stinsă încât, chiar și la o concentrație scăzută de ioni în repaus, ansamblul poate să fie localizate numai prin emisia roșie.
2.1.2. Design senzor ionic
Am introdus recent o familie de indicatori de ioni cu emisie roșie funcționalizabili pe baza unei rodamine extinse (X-), care încorporează fie o porțiune de detectare Ca 2+ bazată pe BAPTA (brevet european, EP 13 194 728.5), fie o porțiune pe bază de fenol pentru detectarea H + (EP 13 199 575.5). În acești compuși (Figura 1 B - D), legarea ionilor la azotul BAPTA (pentru sondele Ca 2+, [21]) sau la fenolat (pentru sonda pH) blochează transferul fotoelectronului (PET) responsabil de fluorescență stingerea la o concentrație scăzută de ioni. Prin urmare, legarea ionilor duce la un fluorofor nestins la concentrație mare de analit. Pentru a permite fluorimetria la excitația cu o singură lungime de undă, precum și la imagistica cu doi fotoni, am reținut compuși care nu au nici o schimbare de absorbție atunci când concentrația de ioni este variată (Figura 1 F, G). În această etapă ne putem aștepta la aceeași curbă de calibrare pentru senzorul liber și pentru QD funcționalizat, cu excepția cazului în care fenomenele non-banale introduc efecte mai complicate.
2.1.3. Senzori Ca 2+
Toate rubinele de calciu (CaRuby) poartă (portocaliu, în figura 1 B, C) un braț distanțier azido pentru chimia clicului și potențialul rezultat pentru reacții de cuplare cu randament ridicat [22]. Acest braț lateral permite în mod eficient reacții de conjugare fără a utiliza grupările carboxilice ale fragmentului BAPTA [23] și conjugarea nu introduce, prin urmare, nicio perturbare semnificativă a afinității de legare a Ca 2+ [8].
O primă generație de CaRubies (denumită de acum înainte CaRuby1) a fost construită având brațul lateral atașat la puntea de etilen glicol dintre cele două inele aromatice ale BAPTA [15,16,17]. Aceste CaRubies au prezentat constante de disociere de la 3,4 la 21,6 µM, în funcție de substituțiile de halogenuri de pe inelele aromatice (Z1, Z2 în Figura 1 B, C). Pentru a crește în continuare afinitatea de legare a Ca 2+ a CaRuby, am introdus un atom de oxigen pe unul dintre inelele aromatice ale BAPTA printr-o reacție SNAr care servește și ca o legătură pentru brațul lateral azido în a doua generație de noi variante CaRuby, CaRuby2 ([18] și Figura 1 C). În plus, în ultimul caz, fluoroforul a fost plasat într-o poziție meta, astfel încât să-și reducă efectul asupra azotului chelator. Aceste modificări au dus la variante cu afinități sub-micromolare pentru legarea Ca 2+ și variind de la 0,26 µM pentru CaRuby-Nano [18], denumită acum CaRuby2-H (vezi Figura 1 B, C), 0,325 µM pentru CaRuby2-F și 1,71 µM pentru CaRuby2-Cl conducând la un interval total de 0,26 până la 22 µM acoperit între toate CaRubies.
Spectrele de absorbție și emisie ale CaRuby2-F sunt identice cu cele ale Caruby1-CH3 prezentate în Figura 1 E unde linia punctată roșie arată spectrul de emisie QD. Gama dinamică și QY ale CaRubies2 încă nepublicate sunt date mai jos în Tabelul 1 (vezi [17,18]) pentru CaRubies1 și respectiv CaRuby2-H). Important pentru aplicațiile fiziologice, acești senzori nu au prezentat sensibilitate la Mg 2+ și au fost slab dependenți de pH (Figura S1C - E; vezi și [17,21] pentru CaRubies1 și [16,18] pentru CaRuby2-H). Pe de altă parte, acești compuși sunt stinși de ioni Cu 2+ care, prin urmare, pot fi aplicați pentru stingerea moleculelor de coloranți extracelulari sau efectuarea experimentelor de calibrare.
tabelul 1
CaRu2-Cl și CaRu2-F caracteristici biofizice.
- GI Imaging Center United Gastroenterologists Ultrasunete CT scanate
- IMC crescut este asociat cu scăderea fluxului sanguin în cortexul prefrontal utilizând imagistica SPECT
- Caviar
- Calorii în ceapă brută - Informații despre calorii, grăsimi, carbohidrați, fibre și proteine SparkPeople
- Cayman jack calorii