S G Bouret
1 Institutul de cercetare Saban, Programul de neuroștiințe, Spitalul pentru copii din Los Angeles, Universitatea din California de Sud, Los Angeles, CA, SUA
2 Inserm, Centrul de cercetare Jean-Pierre Aubert, U837, Neurobese Lab, Universitatea Lille 2, Lille, Franța
Abstract
Introducere
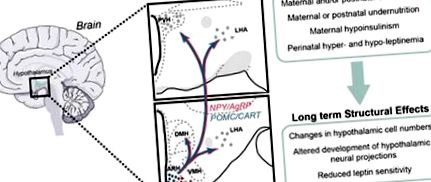
Programarea dezvoltării căilor legate de apetitul hipotalamic. Programarea dezvoltării sistemelor neuronale hipotalamice de către mediul perinatal reprezintă un posibil mecanism prin care modificările nutriției materne și/sau postnatale predispun descendenții la obezitate. Dezvoltarea ARH, care conține un subset de neuroni dedicați reglării metabolice, cum ar fi neuronii coexprimanți ai NPY și AgRP și neuronii care conțin POMC, pare extrem de sensibilă la schimbările din mediul nutrițional. Au fost observate defecte structurale în hipotalamusul animalelor supuse unui mediu nutrițional modificat, cum ar fi modificări ale numărului de celule, perturbare în formarea conexiunilor axonale și sensibilitate atenuată la leptină. Aceste efecte par a fi mediate, într-o oarecare măsură, de secreție anormală de leptină și/sau semnalizare în perioadele critice de dezvoltare fetală și/sau postnatală.
Datorită importanței hipotalamusului în reglarea alimentației și a echilibrului energetic, s-a sugerat că afectarea dezvoltării hipotalamice în timpul vieții perinatale poate duce la dereglare metabolică pe tot parcursul vieții (vezi referințele 6, 7, 10, 15, 16, 17 pentru revizuire ). Prezenta revizuire va rezuma modificările structurale și de dezvoltare care au fost observate în hipotalamus ca răspuns la schimbările din mediul nutrițional și hormonal timpuriu. În plus, discutăm cum modificările unei game variate de sisteme neuronale hipotalamice pot avea efecte durabile asupra reglării apetitului și a echilibrului energetic.
Perioade critice pentru dezvoltarea hipotalamică
Linii de timp ale dezvoltării hipotalamice. Formarea unui hipotalamus funcțional are loc în două faze majore: determinarea numărului de celule, care include neurogeneza, și formarea circuitelor funcționale, care include creșterea axonului și formarea sinapselor funcționale. La rozătoare, oameni și NHP, neurogeneza apare în primul rând în timpul gestației timpurii până la mijlocul perioadei. Cu toate acestea, importanța considerabilă a creșterii axonului hipotalamic postnatal la rozătoare diferă de cea la om și NHP, unde proiecțiile neuronale hipotalamice se dezvoltă aproape în întregime în timpul vieții fetale.
Împreună, aceste date indică faptul că hipotalamusul rozătorului se dezvoltă în două medii distincte: un mediu intra-utero în care se determină numărul de celule și un mediu extra-utero în care este stabilită conectivitatea neuronală hipotalamică. În schimb, hipotalamusul oamenilor și NHP se dezvoltă în primul rând în timpul vieții intrauterine. Aceste date sugerează, de asemenea, că întreruperea dezvoltării hipotalamice în aceste perioade importante de dezvoltare poate duce la anomalii hipotalamice structurale și funcționale severe.
Influențe prenatale
Obezitate maternă/hrănire bogată în grăsimi
Capacitatea obezității materne de a modifica proliferarea celulară în hipotalamusul în curs de dezvoltare a fost demonstrată recent la rozătoare. Hrănirea maternă cu conținut ridicat de grăsimi la șobolani crește proliferarea celulelor hipotalamice și are ca rezultat un număr mai mare de neuroni orexigenici în PVH și LHA, 38 incluzând galanină, encefalină, dinorfină, hormon concentrator de melanină și neuroni orexină. În general, studiile pe rozătoare au indicat că efectele adverse ale unui mediu obezogen matern sunt similare asupra numărului de celule hipotalamice atunci când apar fie în timpul gestației, fie în timpul gestației și alăptării. De exemplu, descendenții mamelor HFD încrucișate cu mamele control în timpul alăptării prezintă modificări similare în numărul de celule orexigenice și rezultatele metabolice comparativ cu puii crescuți de mamele HFD în timpul sarcinii și alăptării. 38
Deoarece multe modele animale de obezitate maternă sunt asociate cu hiperglicemie și rezistență la insulină, poate fi dificil să se determine dacă anomaliile de dezvoltare ale puilor născuți din baraje obeze sunt cauzate de modificări ale dietei barajelor sau dacă apar ca o consecință a Diabet. Manipularea nivelurilor de glucoză fără modificări ale dietei poate fi efectuată experimental prin injectarea streptozotocinei, care este o toxină a celulelor beta pancreatice. Folosind modelul animal streptozotocin, am descoperit recent că puii care se nasc din baraje diabetice neobeze au o reducere a densității fibrelor arexate orexigenice (AgRP) - și anorexigenice (aMSH) care inervează PVH. 46 Aceste date arată că numai diabetul matern poate provoca modificări structurale pe termen lung în hipotalamus.
Malnutriție prenatală/creștere modificată
O serie de rapoarte s-au concentrat, de asemenea, asupra efectelor malnutriției materne asupra dezvoltării hipotalamice. Au fost validate mai multe modele de rozătoare pentru întârzierea creșterii perinatale, cum ar fi rozătoarele născute de baraje care au fost restricționate în calorii (CR) sau proteine (PR) în timpul sarcinii și alăptării. Puii care sunt născuți și crescuți de mamele CR sau PR au o greutate mică la naștere și prezintă o creștere lentă în perioada de preînțărcare. În schimb, puii care sunt născuți în baraje CR sau PR, dar crescuți de mame care alăptează hrănite ad libitum prezintă o creștere rapidă a recuperării în timpul primei săptămâni postnatale. 47, 48, 49 Deși animalele adulte născute de mame subnutrite prezintă greutate corporală normală, acestea sunt hiperfagice, intolerante la glucoză și prezintă o sensibilitate crescută la DIO. 47, 49, 50
Spre deosebire de hrănirea maternă cu conținut ridicat de grăsimi, malnutriția maternă este asociată cu o reducere a numărului de neuroni orexigenici din hipotalamusul descendenților, inclusiv o reducere a neuronilor NPY-IR în ARH. 51 Cu toate acestea, rămâne de investigat dacă această modificare a numărului de celule neuronale este rezultatul unei reduceri a neurogenezei și a migrației celulare sau a unei creșteri a numărului de celule supuse apoptozei. Cu toate acestea, observația că grosimea plăcii corticale este redusă la făturile barajelor PR susține ideea că malnutriția maternă reduce proliferarea celulară în timpul vieții embrionare. 52 În plus, diferite gene implicate în dezvoltarea creierului, inclusiv proliferarea celulară și gene de diferențiere, sunt subregulate de PR materne. 49 Mai mult, astrocitogeneza, care urmează direct perioada neurogenă, este afectată de dieta maternă. La înțărcare, descendenții mamelor PR au un număr redus de astrocite și o reducere a raportului glia-neuron. Aceste constatări sunt deosebit de relevante datorită rolului raportat al celulelor gliale în dezvoltarea creierului și plasticitatea sinaptică. 54
Expunerea nou-născuților la un mediu lipsit de nutrienți afectează conectivitatea axonală hipotalamică. Densitatea fibrelor nervoase AgRP și POMC-IR din PVH este redusă la rozătoarele care se nasc în barajele CR sau PR. 49, 55 În plus, pentru animalele cu ritard de creștere intrauterin, momentul creșterii recuperării este un factor determinant important pentru dezvoltarea hipotalamică postnatală. Creșterea timpurie a recuperării ameliorează organizarea anormală a proiecțiilor neuronale hipotalamice și este extrem de benefică pentru markerii dezvoltării creierului, incluzând markerii de aderență celulară și alungirea axonului, în timp ce creșterea tardivă a recuperării cauzează efecte neurodezvoltare mai dăunătoare în hipotalamus. 49
Influențe postnatale
Supranutriția postnatală
Datorită importanței dezvoltării organelor postnatale, inclusiv a hipotalamusului, la rozătoare, au fost dezvoltate modele animale de programare metabolică postnatală pentru a viza în mod specific perioada postnatală. O abordare care s-a dovedit extrem de fructuoasă pentru studiul supraalimentării postnatale este reducerea dimensiunii deșeurilor. Puii crescuți în litere mici (SL) prezintă o creștere accelerată în perioada de preînțărcare. În consecință, puii crescuți în SL prezintă o greutate corporală mai mare încă de la vârsta de 2 săptămâni, iar aceste animale rămân mai grele pe tot parcursul vieții. 56, 57, 58 În plus, animalele supraalimentate postnatal prezintă creștere în greutate accelerată și exacerbată atunci când sunt hrănite cu HFD. 57
Supraalimentarea postnatală poate influența diverse procese de dezvoltare hipotalamice, inclusiv determinarea numărului de celule hipotalamice și conectivitatea neuronală. Șobolanii crescuți în SL prezintă un număr mai mare de neuroni care produc neuropeptida orexigenică galanină în PVH. 59 În plus, supraalimentarea postnatală afectează răspunsurile neuronale la neuropeptide. De exemplu, neuronii PVH ai puilor supraalimentați cronic s-au dovedit a afișa răspunsuri electrofiziologice reduse la neuropeptidele arcuate, cum ar fi NPY, AgRP, aMSH și CART. 60 O perturbare a dezvoltării proiecțiilor neuronale ARH a fost raportată și la animalele crescute în SL. Supranutriția cronică postnatală reduce excrescența axonilor AgRP și aMSH la PVH. 58
Malnutriție postnatală
Leptina ca potențial mecanism hormonal prin care nutriția perinatală programează dezvoltarea hipotalamică
Ferestre de oportunitate
Se știe că exercițiile fizice reduc greutatea corporală la persoanele obeze, inclusiv la oameni și la rozătoare. În mod remarcabil, doar 3 săptămâni de exerciții postînțărcare sunt suficiente pentru a reduce aportul de alimente și creșterea lentă în greutate la șobolanii DIO, iar aceste efecte s-au dovedit a persista la 10 săptămâni după încetarea efortului. Astfel, expunerea scurtă la exerciții fizice devreme în viață poate avea efecte benefice durabile asupra metabolismului la șobolanii DIO. Cu toate acestea, atunci când șobolanii obezi sunt expuși la exerciții la adulți, pierderea în greutate indusă de efort este tranzitorie, iar greutatea este recâștigată la încheierea exercițiului. 70 Aceste date ilustrează în plus importanța momentului intervenției.
Luate împreună, aceste date arată că perioada imediată de înțărcare și viața peripubertală sunt perioade importante pentru a proiecta studii intervenționale pentru ameliorarea și, sperăm, inversarea malprogramării metabolice a fătului și/sau nou-născutului.
Concluzie
Acum este bine acceptat faptul că o întrerupere a proceselor de neurodezvoltare poate duce la boli mai târziu în viață. Cercetările din ultimele decenii au furnizat informații valoroase cu privire la rolul nutriției perinatale în sensibilitatea la dezvoltarea bolii în viața adultă, inclusiv obezitatea. Acum există dovezi clare că schimbările nutriționale din timpul perioadelor critice ale vieții pot afecta, de asemenea, dezvoltarea sistemelor neuronale hipotalamice care sunt implicate în reglarea echilibrului energetic. Unul dintre mecanismele cheie ale programării metabolice a hipotalamusului este semnalizarea leptinei în timpul dezvoltării perinatale. Abordările care vizează îmbunătățirea și extinderea efectelor neurotrofice ale leptinei dincolo de perioadele critice neonatale ar permite strategii mai eficiente de promovare a cablării hipotalamice adecvate și ar putea oferi noi oportunități terapeutice.
Mulțumiri
Mulțumesc membrilor laboratorului meu pentru participarea activă la studiile discutate în această revizuire. Cercetarea în laboratorul meu a fost finanțată prin subvenții de la Institutul Național al Sănătății (Grant DK84142), „Fondation pour la Recherche Médicale” și Institut Danone, proiectul integrat UE FP7 (Acordul de subvenționare nr. 266408, „Full4Health”) și „Agenția Națională pentru Cercetare” (Granturi ANR-08-JCJC-0055-01 și ANR-11-BSV1-021-02).
Note
Autorul nu declară niciun conflict de interese.
- Suport nutrițional pentru copii în timpul bolilor critice European Society of Pediatric and Neonatal
- Dezvoltarea site-ului înțelepciune nutrițională; E-Commerce - SECOND WEST - Proiectare site-uri web; Dezvoltare,
- Câștigătorii concursului Placemat 2015-16 - Servicii de dezvoltare nutrițională
- Rolul experiențelor hormonale și nutriționale timpurii în modelarea comportamentului alimentar și hipotalamic
- Proprietățile nutriționale și funcționale ale datelor O recenzie Recenzii critice în știința alimentelor și