JoAnn Kerperien
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Désirée Veening-Griffioen
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Tjalling Wehkamp
2 Nutricia Research BV, Utrecht, Olanda
Betty C A M van Esch
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Gerard A Hoffman
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Paquita Cornelissen
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Louis Boon
3 Bioceros BV, Utrecht, Olanda
Prescilla V Jeurink
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Johan Garssen
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Leon M J Knippels
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Linette E M Willemsen
1 Divizia de Farmacologie, Departamentul de Științe Farmaceutice, Facultatea de Științe, Universitatea Utrecht, Utrecht, Olanda
Date asociate
Abstract
fundal
Oligozaharidele acide (GFA) derivate din galacto, cu lanț lung și cu catenă scurtă, nedigerabile din dietă, scad răspunsul efector la șoarecii alergici la laptele de vacă (CMA); și cutia furculiței P3 (Foxp3) - celulele T reglatoare pozitive (Tregs) s-au dovedit a contribui la acest lucru.
Obiectiv
Scopul acestui studiu a fost de a evalua contribuția interleukinei 10 (IL-10) și transformarea factorului de creștere β (TGF-β) la efectul protector al dietei GFA la șoarecii CMA.
Metode
Șoarecii C3H/HeOuJ femele, în vârstă de 3-4 săptămâni, au fost sensibilizați oral cu toxină holerică (Sham) sau zer și toxină holerică (Zer) 1 dată/săptămână timp de 5 săptămâni consecutive și au fost provocați cu zer 1 săptămână mai târziu. Șoarecii au fost hrăniți cu o dietă martor sau 1% GFA (9: 2: 1) (zer + GFA) începând cu 2 săptămâni înainte de prima sensibilizare. Într-un al doilea experiment, șoarecii au fost, de asemenea, injectați cu receptor αIL-10 (αIL-10r), αTGF-β sau anticorpi martor izotip 24 ore înainte de fiecare sensibilizare. S-au determinat răspunsul alergic acut al pielii, scorul de anafilaxie, IgE specific zerului, proteaza mastocitară mucoasă 1 (mMCP-1) și frecvența Treg în ganglionii limfatici mezenterici (MLN) și expresia mRNA intestinală Foxp3, Il10 și Tgfb.
Rezultate
La șoareci din zer + GFA, expresia mARN-ului intestinal Il10, Tgfb sau Foxp3 a fost de 2-10 ori mai mare (Cuvinte cheie P: alergie la laptele de vacă, oligozaharide nedigerabile, prevenire, celule T reglatoare, IL-10, TGF-β, model de șoarece
Introducere
Alergia la laptele de vacă (CMA) este una dintre cele mai frecvente alergii alimentare la copiii mici, afectând 2-3% dintre sugarii din întreaga lume (1-3). Majoritatea acestor copii dobândesc toleranță împotriva proteinelor din laptele de vacă cu vârste cuprinse între 3 și 5 ani (2, 4, 5). Cu toate acestea, copiii care au sau au avut CMA sunt predispuși să dezvolte alte alergii alimentare sau astm mai târziu în viață (6, 7). Există multe abordări diferite pentru a susține inducerea toleranței, care includ utilizarea componentelor dietetice specifice pentru a preveni dezvoltarea răspunsului alergic la proteinele din laptele de vacă. Eficacitatea unui amestec de oligozaharide acide (GFA) derivate din galacto, lanț lung și pectină cu lanț scurt a fost studiată la șoareci sensibilizați cu zer din proteine din laptele de vacă (1, 4). Aceste oligozaharide imită structural și funcțional aspectele specifice ale oligozaharidelor prezente în laptele uman și pot avea un efect pozitiv asupra sistemului imunitar și asupra creșterii bacteriilor benefice în intestin. Acestea pot preveni parțial simptomele CMA la șoareci și s-a demonstrat că reduc riscul apariției dermatitei atopice la sugari (8-11).
Când DC-urile înclină celulele T naive către un fenotip reglator pentru a induce toleranță activă periferică, citokinele IL-10 și TGF-β joacă un rol important (18). DC produc TGF-β în MLN și, împreună cu acidul retinoic, induc Foxp3 + Tregs (19, 20). Mai mult, Tregs secretă TGF-β, precum și IL-10 pentru a inhiba proliferarea și activarea altor celule imune (20). Atât IL-10, cât și TGF-β pot inhiba dezvoltarea și producția de citokine a celulelor T-helper și producția de citokine din mastocite (21). Pentru o prezentare mai completă a funcțiilor IL-10 și TGF-β, cititorul este trimis la Taylor și colab. (22) și du Pre și Samsom (23).
Pentru a stabili rolul IL-10 și TGF-β în toleranță în comparație cu alergia la alimente, au fost efectuate diferite studii. S-a demonstrat că splenocitele cultivate de șoareci tolerați oral produc concentrații semnificativ mai mari de IL-10 decât splenocitele șoarecilor alergici (24). Mai mult, injectarea IL-10 înainte de aplicarea unui alergen de contact specific a inhibat răspunsul alergic (25). Pentru TGF-β s-a arătat că adăugarea de TGF-β la laptele de formulă a condus la un profil imun benefic T-helper 1 într-un model de șobolan CMA în timpul alăptării și chiar și după înțărcare când șobolanii au fost recalificați (26). În plus, s-a demonstrat că TGF-β administrat oral într-un model de șoarece alergic OVA este activ în intestin și îmbunătățește inducerea toleranței orale (27). În plus, administrarea orală de TGF-β după înțărcare ar putea prelungi efectele benefice ale laptelui matern la șoarecii cu provocare OVA (28). Prin urmare, există mai multe indicații că IL-10 și TGF-β sunt importante în inducerea toleranței împotriva particulelor alimentare.
În prezent, nu se știe dacă efectul preventiv al oligozaharidelor nedigerabile din CMA apare prin interacțiuni indirecte cu microbiomul intestinal, interacțiuni directe ale celulelor cu celule epiteliale sau imune sau interacțiuni prin factori solubili precum IL-10 sau TGF-β local în intestin. Dintr-un experiment anterior care utilizează GFA-uri într-un cadru similar, avem o indicație puternică că GFA-urile ar putea acționa fie prin IL-10, fie prin TGF-β (29). În ultimul studiu, s-a observat o expresie a ARNm intestinului mai mare Il10 sau Tgfb la șoarecii alergici hrăniți cu GFA.
Scopul studiului actual a fost de a evalua contribuția IL-10 și TGF-β la efectul protector al dietei GFA în CMA. Prin urmare, TGF-β sau receptorul IL-10 (IL-10r) au fost neutralizați prin tratament anticorp specific înainte de fiecare sensibilizare orală pentru a determina dacă acest lucru ar putea abroga efectul protector al dietei GFA.
Metode
O dietă pe bază de AIN-93G fără proteine din lapte de vacă semisintetică (proteinele din lapte au fost înlocuite cu proteine din soia) a fost compusă și amestecată cu o suplimentare izocalorică de oligozaharide nedigerabile de către Research Diet Services (Wijk bij Duurstede). Un procent dintr-un amestec de galacto-oligozaharide cu lanț scurt, fructo-oligozaharide cu lanț lung și oligozaharide acide derivate din pectină (GFAs; 75,0%, 16,7% și respectiv 8,3%) a fost adăugat la dietă (17).
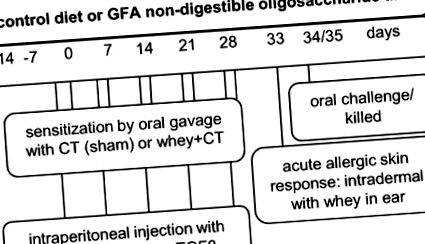
Model animal
Prezentare schematică a proiectelor experimentale. Prima configurare experimentală (datele prezentate în experimentul 1) a fost efectuată fără injecții cu anticorpi, în timp ce a doua configurare experimentală (datele prezentate în experimentul 2 și Figura suplimentară 1) a inclus injecții cu anticorpi. Protocolul de injecție intraperitoneală este prezentat în caseta gri scrisă cu negru. CT, toxina holerei; GFA, oligozaharidă acidă derivată din galacto cu lanț scurt, fructo cu lanț lung și pectină; αIL10r, receptor αIL-10.
Citometrie în flux
MLN-urile au fost îndepărtate, plasate pe gheață în Roswell Park Memorial Institute 1640/penicilină-streptomizină 1%, procesate printr-un filtru de 70 nm pentru a forma suspensie unicelulară și blocate timp de 30 de minute în PBS conținând 1% BSA și 5% căldură FBS inactivat. 1x10E6 Celulele au fost incubate la 4 ° C timp de 30 de minute cu CD8a-APC-Cy7; CD11c-PerCP-Cy5.5 și CD25-Pe-Cy7 au fost utilizate de la BD Biosciences și CD4-PerCP-Cy5.5, CD103-APC și Foxp3-APC de la eBiosciences sau de la controalele de izotipuri potrivite. Celulele colorate extracelulare au fost fixate cu utilizarea de 2% paraformaldehidă, iar colorarea intracelulară a fost efectuată conform instrucțiunilor producătorului (eBiosciences). Datele de citometrie în flux sunt prezentate ca procent din datele de control (Sham).
Imunohistochimie
Rulourile elvețiene ale intestinului subțire proximal au fost fixate în formalină neutră de 10% timp de ≥24 ore, iar secțiunile de parafină au fost încorporate cu utilizarea unui LeicaTP1020, biosistemele Leica, Amsterdam, Olanda. Prelucrarea țesuturilor și colorarea Foxp3 au fost efectuate în conformitate cu van den Elsen și colab. (31). Celulele Foxp3 + au fost numărate numai în vilozități și cripte atașate complet, iar numărul pe vilozitate/criptă sau unitate de criptă a fost calculat.
Un centimetru din intestinul subțire proximal și distal și colon a fost colectat la scurt timp după ucidere și depozitat în RNAlater (Qiagen GmbH) la 4 ° C până la prelucrarea ulterioară, care a fost descrisă anterior de Kerperien și colab. (29). Primeri validați pentru proteina ribozomală S13 (Rps13), Foxp3, Tgfb1 și Il10 au fost achiziționați de la SAbioscience (Qiagen). Nivelurile de ARNm au fost calculate cu software-ul CFX Manager (versiunea 1.6) și corectate pentru expresia Rps13 cu 100 × 2 (Rps13 - gena de interes), așa cum a fost descris anterior (32).
analize statistice
Răspunsul alergic acut al pielii la șoarecii simulați hrăniți cu o dietă martor sau la șoarecii sensibilizați la zer hrăniți cu o dietă martor sau GFA (experimentul 1). Răspunsul alergic acut al pielii a fost măsurat la 1 oră după injectarea intradermică cu zer în urechi. Valorile sunt medii ± SEM, n = 5-6. Mijloacele etichetate fără o literă comună diferă, P Figura 4 A). Răspunsul alergic acut al pielii semnificativ mai scăzut la șoarecii hrăniți cu dieta GFA a fost prevenit atunci când șoarecii din zer + GFA au fost tratați fie cu αIL-10r (zer + GFA + αIL-10r), fie cu αTGF-β (zer + GFA + αTGF-β) ( P Figura 4 A). Pentru scorul simptomului anafilactic, doar șoarecii izotici Whey + au prezentat șoc mai mare comparativ cu șoarecii izotip Sham + (P Figura 4 B). Scorul simptomului anafilactic nu a diferit între șoarecii sensibilizați la zer hrăniți cu dieta GFA tratați cu izotip (șoareci izotici Whey + GFA +) și Whey + GFA + αIL-10r sau Whey + GFA + αTGF-β. La 5 șoareci, nu s-a putut obține măsurarea grosimii urechii (1 în zer, 1 în zer + GFA, 2 în zer + αTGF-β, 1 în zer + GFA + αTGF-β); acestea au fost eliminate din analiză.
mMCP-1 și IgE specifică zerului, măsurată în serul șoarecilor fals, hrăniți cu o dietă martor și șoarecii sensibilizați la zer hrăniți cu o dietă martor sau GFA injectată cu un control izotipic sau cu un anticorp αIL-10r sau αTGFβ (experimentul 2). (A) mMCP-1 (ng/ml) și (B) zer-IgE-specific au fost măsurate în ser. Valorile sunt medii ± SEM, n = 7-10. Datele au fost analizate utilizând testul post-hoc ANOVA cu 1 factor și Bonferroni cu perechi preselectate, dacă este necesar. Transformarea jurnalului a fost utilizată pentru a normaliza distribuția datelor. Cercurile reprezintă valori aberante. * Diferit de fals (P Figura 6 A). Procentul relativ de CD4 + CD25 + Foxp3 + Tregs a fost semnificativ mai mare la izotipul Whey + GFA + comparativ cu șoarecii izotip Sham + (P Figura 6 B). Populația Treg la șoareci Whey + αIL-10r sau Whey + GFA + αIL-10r a fost semnificativ mai mare în comparație cu șoarecii izotip Sham + (P și diferit de zer + αIL-10r, P% diferit de zer + GFA + αIL-10r, P Figura 7 ). În partea proximală a intestinului subțire al șoarecilor izotici Whey + GFA +, numărul Foxp3 + nu a fost semnificativ mai mare decât la șoarecii izotip Sham +. Cu toate acestea, un număr semnificativ mai mare de celule Foxp3 + au fost numărate atât în grupul Whey + αIL-10r, cât și în grupul Whey + GFA + αIL-10r comparativ cu șoarecii izotipici Sham + (P Figura 7).
Celulele Foxp3 + din partea proximală a intestinului subțire (experimentul 2). (A) colorarea IHC a celulelor Foxp3 + din prima parte a intestinului șoarecilor fals hrăniți cu o dietă de control și șoarecilor sensibilizați la zer hrăniți cu o dietă martor sau GFA și tratați cu un izotip martor sau un anticorp αIL-10r sau αTGF-β la șoarecii sensibilizați la zer hrăniți cu o dietă martor tratată cu izotip (B) și la șoarecii sensibilizați la zer hrăniți cu o dietă martor tratați cu αIL-10r (C). Valorile sunt medii ± SEM, n = 3-4 (reprezentat ca Foxp3 + [n/(villus × crypt)]). * Diferit de fals, P și diferit de zer + αIL-10r, P% diferit de zer + GFA + αIL-10r, șoarecii knock-out P -/- nu au putut suprima activarea celulelor T efectoare (39). Prin urmare, Tregs care se dezvoltă în absența IL-10 au fost fenotipic normale, dar și-au pierdut funcția de supresie. Cu toate acestea, se știe că Tregs se dezvoltă în absența IL-10, care este dependentă de TGF-β (40). Într-adevăr, la șoarecii tratați cu αIL-10r populația de CD103 + DC a atins un procent mai mare și se știe că TGF-β contribuie la dezvoltarea acestor celule care sunt implicate în generarea Foxp3 + Tregs (19).
În plus față de posibilitatea ca Tregs să își piardă funcția de supresie la tratamentul cu αIL-10r, este posibil să fi blocat și IL-10r pe celulele efectoare țintă, făcându-le să nu răspundă la efectul IL-10. Într-adevăr, mMCP-1 derivat din mastocite mucoase a fost mai mare la șoarecii sensibilizați la zer alimentați cu dieta de control cu sau fără αIL-10r și la șoarecii alergici hrăniți cu dieta GFA și tratați cu anticorpul αIL-10r (P (577K, docx)
Mulțumiri
Responsabilitățile autorilor au fost următoarele - JK, LMJK și LEMW: au proiectat cercetarea; JK, DV-G, TW, BCAMvE, GAH și PC: a efectuat cercetarea; LB: materiale esențiale furnizate; JK, DV-G, PVJ, PC și LEMW: date analizate sau efectuate analize statistice; JK, DV-G, JG, LMJK și LEMW: a scris sau a citit critic manuscrisul; JK și LEMW: au avut responsabilitatea principală pentru conținutul final; și toți autorii: au citit și au aprobat manuscrisul final.
Note
Dezvăluiri ale autorului: JK, GAH, PC și LEMW, fără conflicte de interese. DV-G, TW și PVJ sunt angajați de Nutricia Research și raportează onorariile personale și sprijinul nefinanciar de la Nutricia Research în timpul desfășurării studiului. BCAMvE este parțial angajat de Nutricia Research și raportează onorariile personale și sprijinul nefinanciar de la Nutricia Research. LB este angajat de Bioceros, dar nu există niciun conflict de interese. JG este parțial angajat de Nutricia Research și raportează taxe personale și sprijin nefinanciar de la Nutricia Research în timpul desfășurării studiului; în plus, el are un brevet în curs pentru oligozaharidele nedigerabile pentru inducerea orală a toleranței împotriva proteinelor dietetice la Nutricia Research, Olanda. LMJK este angajat de Nutricia Research și raportează onorariile personale și sprijinul nefinanciar de la Nutricia Research în timpul desfășurării studiului; în plus, el are un brevet în curs pentru oligozaharidele nedigerabile pentru inducerea orală a toleranței împotriva proteinelor dietetice la Nutricia Research, Olanda.
- Efectul asupra sănătății noii diete nordice la adulți cu circumferința crescută a taliei la 6 luni randomizat
- Un meta-studiu masiv constată că majoritatea suplimentelor vitaminice nu au niciun efect asupra duratei vieții sau asupra sănătății inimii
- Cum are efect nutrițional sănătatea reproductivă FCNE
- Aflați mai multe despre Primerul de evaluare dietetică a efectului în fiecare zi
- Receptorul de leptină - Șobolanii Zucker obezi deficienți își reduc consumul de alimente ca răspuns la un sistemic