Proteinele SNARE sunt un grup de proteine care sunt critice pentru fuziunea membranei și exocitoza neurotransmițătorilor din celulă și includ sinaptobrevin (familia de proteine membranare asociate veziculelor [VAMP]), sintaxină și SNAP-25.
Termeni asociați:
- Exocitoza
- Sintaxina
- Enzime
- Membranele de fuziune
- Mutaţie
- Proteine
- Neuroni
- Plasma cu membrană
- Vezicule sinaptice
Descărcați în format PDF
Despre această pagină
Straturile lipidice planare (BLM) și aplicațiile lor
1. INTRODUCERE
Proteinele SNARE sunt motoare moleculare care conduc la fuziunea biologică a două membrane [1]. O parte a ansamblului motorului se află în membrana veziculelor (v-SNARE) și o parte se află în membrana țintă (t-SNARE) [2,3]. În timpul fuziunii, multe perechi potrivite de v- și t-SNARE se întrepătrund pentru a trage membranele opuse aproape astfel încât să se topească. Această amestecare evocă o imagine sugerată de acronimul proteinelor, SNARE. Cu toate acestea, este probabil ca această imagine să nu fie amintită de semnificația unui acronim. SNARE înseamnă receptor SNAP, SNAP înseamnă solubil NAtașament SF proteină, iar NSF reprezintă factorul sensibil la N-etilmaleimidă! Recent, a fost utilizată o utilizare mai puțin informativă, dar mai directă a acronimului SNARE: solubil N-factor de etilmale-imid-sensibil-Aproteina tachment receptori [1, 4-5] .
Înainte de a se produce fuziunea, vezicula este livrată către și se ancorează cu membrana țintă. Odată ce vezica este ancorată, proteinele SNARE pot fi activate pentru a contopi vezicula și membranele țintă împreună. Deși pașii de livrare și andocare sunt interesanți și sunt cercetați intens, pasul de fuziune este punctul central al acestui capitol. Fuziunea a două membrane este un proces care se pretinde investigației folosind principiile de electrofiziologie și tehnica membranei lipidice negre (BLM).
Cuplarea stimul-secreție în celulele acinare pancreatice
50.5.4 Proteine SNARE
Au fost identificate și alte proteine asociate SNARE și potențiale proteine care interacționează. Proteina modulatoare SNARE, Munc18c. a fost identificat în celulele acinare, localizat la membrana basolaterală și s-a arătat că se disociază ca răspuns la concentrații mari de CCK sau PKC. 347 Acest lucru a fost sugerat pentru a media secreția bazolaterală. Mai recent, s-a demonstrat că etanolul sporește acest efect. 350 Munc18b este cunoscut că interacționează cu sintaxina 2 și 3 și că este implicat în eliberarea amilazei din celulele parotide. Cab45b a fost identificat ca un partener de legare Munc18b și anticorpul împotriva Cab45b a inhibat eliberarea amilazei stimulate de Ca2+ în acini de șobolan permeabilizați SLO. 351 Un alt modulator SNARE, complexina 2, s-a arătat recent că modulează exocitoza ZG reglată de VAMP-2. 352 Alte proteine raportate pe ZG și care pot juca un rol în secreție includ proteina de șir de cisteină, 353 sincolină, 354.355 și subunitățile de proteine G heterotrimerice αq/11 237 și Gαo și Gαs. 238
Inferirea structurilor intermediarilor cinetici în exocitoza declanșată de Ca2 +
1 SNARE-uri
Proteinele SNARE constituie o familie numeroasă cu o gamă largă de funcții în diferite forme de trafic de membrană. SNARE-urile sinaptice, sinaptobrevina (VAMP), SNAP-25 și sintaxina sunt esențiale pentru exocitoza declanșată de Ca 2+ (Jahn & Scheller, 2006; Schiavo, Matteoli și Montecucco, 2000). Domeniile omoloage din aceste proteine ale ∼70 aminoacizilor se unesc pentru a forma un complex format din 4 α-elice paralele. Structura cristalină a acestui complex de către Sutton, Fassauer, Jahn și Brunger (1998) a avut o influență majoră asupra gândirii în acest domeniu. Această structură este un element esențial în majoritatea mecanismelor pe care cercetătorii le-au propus pentru exocitoză și a fost invocată de multe ori în modele de fuziune membranară. Cu toate acestea, aceste modele depind de unele probleme critice nerezolvate. În primul rând, dacă fuziunea este mediată de mai mult de un complex SNARE (adică un complex de complexe SNARE), atunci trebuie să cunoaștem numărul de complexe SNARE care se reunesc în timpul fuziunii unei vezicule. În al doilea rând, trebuie să cunoaștem relația dintre gradul de asamblare complexă SNARE și progresul fuziunii.
Studiile biochimice au arătat că complexele SNARE formează oligomeri cu greutate moleculară mare (Hayashi, Yamasaki, Nauenburg, Binz și Niemann, 1995; Hayashi și colab., 1994), ceea ce este în concordanță cu munca cooperativă în celule. Mai mult, schimbarea domeniului a fost raportată între complexele SNARE (Kweon și colab., 2002). O estimare timpurie a numărului de complexe SNARE necesare pentru fuziune s-a bazat pe dependența supralineară de concentrația inhibării de către un fragment sinaptobrevin care previne formarea complexului SNARE. Acest studiu a obținut o valoare de 3 (Y. Hua și Scheller, 2001), care a fost confirmat de un experiment strâns legat care implică concurență între formele funcționale și nefuncționale ale SNAP-25 (Mohrmann, de Wit, Verhage, Neher și Sorensen, 2010). Acțiunile toxinelor clostridiale, care scindează proteinele SNAP sinaptice, sugerează că numărul ar putea fi mult mai mare (Montecucco, Schiavo și Pantano, 2005). Aceste estimări bazate pe abruptitatea dependenței de concentrația SNARE ar trebui luate ca limite inferioare numărului real de complexe SNARE participante.
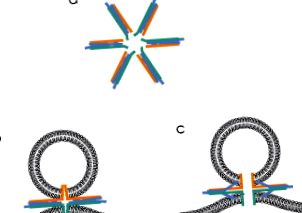
Testele de fuziune a lipozomilor au fost, de asemenea, utilizate pentru a estima numărul de complecși SNARE care conduc un eveniment de fuziune cu membrană. Un studiu a sugerat că numai un singur complex SNARE poate îndeplini această sarcină (van den Bogaart și colab., 2010), dar acești autori nu au evaluat rata de fuziune în funcție de numărul de SNARE pe veziculă. Alte studii în sisteme reconstituite au sugerat că sunt necesare mai multe (5-11, Karatekin și colab., 2010; 6-8, Domanska, Kiessling, Stein, Fasshauer și Tamm, 2009). Numărul real poate depinde de condiții; variațiile numărului de proteine per lipozom duc la rezultate diferite (Domanska, Kiessling și Tamm, 2010). Dacă sunt necesare mai multe complexe SNARE pentru fuziune, aranjamentul cel mai plauzibil ar fi cu fasciculele cu 4 spirale paralele cu planul membranelor de fuziune și care radiază spre exterior dintr-un focar central, precum spițele unei roți. Aceste proteine au ancore de membrană (discutate mai jos) și plasarea acestor motive în centrul focalizării ar concentra forțele generate de complexele SNARE pentru a maximiza capacitatea lor de a deforma membranele (Jackson, 2010) (Fig. 4 a). Într-adevăr, microscopia electronică a arătat că complexele SNARE izolate din creier formează agregate asemănătoare stelelor (Hohl și colab., 1998; Rickman, Hu, Carroll și Davletov, 2005).
Figura 4. Intermediarii de fuziune se bazează pe proteinele SNARE. (a) O configurație asemănătoare unei stele a complexelor SNARE, care probabil înconjoară un por de fuziune. (b) Un por de fuziune asemănător joncțiunii închise, format din ancorele membranei SNARE. (c) Un por de fuziune asemănător joncțiunii deschise. Notă: Creșterea membranei plasmatice către veziculă face din aceasta o structură hibridă. (A se vedea Insertul de culoare.)
Pe baza unei măsurări a conductanței porilor de fuziune, raza porilor a fost estimată sub presupunerea unei geometrii cilindrice simple a porilor (ecuația 1). Numărul de helice α necesare pentru căptușirea unui cilindru de această dimensiune a fost estimat la 5-8 (Han și colab., 2004; Z. Zhang, Zhang și colab., 2010). Aceste experimente oferă astfel o altă estimare a numărului de complexe SNARE care cooperează la declanșarea fuziunii, așa cum sa discutat mai sus. Reducerea fluxului de pori observată cu trunchierea C-terminală (Fang și colab., 2008) ar putea indica faptul că fluxul mai mic de pori de fuziune și rate mai mici de exocitoză rezultă din formarea porilor de fuziune din mai puțini complecși SNARE.
International Review of Cell and Molecular Biology
Cortney Chelise Winkle, Stephanie L. Gupton, în International Review of Cell and Molecular Biology, 2016
2.1.3 Sintaxine
Sintaxina t-SNARE-1 este exprimată în neuroni, se localizează la membranele plasmatice, formează un complex SNARE cu SNAP25 și VAMP2 și este implicată în eliberarea neurotransmițătorului (Söllner și colab., 1993a). Așa cum este cazul cu ștergerea SNAP25, ștergerea genetică a genei sintaxin1A (STX1A) nu este asociată cu diferențe neuroanatomice brute (Fujiwara, 2006). În schimb, tratamentul cu neurotoxină botulinică C (BoNTC1), care scindează atât SNAP25, cât și sintaxina 1, provoacă colapsul conului de creștere și inhibă creșterea neuritei în DRG-urile puiului și blochează creșterea neurită părtinită către o sursă asimetrică de netrin-1 în explanții hipocampici de șoarece (Cotrufo et. al., 2012; Hayashi și colab., 1994; Igarashi, 1996). Deoarece tratamentul cu BoNTA, care clivează SNAP25 și lasă sintaxina intactă, nu recapitulează aceste rezultate, sintaxina 1 este probabil necesară pentru o creștere preferențială către netrin, în timp ce un alt membru al familiei SNAP pare să compenseze pierderea funcției SNAP25.
Alți doi membri ai familiei sintaxinei, sintaxina 13 și sintaxina 16 au fost identificați în creierul în curs de dezvoltare (Chua și Tang, 2008; Hirling și colab., 2000). Sintaxina13 este implicată atât în exocitoză, cât și în traficul endosomal precoce de axoni și dendrite și este îmbogățit în zona de creștere a neuronilor corticali (Hirling și colab., 2000; Prekeris și colab., 1999). Deși nu este încă clar dacă sintaxina13 joacă un rol specific în creșterea neuritei în neuroni, supraexprimarea sintaxinei 13 în celulele PC12 crește creșterea neuritei. Având în vedere expresia sintaxinei13 în creier și localizarea specifică la procesele neurite, sintaxina13 poate juca un rol în expansiunea membranei plasmatice neuronale prin formarea de complexe cu SNAP25 și contribuind la expansiunea membranei plasmatice (Hirling și colab., 2000; Sarria și colab., 2002 ). Sintaxina 16 este îmbogățită în dendrite neuronale la avanposturile Golgi. Exprimarea unei variante negative negative a sintaxinei 16 inhibă creșterea neuritei în neuronii corticali de șoarece (Chua și Tang, 2008), sugerând un rol pentru sintaxina16 endogenă în neuritogeneză. Nu se știe dacă sintaxina 13 sau 16 joacă roluri redundante sau unice pentru sintaxina 1.
Membranele de fuziune
Interacțiuni proteine - proteine
Caracterizarea moleculară a răspunsurilor autofagice, partea A
J. Diao,. Q. Zhong, în Methods in Enzymology, 2017
3.3 Reconstituirea SNARE-urilor
Pentru proba de vezicule t-SNARE, amestecați sintaxina 17 și SNAP-29 (raport molar 1: 2 de sintaxină 17/SNAP-29) în tampon pentru vezicule care conține 1% în greutate OG prin agitare ușoară timp de 0,5-1 h la 25 ° C pentru a forma complex t-SNARE.
Reconstituiți proteinele t-SNARE (sintaxină 17/SNAP-29) și v-SNARE (VAMP8) cu vezicule lipidice care conțin coloranți lipofili la 1: 50-1: 200 raport proteină/lipidă în tampoane care conțin 0,8% în greutate soluție de detergent OG%. Pentru proba de amestecare a conținutului (numai vezicule v-SNARE), 50 mM sulforodamină B a fost dizolvată în soluție de proteină VAMP8 și amestecată cu v-vezicule care conțin 50 mM sulforodamină B la 1: 50-1: 200 raport proteină/lipidă în tampoane conținând 0,8 greutate% soluție de detergent OG. Păstrați proteinele și veziculele pe gheață. Protejați veziculele de expunerea la lumină.
Înfășurați tuburile cu folie și rotiți-le într-o cameră rece (4 ° C) timp de 30 de minute.
Pentru probele de amestecare a lipidelor, diluați amestecul de vezicule/proteine de două ori cu tampon pentru vezicule. Pentru proba de amestecare a conținutului (numai vezicule v-SNARE), diluați amestecul veziculă/proteină de două ori cu tampon pentru vezicule care conține 50 mM sulforodamină B. Vezicula care conține proteina SNARE se formează deoarece concentrația de OG este redusă sub concentrația critică de micelă.
Mutați soluțiile în tuburi de dializă prehidratate și dializați împotriva tamponului de dializă de 2 L (20 mM HEPES, 90 mM NaCl, 2 mM DTT, pH 7,4) timp de 10-12 ore, urmat de un alt tampon de dializă de 2 L timp de 4 h. Dializa trebuie efectuată la 4 ° C. Bio-margele SM-2 (Bio-Rad, Hercules, CA) ar putea fi utilizate pentru a elimina OG. Pentru proba de amestecare a conținutului (doar vezicule v-SNARE), înainte de etapa de dializă, veziculele v reformate ulterior și colorantul liber cu sulforodamină B au fost îndepărtate prin cromatografie de excludere a dimensiunii folosind o coloană Sepharose CL-4B.
Colectați veziculele dializate în tuburi de microfugă. Măsurați volumul pentru a calcula concentrația de lipide. Concentrația lipidelor se poate modifica datorită modificării volumului în timpul dializei. Probele de vezicule reconstituite cu proteine pot fi păstrate la 4 ° C și trebuie utilizate în termen de 3 zile.
Domenii C2 și fuziune de membrană
Sascha Martens, Harvey T. McMahon, în Subiecte actuale în membrane, 2011
IV Concluzie
În timp ce proteinele SNARE și sinaptotagminele sunt ambele implicate în cinetica fuziunii membranei și, prin urmare, în evenimentul de fuziune în sine există multe alte proteine accesorii care reglează probabil amplasarea situsului de fuziune, asamblarea complexelor de fuziune și a altor proteine poate participa, de asemenea, direct în evenimentul de fuziune. Astfel, proteinele care prezintă fenotipuri în ancorarea sau amorsarea fuziunii veziculelor nu pot fi excluse de la a juca un rol în etapele ulterioare. Într-adevăr, sinaptotagmin-1 a fost propus acum să joace un rol în andocare, fuziune și în deschiderea post-fuziune a porului de fuziune (colapsul veziculei). În cele din urmă, în timp ce fuziunea sinaptică a veziculelor este dependentă de Ca2+, multe alte evenimente de fuziune sunt constitutive și nu implică un declanșator Ca2+, dar sunt probabil probabil să necesite selecția identității membranei și amorsarea membranei de către proteinele accesorii ale complexului SNARE într-un proces analog mod către domeniile C2.
Volumul I
Reglarea exocitozei de calciu
Proteinele SNARE neuronale care sunt esențiale pentru exocitoza reglată sunt omologii neuroendocrini ai unei superfamilii proteice ai căror membri sunt necesari pentru traficul de membrană și reacțiile de fuziune în calea secretorie constitutivă. 121122 O caracteristică unică a veziculei neuronale sinaptice și a exocitozei endocrine a veziculelor dense este reglarea sa strânsă mediată de calciu citoplasmatic. 137.123.161 Așa cum s-a studiat în celulele neuroendocrine permeabile sau prin controlul nivelurilor de calciu din celulele intacte, exocitoza veziculară densă reglată este complet dependentă de calciu și este activată de concentrațiile ionilor de calciu în intervalul micromolar. 103.161 Secreția de hormon bazal în celulele endocrine intacte, care este detectată în absența secretagogilor, care este mediată de exocitoza veziculelor cu miez dens, mai degrabă decât de veziculele constitutive, 162 poate apărea din excursii de calciu citoplasmatic care depășesc pragul de activare a exocitozei.
Reglarea căii exocitotice a veziculelor cu miez dens prin calciu are loc în mai multe situri, inclusiv recrutarea granulelor, amorsarea, exocitoza, dilatarea porilor de fuziune și recuperarea membranei endocitice. Granulele gata de eliberare sunt epuizate prin stimulare puternică, iar reaprovizionarea bazinului gata de eliberare are loc în câteva minute după epuizare. 103.170 Ratele de completare a depozitului depind de calciu citoplasmatic la concentrații mai mici decât pragul pentru exocitoză. 171 Completarea bazinului dependent de calciu poate fi mediată prin activarea calciului protein kinazei C și a Munc-13. 157.170.172
Baza moleculară pentru diferențele de sensibilitate la calciu și cinetica exocitozei veziculare este neclară. Mai multe izoforme de sinaptotagmin care diferă în sensibilitatea la calciu sunt prezente pe diferite clase de vezicule și compoziții distincte pot conferi diferite sensibilități la calciu. 187 Synaptotagmins-1, -7 și -9 pe veziculele cu miez dens ar media probabil răspunsuri cinetice distincte la creșterile calciului. 182,188 Synaptotagmin-1 prezintă o afinitate scăzută, dar legarea rapidă de calciu, comparativ cu legarea lentă de afinitate mai mare, prezentată de synaptotagmin-7. 173.174 Granulele de celule PC12 suprarenale de șobolan conțin sinaptotagmine-1 și -9, 178, dar supraexpresia sinaptotagmin-7 crește sensibilitatea la calciu a exocitozei veziculelor cu nucleu dens, în concordanță cu ideea că compoziția isoformă a sinaptotagminului pe veziculele cu nucleu dens modelează răspunsul la calciu se ridică. 189 În plus față de sinaptotagminele, alte proteine care conțin domeniu C2 care leagă calciul, cum ar fi Doc2, contribuie la detectarea calciului pentru fuziunea veziculelor. 190.191
După fuziune, rata de dilatare a porilor de fuziune este reglată de nivelurile de calciu. 192 Studiile indică faptul că proteinele sinaptotagmin participă la formarea și dilatarea porilor de fuziune. 186,193,194 Dincolo de fuziune, recuperarea membranei granulare cu miez dens prin endocitoză este stimulată de calciu într-un proces dependent de calmodulină. 195 În endocitoza veziculei sinaptice, calcineurina, o proteină fosfatază dependentă de calmodulină, activată cu calciu, care defosforilează mai multe proteine implicate în endocitoză (dinamină, amfifizină, sinaptojanină), poate media regulamentul de recuperare a calciului. 196,197 Un mecanism similar poate sta la baza reglării calciului în recuperarea endocitică a membranei granulare cu miez dens, ale cărei componente sunt traficate înapoi către Golgi. S-a raportat, de asemenea, că Synaptotagmin-1 mediază aspecte ale endocitozei reglementate de calciu. 198.199 e cel mai frecvent
NSF și SNAP-uri ☆
SNARE-uri
Figura 1. Structura complexului SNARE (a) și Sec17 (b). (a) Helicele sunt colorate după cum urmează: sintaxină, roșu; VAMP, albastru; SNAP-25, verde. Sunt indicate pozițiile relative ale termenilor N și C.
- Atractivitatea fizică - o prezentare generală Subiecte ScienceDirect
- Pilocarpina - o prezentare generală Subiecte ScienceDirect
- Făină de secară - o prezentare generală Subiecte ScienceDirect
- Scutellospora - o prezentare generală a subiectelor ScienceDirect
- Antidepresivul de a doua generație - o prezentare generală a subiectelor ScienceDirect