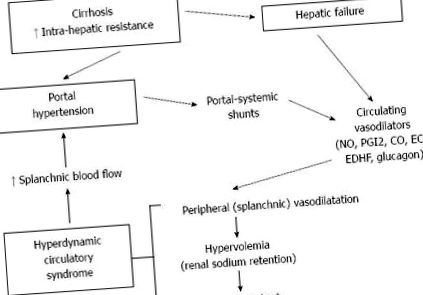
Tipul de bază: În ciroza, hipertensiunea portală se datorează unei creșteri a rezistenței intrahepatice și a fluxului sanguin splanchnic. Aceasta din urmă este secundară vasodilatației splanchnice arteriale și deschiderii circulației colaterale. Deși creșterea rezistenței intrahepatice este cea mai timpurie și cea mai importantă componentă, în prezent singurele regimuri de tratament disponibile pentru controlul hipertensiunii portale în ciroză, adică., beta-blocantele neselective, octreotida și terlipresina, acționează asupra componentei dinamice splanchnice. Astfel, înțelegerea mecanismelor care duc la vasodilatație splanchnică și la sindromul circulator hiperdinamic este esențială pentru tratamentul complicațiilor hipertensiunii portale.
- Citare: Bolognesi M, Di Pascoli M, Verardo A, Gatta A. Vasodilatație splanchnică și sindrom circulator hiperdinamic în ciroză. World J Gastroenterol 2014; 20 (10): 2555-2563
- URL:https://www.wjgnet.com/1007-9327/full/v20/i10/2555.htm
- DOI:https://dx.doi.org/10.3748/wjg.v20.i10.2555
Hipertensiunea portală este un sindrom clinic responsabil de apariția complicațiilor clinice grave, cum ar fi formarea și ruperea varicelor esofagiene și/sau gastrice, ascita și encefalopatia hepatică.
În ciroza, principalul mecanism responsabil de creșterea presiunii portal este creșterea rezistenței intrahepatice la fluxul sanguin portal.
Mecanismul pivot responsabil pentru rezistența crescută în ciroză este depunerea de colagen în acinusul hepatic cu îngustarea lumenului sinusoidal și o scădere consecventă a secțiunii transversale totale a sinusoidelor hepatice. O altă schimbare structurală responsabilă de creșterea rezistenței portalului intrahepatic este comprimarea venulelor centrilobulare prin regenerarea nodulilor, granuloamelor și inflamației portalului. Rolul principal al acestor modificări anatomice în determinarea creșterii presiunii portalului este confirmat de relațiile dintre grosimea septală, nodularitatea mică, rigiditatea ficatului și presiunea portalului [1, 2] .
În afară de componenta structurală, o componentă vasoactivă, potențial reversibilă, este implicată și în creșterea rezistenței hepatice [3]. În ciroză, tonul contractil al celulelor musculare netede și miofibroblaste, derivat din celulele stelate, în jurul sinusoidelor și venulelor hepatice este crescut [4]. Noradrenalina, substanța P, trombina, angiotensina II [5], endotelina (ET) [6] și prostanoizii [7] cresc tonul contractil al miofibroblastelor și, astfel, rezistența portală. Cu toate acestea, disfuncția endotelială este principala sursă a creșterii dinamice a rezistenței portalului intrahepatic [8]. O biodisponibilitate scăzută a oxidului nitric (NO) în sinusoide [8 - 11] și o producție crescută de prostanoide derivate cu ciclooxigenază (COX), cum ar fi prostaglandina H2 și tromboxanul A2 [7, 12], par a fi principalii jucători în endotelial disfuncție în ciroză.
În ciuda faptului că sunt cruciale pentru dezvoltarea modificărilor hemodinamice ale cirozei, mecanismele responsabile de creșterea rezistenței intra-hepatice nu vor fi analizate în detaliu în această revizuire, deoarece acestea depășesc scopul său.
Datorită creșterii rezistenței intra-hepatice, se poate aștepta o reducere a volumului fluxului sanguin portal în hipertensiunea portală. Cu toate acestea, în timp ce se detectează o dilatare a venei porte și o scădere a vitezei sanguine portal [13], acești pacienți se caracterizează printr-o creștere netă a fluxului portal, splenic și mezenteric.
Deschiderea circulației colaterale sistem-portal participă la creșterea fluxului de portal. Cu toate acestea, se poate observa și o vasodilatație arterială splanhnică primară, cu un flux sanguin splenic și mezenteric crescut.
Presiunea portalului rezultă din relația dintre volumul fluxului sanguin care intră în sistemul portal și rezistența la ieșirea sângelui portal. Expresia matematică a acestei relații este furnizată de formula lui Ohm: P = Q * S, unde P reprezintă schimbarea presiunii de-a lungul vasului, Q reprezintă fluxul sanguin și rezistența R la flux.
Creșterea rezistenței la fluxul portal este principalul factor determinant al hipertensiunii portale în ciroză [14, 15], dar o creștere a fluxului portal joacă, de asemenea, un rol. O astfel de creștere a fluxului total splanchnic [16, 17] a fost observată la pacienții cu ciroză și demonstrată în modele experimentale de hipertensiune portală [18, 19] .
În ficatul cu rezistență normală, o modificare a fluxului portal nu modifică presiunea portal [20] din cauza conformității vasculare ridicate a vasculaturii hepatice. Când rezistența portalului de ieșire este crescută și complianța vasculară este scăzută, o creștere a fluxului portal este responsabilă pentru o creștere a presiunii portalului. În ciroza, creșterea fluxului portal, care este declanșată de creșterea rezistenței la fluxul portal (vezi mai jos), menține și agravează hipertensiunea portal [21] .
Mai multe strategii terapeutice pentru hipertensiunea portal vizează scăderea presiunii portal prin scăderea fluxului portal, evidențiind astfel rolul patogen al fluxului portal.
Un mecanism care explică menținerea unui flux mare de portal în hipertensiunea portal este deschiderea colateralelor portal-sistemice, cauzată de creșterea rezistenței la ieșire din sistemul portal.
Deschiderea circulației colaterale are loc prin reperfuzia și dilatarea vaselor preexistente, dar și prin generarea de noi vase, așa cum a fost demonstrat prin studii experimentale care arată rolul factorilor angiogenetici precum factorul de creștere endotelial vascular (VEGF) în patogeneza circulația colaterală la șobolanii hipertensivi portal [22, 23] .
Șunturile sistem-portal sunt responsabile de hemoragia gastro-intestinală (în principal datorită ruperii varicelor esofagiene sau gastrice) și permit accesul la circulația sistemică a substanțelor care sunt de obicei îndepărtate de ficat. Acestea joacă un rol în patogeneza circulației hiperdinamice, a ascitei și a encefalopatiei hepatice [24]. .
În ciroza cu hipertensiune portală, creșterea fluxului sanguin splanchnic este cauzată de o vasodilatație a vaselor splanchnice arteriale, atât în paturile vasculare splenice, cât și mezenterice. În ultimii ani, mecanismele responsabile de reducerea rezistenței arteriale mezenterice în ciroză au fost investigate pe larg. Au fost propuse numeroase substanțe și sisteme ca posibili mediatori: glucagon [24 - 26], prostaciclină (PGI2), peptidă vasoactivă intestinală, histamină, substanță P, estrogeni, colecistokinină, amoniac, endotoxine, adenozină, acizi biliari [24], NO [ 27 - 29], peptida legată de gena alfa-calcitoninei [30], adrenomedullina [31, 32], VEGF [33], monoxid de carbon (CO) [34, 35], canabinoizi endogeni (EC) [24, 28]. Factorii endoteliali joacă cu siguranță un rol major [36] .
Rolul NO în vasodilatația splanchnică a pacienților cu ciroză și hipertensiune portală a fost ipotezat în urmă cu mai bine de 20 de ani [37] și în zilele noastre este considerat factorul pivot implicat în rezistența scăzută mezenterică a cirozei. NO are un timp de înjumătățire foarte scurt (20-30 s), se difuzează liber prin membrana celulară și acționează în principal prin creșterea producției de cGMP de guanilat ciclază cu relaxarea ulterioară a celulelor musculare netede. Biodisponibilitatea NU este crescută la pacienții cu ciroză și hipertensiune portală [38], în principal datorită unei activități crescute a formei constitutive a NO sintazei (eNOS).
Activitatea NOS este crescută în artera mezenterică superioară și aorta toracică a șobolanilor hipertensivi portal [39]. Reglarea ascendentă a eNOS poate fi detectată chiar și în fazele incipiente ale bolii la șobolanii hipertensivi portal [35]. Mai multe mecanisme par a fi responsabile pentru o astfel de creștere a activității eNOS. Citokinele inflamatorii, VEGF și forțele mecanice cum ar fi stresul de forfecare induc cascade de semnalizare pentru a activa Akt și proteina de șoc termic 90 (Hsp90) care, la rândul său, activează eNOS [40]. Translocarea bacteriană din intestin în ganglionii limfatici mezenterici este un alt mecanism timpuriu care crește factorul de necroză tumorală-alfa, cofactorul eNOS tetrahidrobiopterină și NO derivat din eNOS [41] .
În ciroza decompensată, de asemenea, forma inductibilă a NOS (iNOS) este reglată în sus în arterele mezenterice [42, 43], chiar dacă rolul său activ în biodisponibilitatea crescută a NO în patul vascular mezenteric nu a fost demonstrat în mod clar. NO este, de asemenea, un factor angiogen și poate juca un rol în angiogeneza splanhnică crescută care caracterizează șobolanii portal hipertensivi [44]. În ciroza experimentală cu hipertensiune portală angiogeneza mezenterică crescută poate fi inversată prin inhibarea cronică a formării NO [45] .
Cu toate acestea, NO/eNOS nu este singurul sistem implicat în vasodilatația mezenterică a cirozei. Într-adevăr, administrarea cronică a unui inhibitor NOS la șobolanii cirotici ascitici corectează doar parțial vasodilatația mezenterică [35, 43], implicând astfel alte sisteme vasoactive în scăderea rezistenței mezenterice. PGI2, un vasodilatator endogen produs de celulele endoteliale vasculare, este crescut la pacienții cu ciroză [46]. La șobolanii hipertensivi portal, s-a arătat o expresie îmbunătățită COX-1 în artera mezenterică superioară [47]. Inhibarea COX de către indometacină reduce presiunea portalului, îmbunătățește circulația hiperdinamică [48, 49] și reduce fluxul sanguin splanchnic [47] .
S-a observat că în artera mezenterică superioară a șobolanilor cirotici tratați atât cu inhibitori NOS, cât și cu inhibitori COX, un factor hiperpolarizant derivat din endoteliu (EDHF) poate înlocui NO și PGI2, inducând dilatarea arterială [50]. Natura exactă a EDHF este controversată; cu toate acestea, metaboliții acidului arahidonic, cationul K + și peroxidul de hidrogen sunt principalii candidați potențiali [51]. Un studiu realizat de grupul nostru a sugerat că, în ciroză, vasodilatația crescută independentă de NO/PGI2 a arterelor mezenterice se datorează, cel puțin parțial, reactivității excesive la acidul 11,12-epoxyeicosatrienoic printr-o expresie crescută a joncțiunilor gap-ului mioendotelial [52] .
EC sunt molecule omniprezente de semnalizare a lipidelor care determină efectele centrale și periferice prin receptorii specifici CB1 și CB2. Datele experimentale sugerează că EC contribuie la dezvoltarea vasodilatației splanchnice și a hipertensiunii portale prin supraactivarea receptorilor CB1 în vasculatura mezenterică [51, 57 - 59]. Efectele EC asupra vaselor splanchnice par a se datora atât creșterii producției de NO [57], cât și unui mecanism independent de NO, deoarece în arterele mezenterice izolate de la șobolani cirotici denudarea endotelială nu a abolit efectul vasodilatator [60] .
La pacienții cu afecțiuni hepatice cronice s-a observat și disfuncție autonomă, iar vasodilatația periferică este probabil o consecință a scăderii reactivității la sistemele vasoconstrictoare, precum sistemul nervos simpatic [61], vasopresina, angiotensina II și ET-1. Disfuncția autonomă a fost adesea atribuită neuropatiei legate de alcool, dar pot fi implicate și alte mecanisme, deoarece neuropatia este mai frecventă la utilizatorii cronici de alcool care suferă de leziuni hepatice decât la colegii lor fără leziuni hepatice [62]. O reglare descendentă sau o afinitate scăzută a receptorilor pentru vasoconstrictoare poate explica vasodilatația sistemică și splanchnică susținută care are loc în ciuda activării sistemelor vasoconstrictoare. În cele din urmă, o reglare descendentă sau o activare afectată a Rho kinazei indusă de vasoconstrictor poate reprezenta un alt mecanism care contribuie la contractilitatea defectuoasă a cirozei [63] .
În ciroza cu hipertensiune portală, creșterea fluxului de sânge mezenteric nu este singurul factor care determină creșterea fluxului de sânge portal, deoarece fluxul de sânge splenic este, de asemenea, îmbunătățit [64]. Într-adevăr, s-a observat că la pacienții cu ciroză și hipertensiune portală fluxul sanguin splenic crește într-o măsură mai mare decât fluxul mezenteric [65, 66]. În timp ce la subiecții sănătoși splina contribuie la fluxul sanguin portal doar pentru aproximativ 40% [24], la pacienții cu ciroză componenta splenică reprezintă mai mult de 50% din fluxul portal [67]. Această creștere a fluxului sanguin splenic a fost observată la pacienții cu ciroză și splenomegalie [64, 68]. Mai mult, există o corelație între dimensiunea splinei și diametrul venei porte [69, 70], fluxul sanguin splenic [71, 72] și fluxul sanguin portal [69, 73] .
Aceste date sugerează că în ciroza congestia splenică nu este un fenomen pasiv și splina contribuie activ la menținerea hipertensiunii portale prin congestia sistemului portal [17]. .
În ciroză, circulația hiperdinamică se caracterizează prin creșterea debitului cardiac și a ritmului cardiac și scăderea rezistenței vasculare sistemice cu tensiune arterială scăzută [74, 75]. Principala cauză a apariției sindromului este vasodilatația sistemică și splanchnică, care duce în cele din urmă la anomalii ale sistemului cardiovascular și la mai multe paturi vasculare regionale. Administrarea cronică a unui inhibitor NOS la șobolanii cirotici ascitici a normalizat complet parametrii circulației hiperdinamice [76], dar a corectat doar parțial vasodilatația mezenterică [35, 43]. Neuropeptida Y, un co-transmițător simpatic al norepinefrinei, a exercitat efecte hipotensive portale marcate și a ameliorat circulația hiperdinamică printr-o vasoconstricție splanhnică pronunțată și o reducere a fluxului sanguin splannic la șobolanii cirotici cu ascită [77] .
Circulația colaterală contribuie la dezvoltarea sindromului hiperdinamic, atât direct, prin reducerea rezistenței periferice, cât și indirect, permițând substanțelor vasoactive intestinale să ocolească ficatul și să ajungă la circulația sistemică. Mecanismele neurogene, biochimice și locale sunt, de asemenea, implicate în progresia sindromului [21]. Chiar dacă rezistența vasculară periferică și splanchnică generală este semnificativ redusă, o scădere a rezistenței nu este prezentă în toate paturile vasculare [78]. A fost observată o reducere a fluxului sanguin la rinichi [79 - 82], la creier [83 - 86] și la mușchi [87]. Cu cât boala hepatică și vasodilatația splanchnică se înrăutățesc, cu atât mai mult scade fluxul de sânge către alte organe [78]. Vasoconstricția renală este o consecință a hipovolemiei eficiente și a activării sistemelor neurohumorale, oferind rațiunea îmbunătățirii fluxului sanguin renal nu de către vasodilatatorii renali, ci prin perfuzie de albumină și vasoconstrictoare splanchnice precum terlipresina sau octreotida [88 - 91] .
La pacienții cu ciroză, un debit cardiac mai mare este asociat în mod independent cu un gradient de presiune venoasă hepatică mai mare și cu un flux sanguin hepatic [101]. În ciuda creșterii debitului cardiac inițial, răspunsul ventricular sistolic și diastolic la stres este estompat împreună cu hipertrofia sau dilatarea ventriculară și anomaliile electrofiziologice, cum ar fi intervalul QT prelungit. Următoarele mecanisme par a fi implicate în dezvoltarea cardiomiopatiei cirotice: o semnalizare β-adrenergică modificată [102, 103], o disfuncție a membranei cardiomiocitelor și o activare a substanțelor cardiodepresive precum NO, citokine și EC [104]. .
Mai multe strategii terapeutice pentru complicațiile de hipertensiune portală vizează scăderea presiunii portale prin scăderea fluxului portal, evidențiind astfel rolul patogen al vasodilatației splanchnice și al sindromului circulator hiperdinamic.
În cea mai recentă conferință Baveno (mai 2010), recomandările terapeutice pentru blocanții β neselectivi au inclus profilaxia primară a sângerării de varice gastro-esofagiene și prevenirea hemoragiei recurente [105]. Eficacitatea beta-blocantelor neselective la pacienții cu hipertensiune portală se datorează faptului că acestea cresc rezistența splanchnică și scad debitul cardiac, scăzând astfel fluxul portal [106] .
În ciroză, creșterea presiunii portale care este responsabilă pentru apariția complicațiilor, cum ar fi hemoragia gastro-intestinală, ascita, encefalopatia hepatică, sindromul hepato-renal, sindromul hepato-pulmonar și peritonita bacteriană spontană, se datorează nu numai unei rezistențe intrahepatice sporite la flux de sânge portal, dar și la creșterea fluxului de sânge splanchnic în sistemul vascular portal.
Creșterea fluxului sanguin splanchnic este determinată de o vasodilatație a vaselor splanchnice arteriale, atât în paturile vasculare splenice și mezenterice, cât și prin dezvoltarea circulației colaterale. Creșterea producției de NO în patul vascular splanchnic este considerată principalul factor care contribuie la vasodilatația splanchnic. Cu toate acestea, mai multe alte molecule, cum ar fi PGI2, EDHF, CO și EC joacă, de asemenea, un rol. Vasodilatația splanchnică duce la dezvoltarea sindromului circulator hiperdinamic, care se caracterizează prin creșterea debitului cardiac și a ritmului cardiac și scăderea rezistenței vasculare sistemice cu tensiune arterială scăzută. Înțelegerea fiziopatologiei vasodilatației splanchnice și a sindromului circulator hiperdinamic este esențială pentru prevenirea și tratamentul complicațiilor hipertensiunii portale.
P- Recenzori: Xie F, Kanda T, Singh V, Toso C S- Editor: Cui XM L- Editor: A E- Editor: Wang CH
- Riscul extinderii atrialului stâng la pacienții obezi cu sindrom de hipoventilație indusă de obezitate vs.
- NAFLD, NASH și ciroză și ficat gras explicat
- Sindromul pseudotumoral Cerebri cu rezoluție după întreruperea vitaminei A cu conținut dietetic
- Sindromul hipoventilației obezității Factori care contribuie - RTSleepWorld
- Sindromul Roemheld - FindZebra