Annette Brandt
1 Departamentul de Științe Nutritive, Științe Nutriționale Moleculare, Universitatea din Viena, A-1090 Viena, Austria; [email protected] (A.B.); [email protected] (A.J.E.)
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Cheng Jun Jin
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Katja Nolte
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Cathrin Sellmann
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Anna Janina Engstler
1 Departamentul de Științe Nutritive, Științe Nutriționale Moleculare, Universitatea din Viena, A-1090 Viena, Austria; [email protected] (A.B.); [email protected] (A.J.E.)
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Ina Bergheim
1 Departamentul de Științe Nutritive, Științe Nutriționale Moleculare, Universitatea din Viena, A-1090 Viena, Austria; [email protected] (A.B.); [email protected] (A.J.E.)
2 Institute of Nutritional Sciences, SD Model Systems of Molecular Nutrition, Friedrich-Schiller-University Jena, D-07743 Jena, Germania; moc.liamtoh@2002-ijiat (C.J.J.); ten.xmg@etloNajtaK (K.N.); ed.xmg@nnamlleSnirhtaC (C.S.)
Date asociate
Abstract
1. Introducere
Cu o prevalență variind de la
2% la 44% în populația europeană generală și
24% dintre adulții din America de Nord, boala hepatică grasă nealcoolică (NAFLD) este considerată a fi cea mai frecventă boală hepatică din lume până acum [1,2]. NAFLD cuprinde un spectru larg de boli, de la steatoza simplă la steatohepatită, ciroză și, în unele cazuri, chiar la carcinom hepatocelular [3]. Cu toate acestea, în ciuda eforturilor intense de cercetare, mecanismele moleculare care stau la baza dezvoltării NAFLD nu au fost încă clarificate. În consecință, opțiunile de tratament universal acceptate sunt, de asemenea, limitate, iar terapiile care vizează stilul de viață și tiparele dietetice cu rate de recidivă ridicate sunt în continuare strategiile de tratament la alegere [4].
Pornind de la acest context, scopul prezentului studiu a fost de a determina dacă o schimbare pe termen scurt a tiparului alimentar, de exemplu, aportul unei diete bogate în grăsimi, fructoză și colesterol (FFC) timp de doar patru zile, este suficientă pentru a provoca afectarea funcției barierei intestinale și apariția NAFLD. Studiul nostru urmărește în continuare să stabilească dacă un tratament cu doze terapeutice de antibiotice nerezorbabile paralele cu inducerea bolii protejează șoarecii de modificările barierei intestinale, de exemplu, pierderea proteinelor de joncțiune strânsă sau dacă protecția asociată tratamentului cu antibiotice este mai degrabă legată la eliminarea bacteriilor din intestin.
2. Materiale și metode
2.1. Animale și tratament
90% comparativ cu șoarecii tratați de vehicule. Consumul de dietă a fost evaluat zilnic și ajustat între grupuri astfel încât toate grupurile să primească aceeași cantitate de calorii. La sacrificare, șoarecii au fost anesteziați cu un amestec de ketamină (100 mg/kg greutate corporală) și xilazină (16 mg/kg greutate corporală) intraperitoneală. Sângele a fost obținut din vena portală. Porțiuni de ficat și intestin subțire (duoden și jejun) au fost fie înghețate imediat, fixate în formalină cu tampon neutru, înghețate fixate în mediul de montare cu temperatură optimă de tăiere (OCT) (Medite, Burgdorf, Germania) sau depozitate în RNAlater ® la -20 ° C (Sigma-Aldrich, Steinheim, Germania).
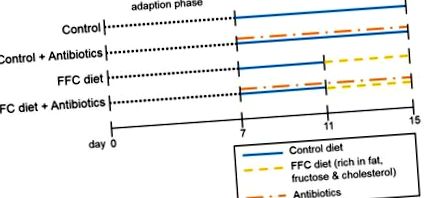
Rezumatul proiectării studiului. După adaptarea șoarecilor timp de 7 zile la aportul unei diete lichide urmată de 4 zile de pretratament cu antibiotice nerezorbabile (92 mg polimixină B/kg greutate corporală/zi și 216 mg neomicină/kg greutate corporală/zi) sau vehicul = apă) adăugate la dieta de control lichid, șoarecii (n = 6-8/grup) au fost fie hrăniți cu dieta de control lichid, fie cu o dietă bogată în grăsimi, fructoză și colesterol (FFC) ± antibiotice timp de încă 4 zile.
2.2. Evaluarea histologică a secțiunilor hepatice și a acumulării de lipide hepatice
Histologia ficatului a fost evaluată în secțiuni încorporate în parafină (4 μm) colorate cu hematoxilină și eozină (ambele Sigma-Aldrich, Steinheim, Germania) folosind scorul de activitate NAFLD (NAS) așa cum s-a descris anterior [16]. Secțiunile congelate de ficat fixate în OCT (10 µm) au fost colorate cu roșu ulei O (Sigma-Aldrich, Steinheim, Germania) așa cum s-a descris anterior [17]. Imagini reprezentative ale ambelor colorări au fost surprinse la o mărire de 200 × folosind un sistem încorporat într-un microscop (Leica DM4000 B LED, Leica, Wetzlar, Germania). Pentru a determina numărul de granulocite neutrofile din țesutul hepatic, secțiunile încorporate în parafină (4 μm) au fost colorate folosind un kit de nafthol AS-D cloracetat de esterază disponibil în comerț (Sigma-Aldrich, Steinheim, Germania). Numărul de neutrofile a fost cuantificat conform detaliilor anterioare [13]. Trigliceridele hepatice au fost extrase din întregul țesut hepatic și măsurate așa cum s-a descris anterior [13].
2.3. Parametrii sângelui pentru afectarea ficatului, ELISA și măsurarea endotoxinei
Activitatea transaminazei cu alanină plasmatică (ALT) a fost determinată folosind un test colorimetric într-un laborator de rutină la Spitalul Universitar din Jena, Germania (Arhitect, Abbott GmbH & Co. KG, Wiesbaden, Germania). Concentrația de proteine a inhibitorului activatorului plasminogen-1 (PAI-1) în omogenizat hepatic a fost determinată folosind un kit de testare a imunosorbentului enzimatic legat de șoarece PAI-1 (ELISA) (LOXO GmbH, Dossenheim, Germania) conform instrucțiunilor producătorului . Nivelurile de endotoxină din plasma portal au fost măsurate cu un test de lizat amebocit limulus disponibil în comerț (Charles River, Ecully, Franța) așa cum s-a descris anterior [13].
2.4. Colorare imunohistochimică pentru 4-HNE Proteine aductive și iNOS Protein în ficat, precum și 3-nitrotozină Proteine aductive, MMP-13, Occludin și ZO-1 Protein în intestinul subțire
2.5. Izolarea ARN și RT-PCR în timp real
ARN din ficat și din țesutul intestinal subțire a fost extras (peqGOLD Trifast, Peqlab, Erlangen, Germania) și ADNc a fost sintetizat utilizând un sistem de transcripție inversă (Promega GmbH, Madison, WI, SUA). Exprimarea acetil-CoA carboxilazei (ACC), a acidului gras sintază (FASN), a interleukinei-1β (Il-1β), a interleukinei-6 (Il-6), a receptorului de tip toll-4 (TLR-4), a stearoil-CoA desaturază-1 (SCD1), proteină de legare a elementelor de reglare a sterolului-1c (SREBP-1c), mNAr de răspuns primar de diferențiere mieloidă 88 (MyD88) mARN în ficat și metaloproteinază-matrice-9 (MMP-9) și mMP-13 în intestinul subțire a fost măsurat utilizând reacția în lanț a polimerazei în timp real (PCR), așa cum s-a detaliat anterior [14]. Exemple de secvențe sunt prezentate în Tabelul 1. Pentru determinarea cantității de gene țintă, a fost utilizată metoda CT comparativă și rezultatele au fost normalizate la referința endogenă 18S și relativ la un calibrator (2 −ΔΔCt).
tabelul 1
| 18S | GTA ACC CGT TGA ACC CCA TT | CCA TCC AAT CGG TAG TAG CG | > NR_003278 |
| ACC | CTT CCT CCT GAT CAG CAA CTC T | CGT GAG TTT TCC CAA AAT AAG C | > NM_133904 |
| FASN | TCT GGG CCA ACC TCA TTG GT | GAA GCT GGG GGT CCA TTG TG | > NM_007988 |
| Il-1β | TGG CTG TGG AGA AGC TGT GG | GTC CGA CAG CAC GAG GCT TT | > NM_008361 |
| Il-6 | CCA CGG CCT TCC CTA CTT CA | TGC AAG TGC ATC ATC GTT GTT C | > NM_001314054 |
| iNOS | CCC CTG GAA GTT TCT CTT CAA AGT C | GAT TCT GGA ACA TTC TGT GCT GTC C | > NM_010927 |
| MMP-13 | AGA AGT GTG ACC CAG CCC TA | GCG CAA GAA GAA TCT GTC TTT | > NM_008607 |
| MMP-9 | TGG TCT TCC CCA AAG ACC TG | GCG GTA CAA GTA TGC CTC TG | > NM_013599 |
| MyD88 | CAA AAG TGG GGT GCC TTT GC | AAA TCC ACA GTG CCC CCA GA | > NM_010851 |
| SCD1 | CCG ATA AAA GGG GGC TGA GG | TGC TGA GAT CGA GCG TGG AC | > NM_009127 |
| SREBP-1c | ACC GGC TAC TGC TGG ACT GC | AGA GCA AGA GGG TGC CAT CG | > NM_001313979 |
| TLR-4 | AGC CAT TGC TGC CAA CAT CA. | GCT GCC TCA GCA GGG ACT TC | > NM_021297 |
ACC: acetil-CoA carboxilaza; FASN: acizi grași sintaza; Il: interleukin; iNOS: oxid de azot inductibil sintază; MMP: metaloproteinază matricială; MyD88: gena de răspuns primar de diferențiere mieloidă 88; TLR: receptor asemănător taxei; SCD1: stearoil-CoA desaturază-1; SREBP-1c: proteina-1c care leagă elementul de reglare a sterolului.
2.6. Western Blot
2.7. Analize statistice
- Nutrienți Cafeteria full-text gratuit Hrănirea cu diete la șobolani tineri duce la steatoză hepatică și
- Sesamol cu text complet fără nutrienți ameliorează steatoza hepatică legată de obezitate prin activare
- Aportul nutrițional și calitatea generală a dietei la fotbalistele de sex feminin înainte de perioada concursului
- Momordica charantia îmbunătățește greutatea corporală și toleranța la glucoză la șoarecii hrăniți cu o dietă bogată în grăsimi
- Dieta obezogenă la șoareci în vârstă perturbă compoziția microbilor intestinali și modifică limfocitele neutrofile