Laetitia Everaere
1 Institut National de la Santé și de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
Saliha Ait Yahia
1 Institut National de la Santé et de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
Melody Bouté
1 Institut National de la Santé et de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
Camille Audousset
1 Institut National de la Santé et de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
5 Clinique des Maladies Respiratoires și Centre Hospitalier Régional și Universitaire de Lille, Lille, Franța,
Cécile Chenivesse
1 Institut National de la Santé et de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
5 Clinica Centrului Spitalului Regional pentru Tineret și Spital și Universitatea din Lille, Lille, Franța,
Anne Tsicopoulos
1 Institut National de la Santé et de la Recherche Médicale, Lille, Franța,
2 CNRS, UMR 8204, Centrul pentru Infecție și Imunitate din Lille, Lille, Franța,
3 Institutul Pasteur de Lille, Lille, Franța,
4 Universitatea din Lille, Lille, Franța,
5 Clinique des Maladies Respiratoires și Centre Hospitalier Régional și Universitaire de Lille, Lille, Franța,
rezumat
Abrevieri
Obezitate și astm
Contribuția răspunsurilor adaptive declanșate de modificări metabolice asupra dezvoltării ulterioare a astmului experimental rămâne controversată. Un răspuns Th17 este observat în ambele boli, 37, 38, 39, în timp ce răspunsul Th2 este 40, 41, 42 sau nu 43, 44 găsit în astmul indus de alergeni exacerbat de obezitatea indusă de dietă. Cu toate acestea, interleukina-33 (IL-33) și IL-25, două citokine pro-Th2 produse atât de celulele AT 45, 46, cât și de celulele epiteliale pulmonare 47, 48 pot activa celulele limfoide înnăscute din grupa 2 (ILC2). 49
Celule limfoide înnăscute
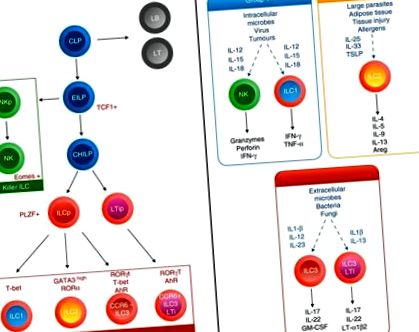
Celulele limfoide înnăscute au fost centrul unei investigații intense în ultimii 5 ani și au apărut ca jucători cheie în răspunsurile imune în diferite țesuturi, inclusiv AT visceral și plămân. 50, 51, 52 ILC-urile sunt în prezent împărțite în trei grupuri care sunt definite prin producția lor de citokine și prin expresia lor de factor de transcripție principală, în corelație ascuțită cu omologii T helper 49 (Fig. (Fig.1). 1). Cu toate acestea, spre deosebire de celulele T helper, ILC-urile nu exprimă receptori specifici antigenului și nu au markeri de linie celulară obișnuiți, ci răspund la semnale induse de daune precum alarminele și citokinele și pot modela răspunsul imun adaptiv.
Ontogenia și funcția descendențelor limfoide. În aval de progenitorul limfoid comun (CLP), progenitorul celular limfoid înnăscut (ILC) inițial (EILP) inițiază expresia TCF 1 și se poate diferenția fie în celule ucigașe naturale (NK), fie într-un ajutor comun Id2 ridicat - ca progenitor ILC (CHILP ). Conform expresiei sau nu a PLZF, va da naștere fie la toate subseturile ILC de tip helper, cum ar fi CCR 6 + ILC 3, fie la ILC 1, ILC 2 și CCR 6 - ILC 3. Citokinele de mediu, precum și transcripția diferențială ILC factorii își programează producția și funcția de citokine.
Grupul 1 ILC (ILC1), include un subgrup de celule natural killer (NK) și celule non-NK ILC1, care se disting printr-o combinație de markeri, inclusiv lipsa de expresie a CD127 și expresia eomilor pentru celulele NK mature. 53 Produc citokine interferon - γ (IFN - γ) și factor de necroză tumorală - α, exprimă factorul de transcripție T - bet și mediază răspunsurile imune la agenți patogeni și tumori ca răspuns la IL-12, IL-15 și IL-18. 54
Grupurile 2 ILC (ILC2) produc IL-4, IL-5, IL-13, IL-9 și amiregulină, exprimă factorii de transcripție GATA3 și receptorul orfan asociat RAR și mediază răspunsurile împotriva paraziților și alergenilor ca răspuns la IL-33, IL-25 și limfopoietina timică stromală (TSLP). 52
Grupa 3 ILC (ILC3) cuprinde diferite subgrupuri de celule, inclusiv la șoareci, inductori ai țesutului limfoid fetal CCR6 + (LTi) și celule asemănătoare LTi adulte și CCR6 - receptor citotoxic natural (NCR) + sau NCR - ILC3. La om, CCR6 + ILC3 sunt subdivizate în funcție de expresia lor de NKp44. Produc citokinele IL-17 și/sau IL-22, exprimă factorul de transcripție Receptorul orfan legat de retinoizi γt și receptorul de hidrocarburi arii și mediază imunitatea mucoasei împotriva infecțiilor bacteriene și fungice, în special la nivel intestinal, ca răspuns la IL- 1β și IL-23. 55
Toate subseturile ILC sunt dependente de semnalizarea comună a receptorilor lanțului γ și se dezvoltă dintr-un progenitor limfoid comun găsit în ficatul fetal și în măduva osoasă care va da naștere unui progenitor ILC timpuriu capabil să se diferențieze fie în celulele NK, fie prin intermediul reglarea inhibitorului factorului de transcripție al proteinei de legare a ADN-ului 2 (Id2), într-un progenitor ILC helper comun (CHILP) (Fig. (Fig.1). 1). Angajamentul din aval pentru diferitele linii ILC se realizează printr-o gamă largă de factori de transcripție, inclusiv factorul celulei T-1 (TCF-1), factorul nuclear IL-3 (NFIL-3), selecția timocitelor asociate HMG boxproteine (TOX), GATA ‐3 56, 57, 58, 59, 60 dând naștere fie degetului de zinc de leucemie pro - mielocitară (PLZF) care exprimă progenitor ILC (ILCP), 61, fie a unui precursor LTi. ILCP va genera toate subgrupurile ILC, cu excepția LTi - cum ar fi ILC3 (Fig. (Fig.1). 1). Interesant, ILCP a reușit să dea naștere la toate subseturile ILC, cu excepția IL-17 + ILC3 au fost recent descrise în sângele periferic la oameni, susținând un model de diferențiere a țesuturilor ca răspuns la indicii de mediu locali. 62
Studii transcriptomice recente au arătat că subseturile ILC prezintă un anumit grad de eterogenitate 63, 64, 65 și plasticitate permițând comutarea între subseturi în funcție în principal de mediul local de citokine. De exemplu, ILC1 poate evolua către ILC3 în prezența IL-2, IL-23 și IL-1β, iar celulele dendritice (DC) CD14 + pot diferenția ILC3 în ILC1. 66 ILC2 s-a dovedit, de asemenea, că se ridică la producătorul IFN-γ asemănător ILC1 în prezența IL-1, IL-12 și IL-18, 67, 68, 69 și ILC1 poate reveni la ILC2 în prezența IL-4 . 70 În plus, un potențial precursor ILC2 indus de IL-25 a fost raportat pentru a da naștere la celule similare ILC3 care produc IL-17. 71
Căile de reglementare joacă, de asemenea, un rol în controlul activării ILC2. IFN de tip I și II, precum și IL-27, sunt capabile să blocheze activarea ILC2 ca răspuns la IL-2, IL-25 și IL-33 printr-un traductor de semnal și activarea căii dependente de transcripție 1 (STAT1), 72, 73 deschiderea de noi căi pentru terapii specifice specifice.
Celulele limfoide în obezitate
Celule limfoide înnăscute (ILC) în țesutul adipos visceral. În condiții de homeostazie, țesutul adipos visceral este infiltrat de ILC 2 ca răspuns la interleukina-33 (IL-33) și IL-25 produse local. Prin producția lor de IL ‐5 și IL ‐13, activează pe de o parte eozinofile și, pe de altă parte, activează alternativ macrofagele de tip M2, ducând la apariția adipocitelor. Celulele T ucigașe naturale sunt, de asemenea, implicate în homeostazie prin activarea eozinofilelor și a celulelor T reglatoare. ILC 1 și ILC 3 sunt, de asemenea, prezente, deși funcția lor la momentul inițial este neclară. În obezitate, ILC 2 și potențial ILC 3 sunt scăzute, în timp ce ILC 1 sunt crescute ca răspuns la IL-12 produs local. ILC 1 activează macrofagele de tip M1 activate clasic care promovează rezistența la insulină asociată cu obezitatea. Putativ, scăderea numărului ILC 2 poate proveni dintr-o conversie a ILC 2 în ILC 1 sau din inhibarea ILC 2 de către ILC 1 și celulele ucigașe naturale prin producerea lor de interferon - γ.
Celulele limfoide în astm
În acord cu rolul ILC2 în răspunsurile de tip 2, 74, 91, 92 ILC2 contribuie la astmul experimental la alergeni precum papaina, alternaria sau acarianul de praf, inducând eozinofilie pulmonară, producerea de mucus și AHR, prin producția rapidă a IL ‐13 și IL-5, la stimularea prin IL-33, IL-25 sau TSLP derivate în principal din celulele epiteliale. 93, 94, 95, 96 La modelele de persistență a astmului cronic (mai mult de 6 luni), doar epuizarea ILC2, dar nu a celulelor T CD4, abrogă AHR susținut. 97 În plus, într-un model de inflamație a căilor respiratorii rezistente la cortico, corticosteroizii ar putea suprima celulele Th2, dar nu și ILC2, rezistența la corticoizi a ILC2 fiind indusă de TSLP. 98
Aceste observații au fost confirmate în astm la om. ILC2 sunt crescute în sângele periferic de la pacienții cu astm, 99, 100, 101, 102, precum și în spută, 102 și spălături bronhoalveolare, 97, 103 comparativ cu subiecții martor. Mai mult, frecvența ILC2 în sânge 100 de la pacienții astmatici a fost invers corelată cu testele funcției pulmonare, sugerând o legătură funcțională între ILC2 și severitatea astmului. ILC2 sunt, de asemenea, implicate în astmul rezistent la steroizi. Numărul de ILC2 și ILC2 producătoare de citokine tip 2 este semnificativ crescut în sângele periferic și în spută la pacienții sistemici dependenți de steroizi cu astm bronșic sever comparativ cu cei cu astm bronșic ușor. 102 În schimb, numărul CD4 producător de citokine tip 2 este similar între cele două grupuri, sugerând că ILC2, mai degrabă decât celulele T CD4 joacă un rol semnificativ în astmul rezistent la steroizi.
În mod remarcabil, cârpa -/- (fără celule T și B), dar nu cârpa -/- IL2rg -/- (fără T, B și ILC) sau cârpa -/- sărăcită în ILC, prezintă simptome asemănătoare induse de papaină, 95 sugerând că imunitatea adaptivă nu este esențială pentru dezvoltarea inflamației alergice.
Este posibil ca ILC să acționeze ca o sursă timpurie de citokine care să permită dezvoltarea imunității adaptive, așa cum sugerează studiile care arată sensibilizarea scăzută și diferențierea celulelor Th2 în absența ILC2 la modelele de inflamație alergică a căilor respiratorii. 104 Efectele majore ale epuizării ILC2 ar putea rezulta, de asemenea, din proprietățile lor de prezentare a antigenului restricționate MHC-II identificate și din producția ulterioară de IL-2 de către celulele T ducând la o creștere reciprocă a producției de citokine de tip 2. 105, 106 În concordanță cu aceasta, la inducerea inflamației alergice a căilor respiratorii, absența ILC2 la șoarecii himerici Rorα sg/sg din măduva osoasă are ca rezultat o scădere puternică a numărului de eozinofile de spălare bronhoalveolară, expresia pulmonară IL-13, precum și a nivelurilor de IgE . 107 Transferul adoptiv al celulelor T ILC2 și CD4 +, dar nu al fiecărei populații individuale, în șoareci Il7ra -/-, cărora le lipsesc atât celulele T, cât și ILC2, are ca rezultat un răspuns robust al citokinelor Th2 specific antigenului și inflamația căilor respiratorii. 108 În plus, producția de IL-13 de către ILC2 în timpul unui răspuns de rechemare induce interferon - factor de reglementare - 4 - exprimând DC în plămâni capabil să conducă acumularea de celule Th2 de memorie. 109
ILC2 poate fi reglat în timpul inflamației alergice pulmonare într-un mod pozitiv sau negativ. De exemplu, IL-4 derivat din bazofil activează ILC2 pulmonar, 110 în timp ce mastocitele activate IL-33 extind celule T reglatoare care suprimă activarea ILC2. 111 În inflamația pulmonară indusă de alternativă, IL-27 poate inhiba celulele ILC2 rezidente în țesut, dar nu celulele Th2. 73 În cele din urmă, mediatorii lipidici precum cisteinil leucotrienele, prostaglandinele și lipoxinele pot, de asemenea, să activeze sau să inhibe ILC2. 112, 113, 114
Pe lângă ILC2, o lucrare recentă a demonstrat că NCR-ILC3 sunt induse și în plămânii șoarecilor cu inflamația căilor respiratorii indusă de acarianul prafului de casă. 42 La om, ILC3 producătoare de IL-17 au fost identificate în lichidul de lavaj bronhoalveolar de la pacienții cu astm. 115 Pentru ILC1, nicio lucrare nu a evaluat încă rolul lor potențial în astm, cu excepția celulelor NK, al căror scop principal este încă neclar.
În total, ILC2 pulmonar și, eventual, ILC3 joacă un rol esențial în inițierea, exacerbarea și cronicizarea astmului (Fig. (Fig.3), 3), spre deosebire de obezitate, unde AT ILC2 sunt benefice pentru homeostazia metabolică. Cu toate acestea, obezitatea este asociată cu un risc crescut de astm și severitate.
Celulele limfoide înnăscute (ILC) în inflamația alergică a căilor respiratorii. Ca răspuns la alergenii de tip protează, celulele epiteliale ale căilor respiratorii eliberează citokine precum interleukina - 25 (IL ‐25), IL 33, limfopoietina timică stromală (TSLP) și IL ‐ 1β, care toate activează ILC 2. ILC 2 activat produce tip 2 citokine, cum ar fi IL-4, IL-5, IL-9 și IL-13. Apoi activează celulele T helper tip 2 (Th2) fie direct, prin expresia MHCII, fie prin celule dendritice. În ansamblu, citokinele eliberate promovează diferitele caracteristici ale astmului, inclusiv hiper-receptivitatea căilor respiratorii, acumularea eozinofilelor și producția de IgE. IL-1β produs de celulele epiteliale sau macrofagele alveolare poate activa, de asemenea, ILC 3, ducând la producerea de IL-17, promovând recrutarea neutrofilelor. ILC 3 poate, de asemenea, să activeze celulele Th17.
Celula limfoidă: o legătură între obezitate și astm?
Unele descoperiri sugerează că ILC sunt, de asemenea, implicate în inflamația alergică a căilor respiratorii asociate obezității. Un număr crescut de ILC3 a fost găsit în plămânii șoarecilor obezi hrăniți cu o dietă bogată în grăsimi, în comparație cu șoarecii slabi. 119 Acești șoareci obezi au prezentat AHR în absența provocării cu alergeni, care era independentă de imunitatea adaptativă, dar în raport cu IL-17 derivat din ILC3. Într-adevăr, AHR indusă de obezitate a fost scăzută la șoarecii IL-17 -/- sau șoareci cârpă// - epuizați în ILC și restaurată prin transfer ILC3. Producția de interleukină-17 de către ILC3 a fost dependentă de inflammasomul Nlrp3 stimulat de IL-1β derivat din macrofage. 115 De asemenea, s-a demonstrat că expunerea la ozon duce la creșterea AHR la șoarecii obezi comparativ cu șoarecii slabi. Acest efect a fost indus prin creșterea IL-33 și prin inducerea ILC2 producătoare de IL-13. 116
Redistribuirea celulelor limfoide înnăscute (ILC) în obezitate: o legătură cu astmul? Un mecanism ipotetic. La momentul inițial, ILC 2 și ILC 3 sunt scăzute în țesutul adipos (AT), dar prezente în țesutul pulmonar de la șoareci obezi, potențial prin redistribuirea ILC de la AT la plămâni sub efectul interleukinei - 1β (IL ‐ 1β). Acest lucru duce la o infiltrare mică de eozinofile în țesutul pulmonar al șoarecilor obezi. În contextul inflamației alergice a căilor respiratorii, există o creștere suplimentară a ILC 2 și ILC 3 la nivelul plămânilor, care ar putea proveni parțial din țesutul adipos, dar și putativ din măduva osoasă și din progenitori circulanți atrași de producția de IL - 33 și IL ‐1β induse de provocarea cu alergeni. Această creștere determină acumularea în continuare a eozinofilelor, activarea celulelor Th2 și Th17 potențial prin prezentarea antigenului și agravarea caracteristicilor astmului.
În alte studii experimentale privind obezitatea urmate de provocarea cu alergeni, creșterea eozinofiliei măduvei osoase și modificări ale traficului de eozinofile către căile respiratorii în dieta bogată în grăsimi și modele genetice de obezitate 40, 125, au sugerat că un astfel de trafic modificat poate participa în dezvoltarea astmului. În condițiile de stimulare a alergenilor, care declanșează producerea de IL-33 în plămâni, surse suplimentare de ILC pot fi recrutate în plămâni, cum ar fi progenitori ILC circulanți, descriși recent la om, 62 sau progenitori ai măduvei osoase (Fig. (Fig. 4 4). În total, infiltrarea bazală a ILC2 și ILC3 în plămânul șoarecilor obezi ar oferi cadrul pentru agravarea astmului în caz de alergen.
Deși ipoteza migrației așteaptă investigații suplimentare, aceasta poate încuraja noi strategii terapeutice, cum ar fi redirecționarea ILC2 către AT. Într-adevăr, semnul distinctiv al ILC este activarea rapidă și independentă de antigen, stabilindu-i ca orchestratori supuși ai răspunsurilor adaptative și, ca atare, sunt ținte terapeutice interesante.
Dezvăluiri
Autorii declară că nu au interese concurente.
- Celulele limfoide înnăscute în inducerea obezității - ScienceDirect
- Disfuncția metabolică poate exacerba astmul la adulții cu obezitate
- Epidemia de obezitate din Samoa este un vestitor pentru alte națiuni în curs de dezvoltare The NPR Salt
- Cât de rea este obezitatea copilului AFC Îngrijire urgentă
- Cum vă afectează personalitatea riscul de obezitate