Svetlana Kochetova
Institutul de chimie generală și anorganică Vernadsky, bulevardul Palladin 32/34, Kiev, 03142 Ucraina
Anastasiya Savchuk
Institutul de chimie generală și anorganică Vernadsky, bulevardul Palladin 32/34, Kiev, 03142 Ucraina
Dmytro Shakhnin
Institutul de chimie generală și anorganică Vernadsky, bulevardul Palladin 32/34, Kiev, 03142 Ucraina
Viktor Malyshev
Institutul de chimie generală și anorganică Vernadsky, bulevardul Palladin 32/34, Kiev, 03142 Ucraina
Abstract
A fost investigat comportamentul electrochimic al rodiului la carbamidă-clorură de temperatură scăzută și acetamidă-clorură. S-a constatat că, în timpul dizolvării anodice de rodiu în carbamidă și acetamidă care conține clorură se topește, se produc complexe mixte [Rh (NH3) 4Cl2] + de simetrie cvasi-octaedrică D4h. Au fost studiate compoziția și structura ionilor complexi născuți. În timpul reducerii electrochimice a complexelor [Rh (NH3) 4Cl2] +, s-a realizat sinteza nanoparticulelor Rh, precum și a nano-acoperirilor Fe, Cu și Mo.
fundal
Nanoparticulele și materialele bazate pe ele prezintă proprietăți electrice, chimice, magnetice, optice, catalitice și alte proprietăți unice. De aceea astfel de studii primesc o atenție considerabilă [Bychkova [1], Gusev și Rempel [2] și Beloglazkina și colab. [3]]. În legătură cu o gamă largă de aplicații nanocompozite în tehnologiile moderne și știința materialelor, se dezvoltă metode pentru sinteza lor [Olenin și Lisichkin [4]]. O mare importanță în soluționarea acestei probleme sunt metodele de reducere electrochimică a complexelor metalice în topituri la temperatură scăzută. Dezvoltarea metodelor de sinteză a nanoparticulelor metalice în topituri ion-organice la temperatură scăzută cu utilizarea de compuși complecși contribuie la crearea de noi tehnologii de producție a acestora.
Această lucrare este dedicată sintezei electrochimice a compușilor care conțin rodiu complex în topituri ion-organice pe bază de uree și acetamidă, investigarea amănunțită a proprietăților și structurii acestora folosind metode spectroscopice și realizarea depunerii catodice a acoperirilor nanostructurate de rodiu pe diferite substraturi metalice.
Metode
Pentru a determina proprietățile electrochimice ale solventului topit și pentru a studia comportamentul electrochimic al Rh în topiturile care conțin carbamidă și acetamidă, metoda voltametriei ciclice a fost aleasă folosind potențiostat PI-50-1.1. Ca anod, a fost utilizată placa metalică investigată, iar electrodul auxiliar a fost o tijă de platină. Ca electrod de referință, s-a folosit jumătate de celulă Ag/Ag +. Studiile au fost efectuate în intervalul de temperatură 80-130 ° C sub argon.
Pentru a determina starea ionilor metalici din topituri după dizolvarea electrochimică și, de asemenea, pentru a determina structura și compoziția complexelor formate cu componentele topiturii, au fost utilizate următoarele metode spectroscopice: spectroscopie electronică de absorbție (EAS) în timpul electrolizei Specord UV/VIS), spectroscopie în infraroșu a solidificat rapid după topirea electrolizei (cu Specord M-80) și cromatografie gazoasă (cu LCM-80).
Compoziția de depozit metalic obținută a fost determinată prin metoda de analiză a fazei cu raze X (cu aparat DRON-3) și structura depozitului prin metode de microscopie electronică de transmisie (cu JEOL-100) și de microscopie electronică de scanare (cu REM-101).
Rezultate si discutii
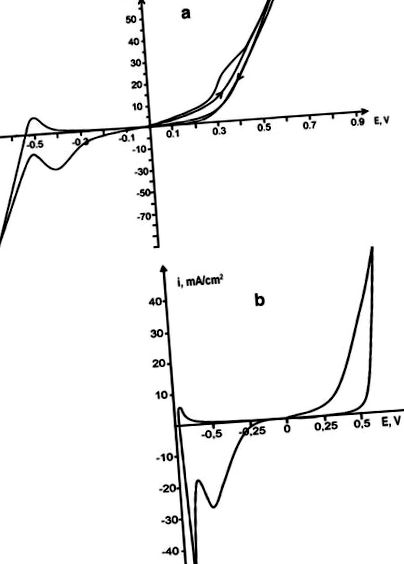
Dizolvarea rodiei anodice a fost efectuată în topirea ureei individuale și în topitura eutectică uree-NH4Cl (16,8% mol.) (T = 130 ° C). În ureea topită individuală, dizolvarea metalului este complicată de pasivare și, datorită conductivității electrice slabe a topiturii, creșterea curenților catodici și anodici este slab exprimată. Adăugarea de NH4Cl la uree crește conductivitatea electrică a topiturii, ceea ce duce la curbele de polarizare care afișează clar toate procesele electrodului. În topirea carbamidei-clorurii, dizolvarea electrochimică a rodiului are loc inițial fără restricții; cu toate acestea, deja în timpul celui de-al doilea ciclu, are loc pasivarea anodului, care se arată prin apariția umărului la partea anodică a voltamogramei ciclice (Fig. 1 a). Pierderile în greutate ale anodului de rodiu în topitura de uree-clorură cresc în comparație cu ureea individuală, iar intensitatea colorării topiturii crește și atinge o culoare galben-maro intens. Dizolvarea electrochimică a rodiului este însoțită de formarea ionilor Rh (III).
Voltamogramele ciclice ale electrodului de rodiu împotriva tijei de platină în topirea ureei-NH4Cl (A), V p = 0,1 V/s și acetamidă-NH4Cl (b), Vp = 0,1 V/s
De asemenea, dizolvarea anodică a rodiului a fost efectuată în topitura de acetamidă la 108 ° C și în topitura de acetamidă-NH4Cl la 80 ° C. Curbele de polarizare în topitura acetamidei sunt estompate, astfel încât procesele electrodului nu pot fi interpretate corect. Adăugarea clorurii de amoniu la acetamidă pentru a forma acetamida-NH4Cl (22,3 mol.%) Compoziția eutectică topită [Tumanova și colab. [5]] ne-a permis să obținem curbe de polarizare care să arate clar procesele electrochimice ale dizolvării anodului de rodiu și ale reducerii ionilor săi. Rodiul se dizolvă în topitură de clorură de acetamidă fără pasivare (Fig. 1 b). Viteza de dizolvare a acesteia (4,7 ∙ 10 −5) este mai mare decât în topitura de uree-clorură, în timp ce conductivitatea specifică a topiturii de clorură de uree-amoniu (0,06 ohm -1 cm -1) este mai mare decât cea a acetamidei-clorură unu (0,015 ohm −1 cm −1) [Tumanova și colab. [6]]. Acest rezultat poate fi explicat prin absența pasivării electrodului în timpul electrodizolvării în topitură de clorură de acetamidă. La dizolvare, rodiul este transferat în topitură ca ioni Rh (III).
Cea mai stabilă stare de oxidare a rodiului este Rh (III) cu configurația electronică [Kr] (4d) 6. Pentru compușii complexi Rh (III) caracterizați prin formarea configurației octaedrice, starea principală pentru complexele octaedrice ale Rh (III) este 1 A1g (t2g) 6, iar o stare excitată singlet este 1 T1g și 1 T2g referitoare la configurație ( t2g) 5 (de ex.).
În timpul dizolvării anodice a Rh în topirea clorurii de uree, benzile la 28.000 cm -1 și 37.000 cm -1 apar la spectrele electronice, iar în topitura acetamidă-clorură - la 28.000 cm -1 și 36.000 cm -1 (Fig. 2) ). În spectrele IR ale probelor răcite rapid, s-a constatat prezența vibrațiilor ν (Rh-N) la 480 cm -1 și ν (Rh-Cl) la 330 cm -1. În conformitate cu datele din literatură [Ficatul [7], Volkov și Yatsimirskiy [8] și Nakamoto [9]], acest lucru este caracteristic pentru formarea în carbamidă și acetamidă care conține topituri de complexe cvasi-octaedrice [Rh (NH3) 4Cl2] + de simetrie D4h.
Spectrele electronice ale ionilor complexi Rh (III) din clorură-acetamidă (1) și uree-clorură (2) se topesc la 120 ° C
Următorii parametri spectroscopici au fost obținuți pentru complexele [Rh (NH3) 4Cl2] + în topituri de clorură de uree și clorură-acetamidă: 10 Dq = 31000 (30650) cm -1; B = 562 (500) cm -1; b = 0,78 (0,70). Puterea câmpului ligandului în complexele mixte [Rh (NH3) 4Cl2] + este mai slabă decât în complexele de amoniac pur [Rh (NH3) 6] 3+, unde 10 Dq = 33200 cm -1 [Galus [10]], care confirmă din nou formarea în aceste topituri în timpul dizolvării rodice anodice a complexelor mixte [Rh (NH3) 4Cl2] + .
Compusul complex [Rh (NH3) 4Cl2] + din topiturile investigate este electroactiv și reducerea acestuia se observă în partea catodică a ciclogramelor ca un maxim prezentat în Fig. 1a, b. Determinarea parametrilor cinetici ai procesului de reducere Rh (III) a fost efectuată printr-o metodă convențională. Criteriile principale pentru controlul difuziei și reversibilitatea procesului au fost calculate în conformitate cu ecuațiile date în monografia lui Galus [10]. Curbele de polarizare au fost înregistrate într-o gamă largă de rate de polarizare: 0,05, 0,1, 0,2, 0,5 și 1 V/s. Dependența ip/V 1/2 de la V 1/2 (Fig. 3) este rectilinie și paralelă cu axa x, ceea ce arată că procesul se desfășoară în modul de difuzie, dar din moment ce există o dependență de ip de V 1/2 . Coeficientul de difuzie al ionilor de rodiu în topiturile de uree-clorură și clorură-acetamidă este determinat de conductivitatea respectivă, iar domeniul său de valori este cuprins între 8,4 ∙ 10 −6 cm 2/s pentru aceste sisteme. Reducerea ionilor de rodiu are loc ireversibil în modul de difuzie într-un singur pas către metalul liber. Micrografia depozitului de rodiu obținut este prezentată în Fig. 4 .
Dependența i p/V 1/2 de la V 1/2 pentru catodul de rodiu vs tija de platină în amestec topit uree-NH4Cl
Micrografia nanoparticulelor de rodiu (10-22 nm) obținută la catodul de platină în amestec topit uree-NH4Cl (JEOL-100)
Dimensiunea particulelor de depozit Rh este cuprinsă între 10-22 nm, dar o parte semnificativă a acesteia este agregată. Dimensiunea medie a cristalitelor de rodiu a fost evaluată prin expansiunea fizică a vârfurilor și este de aproximativ 5 nm. Acest lucru indică formarea nanocompozitelor de rodiu pe suprafața Fe, Cu și Mo metalice în topiturile investigate. Acoperirile cu rodiu obținute din topituri pe bază de uree și acetamidă cu anod de rodiu solubil sunt uniforme, de culoare gri și grosime de 6,1 microni (fig. 5). În timpul depunerii cu acoperire Rh, s-au obținut 0,05-0,7 g de metal în funcție de timpul de electroliză. Astfel, randamentul curent a fost de 85-90%.
Aspectul nanocompozitelor Rh la suprafața Fe (A, b), Cu (c, d) și Mo (e, f) după electroliză în (1) clorură de carbamidă și (2) acetamidă se topesc cu anodul Rh solubil (obținut cu ajutorul microscopului REM-101)
Concluzii
Astfel, comportamentul electrochimic al rodiului a fost studiat la topiturile pe bază de uree și acetamidă. Dizolvarea anodică a metalului în acești electroliți este însoțită de pasivare cu formarea de complexe Rh (III) care sunt reduse în modul de difuzie, într-un singur pas la metal. S-a realizat sinteza nanoparticulelor Rh și nano-acoperirilor la suprafața Fe, Cu și Mo.
Mulțumiri
Autorii acestei lucrări recunosc sprijinul întregului personal al Universității „Ucraina” în efectuarea cercetărilor științifice și în redactarea acestei lucrări.
Finanțarea
Autorii acestei lucrări nu au folosit surse externe de finanțare în plus față de finanțarea periodică pentru investigații științifice furnizate de Academia Națională de Științe din Ucraina.
Contribuțiile autorilor
Autorii acestei lucrări au adus contribuții egale la efectuarea cercetărilor științifice și la scrierea acestei lucrări. Toți autorii au citit și au aprobat manuscrisul final.
Interese concurente
Autorii declară că nu au interese concurente.
Nota editorului
Springer Nature rămâne neutru în ceea ce privește revendicările jurisdicționale din hărțile publicate și afilierile instituționale.
- CLOCK 3111 TC SNP interacționează cu comportamentul alimentar emoțional pentru scăderea în greutate într-o Mediterană
- Exercițiu pentru pierderea în greutate a animalelor de companie - Soluții de comportament veterinar New Horizons - Park Forest, IL
- Analiza comportamentului consumatorului pe piața globală de gestionare a greutății și a produselor de bunăstare pe țări,
- Găsiți cel mai bun) Arzător de grăsime de top pentru bărbați Pierderea în greutate în 28 de zile - Camp Como
- Glam D Diet Pills Review Dorfschmiede Freienseen