Ariell M. Joiner
1 Departamentul de farmacologie, Facultatea de Medicină a Universității din Michigan, Ann Arbor, Michigan 48109-5632,
Warren W. Green
2 Departamentul de farmacologie și terapie, Universitatea din Florida, Colegiul de medicină, Gainesville, Florida 32610-0267,
Jeremy C. McIntyre
2 Departamentul de farmacologie și terapie, Universitatea din Florida, Colegiul de medicină, Gainesville, Florida 32610-0267,
Benjamin L. Allen
3 Departamentul de biologie celulară și de dezvoltare, Facultatea de Medicină a Universității din Michigan, Ann Arbor, Michigan 48109-2200 și
James E. Schwob
4 Departamentul de Biologie Dezvoltării, Moleculare și Chimice, Școala de Medicină a Universității Tufts, Boston, Massachusetts 02111
Jeffrey R. Martens
1 Departamentul de farmacologie, Facultatea de Medicină a Universității din Michigan, Ann Arbor, Michigan 48109-5632,
2 Departamentul de farmacologie și terapie, Universitatea din Florida, Colegiul de medicină, Gainesville, Florida 32610-0267,
Contribuțiile autorului: A.M.J., J.C.M. și J.R.M. cercetare proiectată; A.M.J., W.W.G. și J.C.M. cercetări efectuate; A.M.J., W.W.G., J.C.M. și J.R.M. date analizate; A.M.J., W.W.G., J.C.M., B.L.A., J.E.S. și J.R.M. a scris ziarul.
Abstract
DECLARAȚIE DE IMPORTANȚĂ Arătăm pentru prima dată prezența ciliilor primari pe o populație în repaus de celule stem bazale, celulele bazale orizontale (HBC), în epiteliul olfactiv (OE). Important, datele noastre demonstrează că cilii de pe HBC sunt necesari pentru regenerarea OE după rănire. Mai mult, perturbarea ciliilor HBC modifică neurogeneza în timpul dezvoltării OE, oferind dovezi că HBC participă la stabilirea acestui țesut. Aceste date sugerează că mecanismele de penetrare pentru ciliopatii în OE se extind dincolo de defectele neuronilor senzitivi olfactivi și pot include modificări în întreținerea și regenerarea OE.
Introducere
Neurogeneza apare din autoînnoirea și diferențierea celulelor stem neuronale (NSC; Gage, 2000). În timp ce prevalează în timpul dezvoltării, NSC se găsesc și în sistemul nervos adult, în epiteliul olfactiv (OE), în zona subventriculară (SVZ) a ventriculului lateral și în zona subgranulară a hipocampului (Gage, 2000; Alvarez-Buylla și Garcia -Verdugo, 2002; Lie și colab., 2004). Factorii și mecanismele care reglează proliferarea celulară, migrația, diferențierea și supraviețuirea în timpul dezvoltării pot fi active în sistemul nervos adult, permițând repararea țesuturilor și neuroplasticitatea (pentru o revizuire, vezi Lie și colab., 2004). Spre deosebire de majoritatea sistemelor senzoriale, OE este capabil să reconstituie atât populațiile neuronale, cât și cele non-neuronale după leziuni și moarte neuronală prin acțiunea populațiilor rezidente de celule stem olfactive (Graziadei și Graziadei, 1979; Calof și Chikaraishi, 1989; Edge și Chen, 2008). Neuronii senzitivi olfactivi (OSN) sunt unici prin faptul că contactează direct atât mediul extern, cât și creierul. În timp ce acest contact direct permite OSN-urilor să detecteze mirosurile, acesta expune, de asemenea, OE la insulte din toxine, bacterii și viruși care duc la moartea celulară. Prin urmare, capacitatea de neurogeneză și înlocuirea OSN este esențială pentru menținerea acestui important sistem senzorial.
Ciliile primare au roluri importante în proliferarea, diferențierea și reglarea celulelor celulare (pentru revizuire, vezi Irigoín și Badano, 2011). Există dovezi din ce în ce mai mari că cilii primari reglează neurogeneza și/sau diferențierea corectă a celulelor stem adulte în celule progenitoare amplificatoare sau celule gliale în SVZ și hipocamp (Amador-Arjona și colab., 2011; Kumamoto și colab., 2012; Tong și colab. ., 2014). În consecință, atunci când cilia este perturbată în aceste sisteme, căile de semnalizare mediate de cilia, cum ar fi ariciul sonic, și căile de semnalizare modulate de cilia, cum ar fi Wnt, sunt, de asemenea, întrerupte (Kumamoto și colab., 2012; Tong și colab., 2014) . Aceste descoperiri demonstrează rolul important pe care îl joacă cilii în căile de semnalizare care sunt esențiale pentru diferențierea corectă a celulelor în timpul dezvoltării și homeostaziei adulților.
Aici, arătăm că HBC posedă cili primari, sugerând un mecanism potențial pentru reglarea moleculară a celulelor stem bazale olfactive în OE. La șoarecii la care HBC nu au avut cili, OE a prezentat o regenerare limitată în urma leziunii, cu o reducere semnificativă a OSN-urilor mature. În plus, când ciliile HBC au fost îndepărtate la începutul dezvoltării, s-a constatat că anumite regiuni ale OE au o reducere semnificativă a OSN. Aceste date identifică ciliile HBC ca o structură de semnalizare nerecunoscută anterior în OE, oferă o perspectivă mecanicistă asupra reglementării HBC în timpul regenerării olfactive și indică un rol potențial pentru HBC în dezvoltarea OE.
Materiale și metode
Tulpini de șoareci și genotipare.
Inducția transgenică a doxiciclinei și leziunea epitelială olfactivă.
Șoarecii au fost hrăniți cu doxiciclină chow (200 mg/kg doxiciclină, Bio-Serv) și apă (200 μg/ml doxiciclină, 5% zaharoză, Thermo Fisher) începând fie în ziua embrionară 16 (E16), fie în ziua postnatală 28 (P28) și au rămas pe o dietă care conține doxiciclină până când au fost uciși. Pe baza unui aport zilnic aproximativ de 4 g/șoarece și a unui aport de apă de 6 ml/șoarece (Bachmanov și colab., 2002), șoarecii au consumat ∼2 mg de doxiciclină/zi (0,8 mg în chow și 1,2 mg în apă). K28rtTA tratat cu doxiciclină P28; TetOcre; Șoareci Ift88 fl/fl sau K5rtTA; TetOcre; Șoareci Arl13b fl/fl și colegii de control corespunzători au primit o injecție intraperitoneală de metimazol (2-mercapto-1-metilimidazol, 75 mg/kg în 1 × sterilizat PBS; Sigma-Aldrich) la 4 săptămâni după începerea dietei care conține doxiciclină. Acești șoareci au fost menținuți pe o dietă care conține doxiciclină până când au fost uciși la 8 săptămâni după tratamentul cu metimazol.
Colectarea și pregătirea țesuturilor.
Șoarecii au fost anesteziați cu 30% Fluriso (izofluran, VetOne), perfuzați transcardic cu 4% paraformaldehidă (PFA) și decapitați, iar capetele lor au fost fixate în 4% PFA timp de 12-16 ore la 4 ° C. Țesutul a fost apoi decalcificat în 0,5 m EDTA (Thermo Fisher)/1 × PBS peste noapte la 4 ° C; crioprotejat în 10% (1 oră), 20% (1 oră) și 30% zaharoză/1 × PBS peste noapte la 4 ° C; și congelate în compusul OCT (Tissue Tek). Secțiuni ale epiteliului olfactiv și ale bulbului olfactiv (OB) care au avut o dimensiune de 10-12 μm au fost colectate pe un criostat Leica CM1860.
Imunohistochimie.
Pentru detectarea Cre, secțiunile de țesut au fost clătite în 1 × PBS pentru a îndepărta OCT, baltite cu tampon de citrat și aburite timp de 10 minute într-un borcan de sticlă într-o baie de apă fierbinte. Secțiunile au fost blocate cu 2% ser de măgar sau de capră/5% lapte uscat fără grăsimi/4% BSA/1% TTX100 în 1 × PBS și incubate peste noapte în anticorp primar. Pentru detectarea GFP, secțiunile de țesut au fost clătite în 1 × PBS pentru a îndepărta OCT, bălțate cu tampon de citrat și aburite timp de 10 minute într-un borcan de sticlă într-o baie de apă fierbinte. Secțiunile au fost blocate cu 2% ser de măgar sau de capră/0,3% TTX100 în 1 × PBS și incubate peste noapte în anticorp primar. Pentru colorarea triplă cu MASH1, SEC8 și LSD1 sau OMP și ATub, anticorpii de șoarece sau OMP au fost incubați împreună peste noapte, iar LSD1 sau respectiv ATub, au fost incubați timp de 1 oră în ziua următoare.
Prelucrarea și cuantificarea imaginilor.
Imaginile au fost capturate folosind un microscop confocal Nikon A1R. Software-ul ImageJ a fost utilizat pentru a măsura lungimea OE (în micrometri) în fiecare imagine, pentru a număra tipuri specifice de celule cu pluginul de contor de celule și pentru a măsura intensitatea TH. Pentru a cuantifica tipurile de celule, au fost luate 10-15 imagini din regiunile dorsal-medial, dorsal-lateral, ventral-medial și ventral-lateral, pe trei până la patru secțiuni ale OE. Numărul de celule a fost calculat în medie și convertit la numărul de celule pe milimetru de OE. Cuantificarea a fost efectuată pentru N = 3-6 șoareci în toate grupurile de control, iHBC-IFT88 și iHBC-ARL13B, dacă nu se specifică altfel. Valorile N raportate reprezintă numărul de șoareci examinați. Măsurătorile intensității TH au fost cuantificate pentru toți glomerulii din fiecare dintre trei până la patru secțiuni ale OB în patru șoareci iHBC-IFT88 și patru șoareci de control utilizând software-ul ImageJ. O paradigmă experimentală oarbă a fost utilizată pentru a elimina prejudecățile în timpul procesării și cuantificării imaginilor.
Statistici.
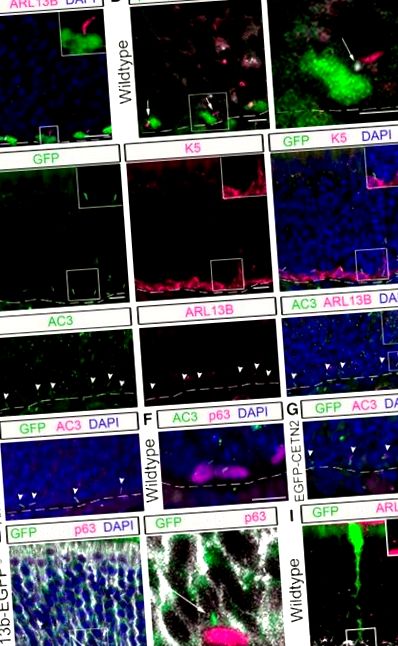
În OE, celulele SUS localizate apical posedă proiecții, cunoscute sub numele de picioare de capăt, care juxtapun celulele bazale olfactive în drum spre contactul cu lamina bazală (Doyle și colab., 2001). Scopul acestor conexiuni nu a fost încă elucidat; cu toate acestea, s-a propus că acesta este un site de comunicare între celulele bazale și celulele SUS (Jia și Hegg, 2010). În analiza noastră, am observat că majoritatea cililor HBC se proiectează din partea de sus a HBC-urilor către picioarele capătului celulei SUS. Pentru a determina dacă cilii HBC au fost asociați cu picioarele de capăt ale celulei SUS, analiza p63 + HBC și a celulelor SUS imunomarcate cu K18 (Holbrook și colab., 2011) a fost efectuată la șoarecii tg Arl13b-EGFP. După cum se vede în imaginea reprezentativă (Fig. 1 H), cilii care se proiectează de la HBC sunt în poziție la picioarele de capăt. Pentru a îmbunătăți rezoluția unui singur picior de capăt al celulei SUS, am analizat OE de șoareci injectați intranazal cu un adenovirus care exprimă GFP, în care un subset mic de celule SUS sunt transduse (pentru metode, vezi McIntyre și colab., 2012). Folosind această abordare, este clar că ciliul ARL13B + se proiectează în spațiul interstițial dintre celula HBC și SUS (Fig. 1 I). Aceste date sugerează potențialul ca cilii să acționeze ca o antenă de comunicare între celulele bazale și celulele SUS, poate într-un mod analog sinapselor imunologice (Bromley și colab., 2001; Finetti și colab., 2011).
Cilii sunt prezenți pe subpopulații distincte de celule stem olfactive
HBC sunt celula stem bazală olfactivă ciliază predominantă. Colorarea prin imunofluorescență a fost efectuată în epiteliul olfactiv al șoarecilor de tip sălbatic. A, Markerul canonic GBC MASH1 se colocalizează cu un subset de GB8 SEC8 +, în timp ce LSD1 se colocalizează cu un subgrup mai mare de GB8 SEC8 +. B, Puține GBC etichetate cu SEC8 posedă cilii marcate cu ARL13B (vezi săgețile) în comparație cu HBC-uri marcate cu K5 (inserare, imagine mărită). Bare de scară, 10 μm. Linie punctată, Membrană de subsol. † GBC migrator ocazional. C, Date cuantificate ale celulelor SEC8 + care sunt fie MASH1 + (N = 4), fie LSD1 + (N = 4). D, Procentul de HBC (N = 6) și GBC (N = 6) care posedă cilii. **** p fl/fl și K5rtTA; TetOCre; Ift88 fl/Δ) sunt denumiți în continuare șoareci iHBC-IFT88, în timp ce șoareci de tip sălbatic (K5rtTA; TetOCre; Ift88 fl/wt) sunt denumiți în continuare șoareci de control.
Șoarecilor de control și iHBC-IFT88 li s-a administrat o dietă care conține dox pentru a activa expresia Cre (Gunther și colab., 2002; Grachtchouk și colab., 2011) la P28, când OE este matur (Murdoch și Roskams, 2007). La o săptămână după administrarea dox, aproximativ 90% din HBC la șoareci cu ambele alele TetOCre și K5rtTA au prezentat expresia Cre (Fig. 3 A). Expresia Cre nu a fost detectată la HBC-urile la șoareci cărora le lipsea alela TetOCre (Fig. 3 B). Mai important, șoarecii iHBC-IFT88 au prezentat o pierdere semnificativă (88,5%) de HBC ciliați după 4 săptămâni de a lua o dietă care conține dox (Fig. 3 C, D; N = 5). Interesant este că pierderea cililor nu a dus la o modificare a numărului de HBC (Fig. 3 E; N = 5). Imunomarcarea cu markerul OSN matur OMP și a-tubulina acetilată (Acet-Tub) nu a evidențiat modificări ale compoziției OSN (Fig. 3 F). O creștere a pierderii cililor la HBC (95,6%) a fost detectată după 8 săptămâni de administrare dox (Fig. 4 A, B), fără efect asupra numărului de HBC (Fig. 4 C), GBC (Fig. 4 D, E) și OSN (Fig. 4 F, G; șoareci martor, N = 2; șoareci iHBC-IFT88, N = 4). Aceste date demonstrează că ablația genetică a Ift88 îndepărtează în mod eficient cilii de HBC, fără a modifica starea de repaus HBC sau menținerea obișnuită a OE.
- Nanorattle de silice - Celule stem mezenchimale ancorate în doxorubicină pentru terapia tumorală-tropicală ACS Nano
- Parsley Health percepe 150 de dolari pe lună pentru îngrijirea primară directă - Business Insider
- RSK2 protejează celulele umane de cancer de sân sub stresul reticulului endoplasmatic prin activare
- Punerea strângerii pe celulele adipoase - ScienceDaily
- Tulburări ale mirosului (olfactiv) - Anosmia, Phantosmia și altele NIDCD