Markus Gressler
1 Unité des Aspergillus, Institut Pasteur, Paris, Franța
Christoph Heddergott
1 Unité des Aspergillus, Institut Pasteur, Paris, Franța
Inés C. N'Go
1 Unité des Aspergillus, Institut Pasteur, Paris, Franța
Giorgia Renga
2 Departamentul de Medicină Experimentală, Universitatea din Perugia, Perugia, Italia
Vasilis Oikonomou
2 Departamentul de Medicină Experimentală, Universitatea din Perugia, Perugia, Italia
Silvia Moretti
2 Departamentul de Medicină Experimentală, Universitatea din Perugia, Perugia, Italia
Bernadette Coddeville
3 Unitatea de Glicobiologie Structurală și Funcțională (UGSF) UMR 8576 CNRS, Universitatea din Lille, Lille, Franța
Joana Gaifem
4 Institutul de Cercetări în Științele Vieții și Sănătății (ICVS), Facultatea de Medicină, Universitatea din Minho, Braga, Portugalia
5 ICVS/3B's-PT Laborator asociat guvernamental, Braga, Portugalia
Ricardo Silvestre
4 Institutul de Cercetări în Științele Vieții și Sănătății (ICVS), Facultatea de Medicină, Universitatea din Minho, Braga, Portugalia
5 ICVS/3B's-PT Laborator asociat guvernamental, Braga, Portugalia
Luigina Romani
2 Departamentul de Medicină Experimentală, Universitatea din Perugia, Perugia, Italia
Jean-Paul Latgé
1 Unité des Aspergillus, Institut Pasteur, Paris, Franța
Thierry Fontaine
1 Unité des Aspergillus, Institut Pasteur, Paris, Franța
Date asociate
Toate seturile de date generate pentru acest studiu sunt incluse în articol/Material suplimentar.
Abstract
Galactosaminogalactanul (GAG) este un polimer aminosugar insolubil produs de Aspergillus fumigatus și are proprietăți antiinflamatorii. Aici, au fost investigate secvențele glicozidice minime necesare pentru inducerea IL-1Ra de către celulele mononucleare din sângele periferic (PBMC). Folosind degradarea chimică a GAG-ului nativ pentru a izola oligomerii solubili, am constatat că de-N-acetilarea reziduurilor de galactozamină și dimensiunea oligomerului sunt critice pentru răspunsul imun in vitro. Pentru răspunsul antiinflamator este necesară o dimensiune minimă a oligomerului de 20 de resturi de galactozamină, dar prezența reziduurilor de galactoză nu este necesară. Într-un model de șoarece de colită indus de sulfat de dextran, o fracțiune de oligomeri de-N-acetilați din 13 Cuvinte cheie: galactosaminogalactan, Aspergillus fumigatus, IL-Ra, răspuns antiinflamator, glicodrug
Introducere
Modificarea chimică a polizaharidelor
De-N-acetilarea polizaharidelor
GAG a fost suspendat în 3 ml HCl 10 mM la o concentrație finală de 3,33 mg/ml prin sonicare în tuburi de plastic. De-N-acetilarea a fost începută prin adăugarea a 3,4 ml de NaOH 18,8 M și amestecul a fost incubat la 100 ° C timp de până la 4-5 ore. Tuburile erau agitate în fiecare oră. Reacția a fost oprită pe gheață și neutralizată cu HCI 12 M. Amestecul a fost tamponat cu 20 mM Tris, pH 7. GAG-urile de-N-acetilate (dGAG) au fost dializate împotriva apei de la robinet și de două ori împotriva dH20 (24 ore fiecare) și în cele din urmă liofilizate la sec și depozitate la temperatura ambiantă.
Acetilarea oligozaharidelor
Procedura de acetilare descrisă de Lavertu și colab. (2012) a fost modificat după cum urmează: 0,5 mg oligozaharide dGAG (F-I și F-III) au fost liofilizate până la uscare și au fost rezolvate în 25 μl de acid acetic 400 mM și 100 μl CH3OH. Amestecul a fost preincubat timp de 1 oră la temperatura ambiantă sub agitare la 300 rpm. Acetilarea a fost inițiată prin adăugarea a 3 μl de anhidridă acetică. După 1 oră de incubare, solvenții au fost evaporați într-un desicator peste noapte. Probele au fost desalinizate prin dizolvare repetată cu 500 μl de apă (de 4 ori) urmată de evaporare la sec. Probele au fost rezolvate în 500 μl de apă și în cele din urmă depozitate la -20 ° C.
Producerea de oligozaharide GAG
Proceduri analitice
Analiza MBTH
Osminele de-N-acetilate au fost detectate și cuantificate prin testul MBTH (Plassard și colab., 1982). Procedura a fost efectuată pe o placă cu 96 de godeuri (Sarstedt): 40 μl probă (conținând până la 200 μg osmini/ml) au fost amestecate cu 40 μl KHSO4 5% (Sigma Aldrich). Probele au fost reduse prin adăugarea a 40 pl de NaNO2 5% (Sigma Aldrich) timp de 60 min la 50 ° C, prin care s-au folosit 40 pl de NaCI 5% ca martor negativ. După neutralizare cu 40 μl 12,5% NH4SO2NH2 (Sigma Aldrich) (temperatura ambiantă, 30 rpm, 10 min), s-a adăugat 40 μl 0,5% 3-metil-2-benzotiazolinonă hidrat clorhidrat de hidrat (Sigma Aldrich). Placa acoperită a fost incubată la 37 ° C timp de 30 de minute. În cele din urmă, s-a adăugat 40 μl 0,5% FeCl3 și absorbția la λ = 650 nm a fost măsurată de cititorul de plăci ELISA infinit M200Pro Tecan, în timp ce λ = 800 nm a servit ca lungime de undă de referință. O curbă de calibrare a unei diluții seriale de d-galactozamină (GalN) a servit drept referință. Pentru a cuantifica cantitatea totală de osmină sau gradul de acetilare (DA), a fost efectuată o etapă de hidroliză înainte de testul MBTH. Probele au fost complet hidrolizate cu HCI 4 M la 100 ° C timp de 4 ore și ulterior uscate peste noapte într-un desicator.
Analiza acetatului
DA a fost, de asemenea, estimată prin testul acetat enzimatic. Probele (220 μl) au fost complet hidrolizate prin adăugarea a 100 μl de HCl 12 M (100 ° C, 4 h). Apoi, 100 μl au fost folosiți pentru detectarea osminei prin testul MBTH așa cum este descris mai sus și alți 100 μl au fost folosiți pentru testul acetat. După neutralizare prin adăugare de 75 μl 7 M NaOH și 75 μl 2 M MOPS (pH 7,5), probele au fost supuse testului colorimetric al acetatului (Sigma-Aldrich) conform protocolului producătorului. Absorbția la λ = 450 nm a fost măsurată de cititorul de plăci ELISA infinit Tecan M200Pro, în timp ce λ = 700 nm a servit ca lungime de undă de referință. Conținutul de acetat din probele hidrolizate a fost determinat printr-o curbă de calibrare de 0,25-1,5 mM soluție standard de acetat.
Identificarea și cuantificarea monozaharidelor prin cromatografie cu gaze
Probele (100 μg) au fost hidrolizate în 500 μl de HCl 8 M pentru analiza hexozaminei sau TFA 4 M pentru analiza hexozozei. Meso-inozitol (4 μg) a fost utilizat ca standard intern și 50 μg Gal, GalNAc și GlcNAc ca standarde externe. După hidroliză, reducerea cu probe de BH4Na și acetilare a fost analizată de GC pe un instrument Perichrom PR2100 cu un detector de ionizare a flăcării folosind o coloană capilară (30 m × 0,32 mm) umplută cu un DB-1 (SGE) așa cum a fost descris anterior (Fontaine și colab. ., 2011).
Degradarea enzimatică a fracțiilor GAG
Producerea unei Endo-α-1,4-galactozaminidază recombinante
Pentru degradarea enzimatică a GAG, o poli-GalN hidrolază a Pseudomonas sp. (Tamura și colab., 1988), numită aici GAGnase, a fost produsă în Escherichia coli. Înainte de sinteza totală a genei, secvența ADN a fost optimizată cu codoni pentru exprimare în E. coli. În plus, a fost adăugată o etichetă histidină la capătul carboxil pentru a facilita purificarea ulterioară (Figura S2). Gena a fost donată în vectorul de expresie pET28a (+) și transformată în tulpina de expresie E. coli BL21 Gold. O cultură în faza de creștere exponențială a fost indusă cu 1 mM IPTG (concentrație finală), urmată de producție timp de 4 ore la 30 ° C. Proteina poate fi găsită în supernatantul de cultură (conține un semnal de secreție bacteriană), în citoplasmă și în corpurile de incluziune. Enzima prezentă în supernatant a fost purificată folosind mărgele de agaroză chelatoare cu nichel ProBond ™ (ThermoFisher) (raport 0,5 ml margele/50 ml supernatant) (Figura S2). Preparatul final a fost păstrat într-un tampon HEPES 20 mM pH 7,4, NaCl 137 mM și depozitat în alicote la -20 ° C.
Degradarea enzimatică a oligozaharidelor
Hidroliza enzimatică a GAG a fost efectuată așa cum s-a descris anterior (Tamura și colab., 1992). Pe scurt, 5 mg/ml GAG/dGAG sau 1 mg/ml oligozaharide GAG au fost dizolvate în NaAc 50 mM, pH 6,0. Reacția (scara de 100 μl) a fost inițiată prin adăugarea de 2 μg/ml GAGnază și incubată în continuare timp de 2 ore la 37 ° C. GAGnaza a fost rapid inactivată la căldură (100 ° C, 5 min) și eficiența degradării a fost estimată prin testul final de reducere a zahărului utilizând PABA ca reactiv (Lever, 1972).
Spectrometrie de masă MALDI-TOF
Spectrele MALDI-TOF au fost analizate în modul reflectron pozitiv folosind un spectrometru 4800 TOF/TOF (Applied Biosystems, Framingham, MA, SUA) echipat cu un laser cu azot pulsat (337 nm și frecvența de 200 Hz). O medie de 5.000 de fotografii pe loc a fost utilizată pentru achiziționarea datelor MS. Probele au fost preparate prin amestecarea directă a 0,5 ml țintă de soluție de oligozaharidă în apă (10-50 pmol) cu 0,5 μl de soluție matricială de acid 2,5-dihidroxibenzoic (10 mg/ml în CH3OH/H2O, 50:50, V/C). Probele au fost uscate la temperatura camerei.
Izolarea celulelor mononucleare din sângele periferic (PBMC)
Probele de sânge de la donatori sănătoși au fost obținute de la Etablissement Français du Sang Saint-Louis (Paris, Franța) cu consimțământul scris în conformitate cu liniile directoare furnizate de Comitetul de Etică Instituțională, Institutul Pasteur (convenția 12/EFS/023). Eșantionul de sânge uman de la pacienți sănătoși a fost diluat 1: 1 cu PBS (Gibco). Într-un tub de șoim de 50 ml, 15 ml de mediu de separare a limfocitelor (Eurobio) au fost suprapuse încet cu 30 ml de diluție sanguină. Celulele au fost separate prin centrifugare la temperatura ambiantă (20 min, 1800 rpm). Faza superioară (tampon și plasmă) a fost aruncată și PBMC-urile (2-5 ml) au fost colectate. Celulele au fost spălate prin adăugare de 40 ml PBS și centrifugare ulterioară la temperatura ambiantă (10 min, 1.500 rpm). Etapa de spălare a fost repetată (30 ml PBS; 10 min, 1200 rpm). Celulele au fost în cele din urmă suspendate în 10-20 ml RPMI 1640 + Glutamax-I (Gibco) și numărate într-un hemocitometru (c-Chip DHC-M01; Digital Bio). Celulele au fost în cele din urmă diluate la o concentrație de 1 × 107 celule/ml în RPMI și depozitate pe gheață.
Detectarea producției de interleukină în PBMCs prin test imunosorbent legat de enzime (ELISA)
Detectarea citotoxicității prin testul lactat dehidrogenazei (LDH)
Citotoxicitatea putativă a GAG-urilor și oligozaharidelor GAG a fost estimată ca eliberare de LDH din PBMC. PMBC-urile au fost însămânțate într-o concentrație finală de 5 × 105 celule în 200 pl RPMI 1640 + Glutamax-I suplimentat cu 10% ser uman într-o placă cu 96 de godeuri în formă de U. GAG-urile și oligozaharidele au fost testate într-o concentrație finală de 1,0 și 5,0 μg/ml (cantitate conform testului MBTH al probelor hidrolizate). Lipopolizaharidele (LPS) de la E. coli (10 ng/ml; SIGMA) au servit ca martor negativ. Celulele total lizate TritonX100 au servit drept control pozitiv și referință. Toți supernatanții s-au diluat 1: 5 în PBS + 1% BSA (control pozitiv 1:20) și testul LDH a fost realizat de setul de detectare a citotoxicității LDH (Roche) conform protocolului producătorului. Niciuna dintre aceste oligozaharide nu a fost toxică pentru PBMC (Figura S3), arătând că secreția IL-1Ra nu a fost asociată cu apoptoza celulară sau necroză.
Aplicarea GAG și Oligo-GAG la șoareci tratați cu DSS
Analize statistice
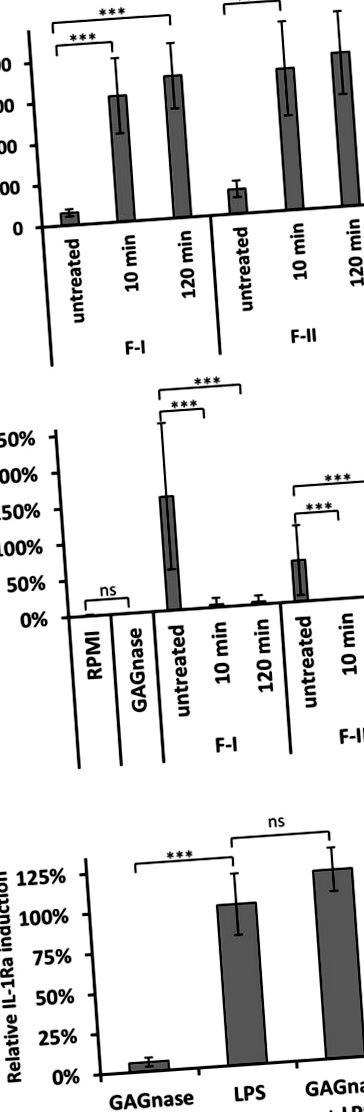
Toate experimentele au fost efectuate cu cel puțin cinci loturi diferite de GAG și oligozaharide și un minim de patru donatori de sânge. Toate statisticile experimentelor in vitro au fost efectuate cu un test Wilcoxon - Mann - Whitney nepereche, cu două cozi, de către software-ul gratuit EDISON-WMW (Marx și colab., 2016). Analize statistice din experimente in vivo (Figura 5) au fost efectuate cu ANOVA unidirecțional sau cu două căi. Datele, dintr-un experiment folosind 10 șoareci/grup, au fost exprimate ca medie ± SD și au fost analizate în triplu folosind GraphPad Prism Software. Valorile P sunt indicate prin asterisc după cum urmează: * p ** p *** p 20) Din GAG Induce IL-1Ra pe PBMCs
Severitatea redusă a colitei DSS la șoarecii C57BL/6 tratați cu molecule GAG modificate. DSS sau vehiculul de apă a fost administrat ad libitum în apă potabilă timp de 7 zile. Polimerul GAG nativ și oligomerii GAG în doza de 1 mg/kg au fost administrați intraperitoneal timp de 7 zile consecutive după tratamentul DSS. (A) Supraviețuirea, greutatea (grame) și indicele de activitate a bolii clinice. (B) Imagine macroscopică a colonilor. (C) Evaluarea histologică a severității colitei (mărire 20X, bar = 200 μm). (D) Niveluri de citokine colonice. Datele sunt exprimate ca medie ± SD. * P Figura 5, au fost observate două profiluri de salvare a colitei cu oligomeri GAG. Oligomerii de-N-acetilați (dp medie de 16 sau mai mulți) au salvat șoarecii tratați cu DSS cu o reducere semnificativă a infiltrării celulelor inflamatorii, îngroșarea musculară și ameliorarea structurii colonului. Acest efect este concomitent cu inducerea secreției de IL-1Ra, așa cum s-a observat și in vitro. În contrast, oligomerii acetilați insolubili de dp> 26 au salvat șoareci tratați cu DSS într-un mod de acțiune independent de IL-1Ra. În rezumat, oligozaharidele poli-galactozaminice solubile în apă sunt candidați promițători pentru tratamente alternative ale bolilor dependente de IL-1Ra.
Discuţie
Declarație privind disponibilitatea datelor
Toate seturile de date generate pentru acest studiu sunt incluse în articol/Material suplimentar.
Declarație de etică
Studiul pe animale a fost revizuit și aprobat de autorizația italiană de bunăstare a animalelor 360/2015-PR și gradul legislativ 26/2014.
Contribuțiile autorului
MG, CH, RS, LR, J-PL și TF au conceput și proiectat experimentele. MG, CH, IN'G, GR, VO, SM, BC, JG și TF au efectuat experimentele. MG, CH, BC, RS, LR, JP-L și TF au analizat datele. Reactivi, materiale și instrumente de analiză au contribuit cu MG, CH, GR, VO, SM, BC, JG, RS, LR, J-PL și TF. MG, TF și J-PL au scris lucrarea.
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Mulțumim lui Pauline Robinet, Giorgio Camilli și Jessica Quintin (Institutul Pasteur, Paris) pentru asistență la izolarea PBMC.
Note de subsol
Finanțarea. Această cercetare a fost finanțată de proiectul Aviesan Aspergillus, programul Investissement d'Avenir al guvernului francez, Laboratoire d'Excellence Integrative Biology of Emerging Infectious Diseases (Grant No ANR-10-LABX-62-IBEID), Fondation pour la Recherche Médicale ( DEQ20150331722 LATGE Equipe FRM 2015). RS datorită contractului Fundației pentru Știință și Tehnologie (FCT) IF/00021/2014.
- DNP - definiția DNP de The Free Dictionary
- Herbal fen-phen - definiția Herbal fen-phen de Dicționarul gratuit
- Contribuția microbiotei intestinale la efectele antiinflamatorii mediate de P28GST experimentale și
- Definiția Concor a Concor din dicționarul medical
- Supliment alimentar Definiție Supliment alimentar la