Benoît Foligné
Coline Plé
2 Univ. Lille, CNRS, Inserm, CHU Lille, Institut Pasteur de Lille, U1019 - UMR 8204 - CIIL - Centrul pentru Infecție și Imunitate din Lille, F-59000 Lille, Franța; [email protected] (C.P.); [email protected] (C.D.)
Marie Titécat
Arnaud Dendooven
Aurélien Pagny
Catherine Daniel
2 Univ. Lille, CNRS, Inserm, CHU Lille, Institut Pasteur de Lille, U1019 - UMR 8204 - CIIL - Centrul pentru Infecție și Imunitate din Lille, F-59000 Lille, Franța; [email protected] (C.P.); [email protected] (C.D.)
Elisabeth Singer
Muriel Pottier
Benjamin Bertin
Christel Neut
Dominique Deplanque
3 Univ. Lille, Inserm, CHU Lille, CIC 1403, Centre D’Investigation Clinique, F-59000 Lille, Franța; [email protected]
Laurent Dubuquoy
Pierre Desreumaux
4 Maladies de L’Appareil Digestif et de la Nutrition, CHU Lille, F-59000 Lille, Franța
Monique Capron
Annie Standaert
Date asociate
Abstract
1. Introducere
2. Materiale și metode
2.1. Materiale
Substanțele chimice și reactivii au fost achiziționați de la Sigma - Aldrich Chemical (St Quentin Fallavier, Franța), dacă nu se specifică altfel. Loturile de proteine P28GST au fost produse și purificate din cultura recombinantă Saccharomyces cerevisiae în condiții de bune practici de fabricație de către Eurogentec SA (Seraing, Belgia). P28GST a fost conservat liofilizat în NH4HCO3 10 mM și 6% lactoză. Acest preparat a fost resuspendat extemporan cu sau fără hidroxid de aluminiu 0,2%, un adjuvant compatibil cu utilizarea animală și umană (Alhydrogel®, Brenntag Nordig, Frederikssund, Danemarca și Miltenyi Biotec, Paris, Franța).
2.2. Experimente pe animale și declarații de etică
Șoarecii BALB/c (femele, cu vârsta de 6 săptămâni) au fost achiziționați de la Charles Rivers (L’Arbresle, Franța) și au fost întreținuți în instalații de exploatare a animalelor fără patogeni. Experimentele pe animale s-au conformat legislației franceze (Legea Guvernului 87-848). Toate studiile au fost aprobate de comisia locală de revizuire a eticii investigaționale (Nord-Pas-de-Calais CEEA nr. 75, Lille, Franța; numerele de referință ale protocolului 352012 și 19-2009R) și acordul guvernului francez nr. APAFIS # 7542-20 1608251651940 ).
2.3. Protocoale de imunizare
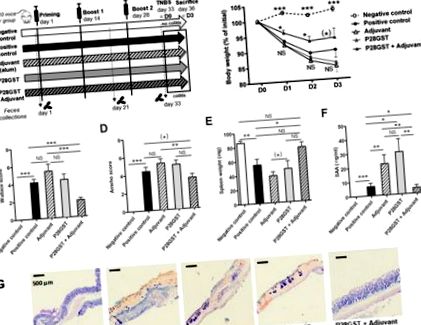
Imunizarea a fost efectuată la șoareci BALB/c prin trei injecții subcutanate (pe spate între omoplați) de P28GST la 5 µg.kg -1 cu un interval de 2 săptămâni, așa cum s-a descris anterior [7]. Alternativ, șoarecii de control au primit fie soluție salină (CTL), adjuvant singur (adjuvant), fie P28GST cu adjuvant (P28GST + adjuvant).
2.4. Inducerea colitei acidului trinitrobenzen sulfonic (TNBS) și a scorului inflamației
Modelul acidului trinitrobenzen sulfonic (TNBS) al colitei acute induse chimic a fost implementat la femele BALB/c de 13 săptămâni (n = 10 șoareci per grup), așa cum s-a descris anterior [30]. Patologia anatomică și citirile inflamatorii, inclusiv reacția în lanț cantitativă a transcriptazei polimerazei au fost raportate în altă parte [31]. Pe scurt, 0,5 cm de probe mediane de colon au fost omogenizate folosind instrumentul FastPrep (MP Biomedicals, Illkirch, Franța), ARN-ul total a fost izolat folosind coloane RNAspin (Macherey-Nagel, Hoerdt, Franța). Transcrierea inversă și PCR în timp real au fost efectuate cu kituri de reacție (trusa de înaltă capacitate cDNA RT, Applied Biosystems - Fischer Scientific, Illkirch, Franța) și reactivi (Universal PCR Master Mix, Applied Biosystems - Fischer Scientific, Illkirch, Franța), conform instrucțiunilor producătorilor. Reacțiile în lanț ale polimerazei (PCR) au fost efectuate cu o mașină MX3005P (Agilent Technologies, Les Ulis, Franța). O analiză de expresie a genei personalizată (TaqMan, Applied Biosystems) a fost utilizată cu primeri proiectați comercial și validați, care sunt enumerați în Tabelul S1 din Materialele Suplimentare. Gena de menaj, beta-actina, a fost administrată ca un control intern. Datele au fost analizate folosind metoda 2 - ΔΔCt și exprimate ca o creștere a valorilor grupului de control.
2.5. Pacienți și probe de fecale umane
Pacienții cu boală Crohn (CD) au făcut parte dintr-un studiu clinic pilot de fază 2a conceput pentru a evalua siguranța P28GST, având ca scop controlul inflamației în CD moderată (ClinicalTrials.gov,> NCT02281916). Atât Autoritatea franceză de sănătate (Agenția Națională de Securitate a Medicamentelor, ANSM), cât și Comitetul de Etică al Nord-Ouest IV au aprobat studiul pilot (numărul EudraCT 2013-000595-15), precum și toți subiecții și-au dat consimțământul informat pentru a participa la proces. Opt pacienți au fost incluși după intervenția chirurgicală de rezecție intestinală sau în CD moderat. Pacienții înrolați au primit trei injecții subcutanate (o injecție pe lună) de 100 µg de P28GST asociate cu Alhydrogel® ca adjuvant recomandat. Pentru acest studiu, probele fecale înainte și după administrarea P28GST au fost obținute numai pentru 5 pacienți și au permis analiza microbiotei. Probele au fost congelate și depozitate la -80 ° C până la analiză.
2.6. Analiza microbiotei
Extracția ADN-ului, analiza metagenomică vizată 16S și analizele bioinformatice au fost realizate în conformitate cu metodologiile optimizate și standardizate dezvoltate de Genoscreen (Lille, Franța) și sunt complet detaliate în materialele suplimentare.
2.7. Tratament antibiotic și transplant de microbiote fecale
În unele experimente, șoarecii naivi cu vârste potrivite (n = 20) au fost tratați cu antibiotice cu spectru larg timp de 5 zile pentru a facilita reconstituirea ulterioară a transplantului de microbiote fecale (Abx) (Figura S4). Compoziția de cocktailuri antibiotice și procedurile conexe sunt furnizate în materialele suplimentare.
Probele fecale de zece șoareci donatori (200 până la 300 mg fiecare) au fost colectate aseptic și adunate în 0,5% cisteină 1X PBS pentru a maximiza conservarea bacteriilor anaerobe. Scaunele (100 mg.mL -1) de la donatorii martori sau imunizați au fost resuspendate prin amestec viguros timp de 1 min și centrifugate la 2000 rpm timp de 2 min pentru a depozita resturile. Supernatantul a fost colectat și livrat șoarecilor primiți în funcție de vârstă prin gavaj oral (200 μL fiecare primitor) în termen de 15 minute de la excreție pentru a preveni modificările compoziției bacteriene. Șoarecii primiți (n = 10 fiecare grup), fie hrăniți cu dietă normală și apă potabilă, fie tratați cu antibiotice au fost supuși transplantului de microbiotă trei zile consecutive pe săptămână timp de trei săptămâni, de la prima creștere a imunizării P28GST (vezi și Figura S4).
2.8. Analize statistice
În cele din urmă, aceste observații au fost în concordanță cu semnăturile transcripționale din colonele inflamate (Figura 2 A - H). Într-adevăr, reglarea ascendentă indusă de TNBS a genelor inflamatorii (cum ar fi Il-6, Il-1β și Tnf-α legate de imunitate) și genele legate de stresul oxidativ (precum Nos2 și Cox2) a fost semnificativ mai puțin marcată de P28GST + Tratament adjuvant. Acesta din urmă a normalizat, de asemenea, scăderea genelor homeostatice care au fost reglate în jos în colită (cum ar fi Pparγ și Zo1).
Curbele de rarefacție ale speciilor bacteriene în funcție de numărul de secvențe au indicat diversitatea totală a bacteriilor atinsă pentru cele patru grupuri experimentale în cele trei momente de timp considerate (a se vedea materialele suplimentare Figura S1A - C). Numărul mediu de unități taxonomice operaționale (OTU) de 150 per persoană este în acord cu alte studii efectuate la șoareci [32,33]. La D0, înainte de orice tratament, bogăția specifică a OTU observate a fost similară în toate grupurile, deși numărul mediu OTU a fost ușor, dar semnificativ mai mic în probele de fecale din grupul adjuvant. Acest lucru se poate datora eterogenității generale a șoarecilor de laborator. La D21, indicii de bogăție și Shannon nu mai erau diferiți între grupuri, sugerând o diversitate stabilizată neafectată de condițiile de locuință și tratamente. Cu toate acestea, la punctul final D33, spre deosebire de diversitatea alfa, datele au fost încă comparabile cu timpurile anterioare, o ușoară scădere a diversității a fost măsurată doar la animalele tratate cu P28GST (Materiale suplimentare Figura S1D - I și S2C).
Imunizările șoarecilor de către Adjuvant, P28GST și (P28GST + Adjuvant) induc ușoare modificări în compoziția microbiotei fecale în comparație cu soluția salină ca martor. Datele au fost generate prin analiza secvențelor genei 16S ARNr. (A) Abundența relativă medie la nivelul filumului pentru fiecare grup de șoareci, n = 8 per grup. (B) Abundența relativă individuală la nivel de filum arată consistența efectelor. (C) Abundența relativă medie la nivel de familie pentru fiecare grup de șoareci și (D) concentrați-vă pe abundența relativă medie reprezentată redus corespunzătoare la nivel de familie (sub 6%), n = 8 pe grup. Rezultatele sunt exprimate ca% din numărul total al unităților taxonomice operaționale (OTU). * p (*) 0,05 Figura 4 A - D). În ceea ce privește abundența relativă la nivel de filum și familie, distribuția taxonomică a confirmat ușoare modificări asociate imunomodulării. Aceste variații, moderat distincte de cele observate în experimentul anterior, erau încă destul de marginale. Din nou, unele modificări semnificative, dar marginale, au fost observate la OTU-uri rare, dar P28GST + Adjuvant nu a modificat structura generală a filelor și familiilor bacteriene dominante (Figura 4 E, F). Cu toate acestea, grupul de șoareci imunizați supuși colitei TNBS a recapitulat un nivel mai scăzut de inflamație intestinală comparativ cu șoarecii neimunizați, după cum arată o cantitate mai mică de pierdere în greutate, mortalitate redusă și o scădere semnificativă a scorurilor inflamatorii macroscopice (p = 0,014), (Figura 4 G - I). Acești șoareci sănătoși neimunizați și imunizați cu P28GST (Non-imu și, respectiv, Immu) servesc ca donatori de fecale pentru transplantul la primitori naivi (Non-imu-R și Immu-R).
Transplantul fecal nu reușește să inducă modificări substanțiale ale microbiotei și nu transferă rezistența la colită. Abundența relativă medie la filum (A) și la nivel familial (B) pentru fecale neimunizate (NI) și imunizate (I) de șoareci donatori, n = 5 per grup; respectivele transplanturi fecale reprezentative grupate (FT) (după resuspensie, n = 1) și fecalele corespunzătoare de șoareci primitori, în ziua 36, n = 5 per grup. Rezultatele sunt exprimate ca% din numărul total al OTU. (C) Procentul de pierdere a greutății inițiale (colită anterioară, în ziua 36 = D0) exprimată ca comparație a greutăților individuale înregistrate la ucidere (ziua 39 = D3) ca mijloace ± SEM și (D) scoruri clinice macroscopice (Wallace) ale colonilor în ziua 39, atât la grupul de șoareci neimunizați, cât și la cei imunizați; înseamnă ± SEM. n = 10 per grup pentru parametrii de evaluare a colitei (C și D); NS, nu diferă semnificativ de grupul de control pozitiv.
3.5. Transplantul de fecale la șoarecii tratați cu antibiotice nu este suficient pentru a restabili efectele antiinflamatorii benefice induse de P28GST
Microbiota fecală a pacienților cu boala Crohn nu a fost modificată în urma a trei injecții subcutanate cu P28GST. (A) Curbele de rarefiere ale OTU-urilor observate în funcție de citiri au demonstrat heterogenitatea mare a microbiotei în rândul pacienților la T0 și la T1 (B), n = 5. (C) Analiza principală a coordonatelor (PCoA) a microbiotei fecale colectate de la 5 pacienți cu CD înainte și după injecții cu P28GST folosind UniFrac ponderat. Culorile indică mostre de la fiecare individ. Comparația diversității beta între înainte și după injecțiile P28GST nu a arătat nicio diferență semnificativă cu testul PERMANOVA (p = 0,81, număr de permutări 10.000). Abundențe relative individuale analizate din secvențe metagenomice bazate pe 16S la filum (D) și la nivel familial (E) înainte (T0) și după realizarea protocolului de tratament (T1) descrieți distribuția bine conservată pentru fiecare specimen.
4. Discutie
În lucrarea de față, în care imunizarea de către o proteină unică de helmin (P28GST) modifică sensibilitatea șoarecilor la colită într-o manieră preventivă, am demonstrat anterior că astfel de efecte antiinflamatorii cuprind contribuția eozinofilelor mucoasei, acționând ca tip T-helper Inductori de răspuns (Th2) [7]. În plus față de inducția sistemică și locală a IL-13 și IL-5, poate fi ipotezat un posibil rol al IL-25, așa cum s-a demonstrat recent în protecția împotriva colitei amoebice, acționând prin eozinofile și suprimarea TNF-α printr-o o nouă cale de răspuns imun al mucoasei înnăscute [39].
În măsura în care hidroxidul de aluminiu a fost folosit de mult timp pentru a promova răspunsurile Th2, un mecanism propus se bazează pe contribuția bazofilelor [40], deși alte tipuri de celule pot părea cruciale. Cu toate acestea, nu putem exclude faptul că unele fenomene suplimentare ar putea contribui și ele. În consecință, într-un alt context al provocării Toxoplasma gondii, de exemplu, s-a dovedit că imunizarea cu TgHSP70, o proteină de șoc termic, poate induce protecție și un eveniment antiinflamator masiv prin efecte oxidative puternice la un loc îndepărtat, în ciuda faptului că nu există direct rolul asupra neutralizării anticorpilor și nici asupra controlului proceselor de infecție cu paraziți [41]. Un mecanism similar ar putea apărea și în favoarea homeostaziei bacteriene intestinale și a prevenirii ulterioare a colitei, așa cum a fost dezvăluit recent [42], deși rămâne de demonstrat. În mod colectiv, modul celular precis de acțiune indus de imunizarea P28GST rămâne de elucidat, dar rezultatele preliminare indică rolul proeminent al celulelor reglatoare (DC regulatoare, T reg și macrofage M2) și citokina IL-10 antiinflamatoare.
Rolul posibil al microbiotei intestinale în acest protocol de imunomodulare este o întrebare cheie care trebuia explorată. Cu alte cuvinte, imunizarea P28GST modulează microbiota intestinală? Dacă da, unele dintre efectele de protecție sunt susținute de astfel de schimbări bacteriene? În studiul de față, am arătat în mod clar că diversitatea generală și bogăția microbiotei fecale de șoarece nu a fost influențată de imunomodularea P28GST. Doar ușoare variații ale impozitului foarte redus au putut fi identificate. De remarcat, aceste variații marginale au fost moderat distincte între ambele experimente, probabil din cauza discrepanțelor în microflora bazală din diferite loturi și timp de animale, dar fără a afecta efectele benefice ale P28GST asupra colitei. Acest lucru a fost puternic în contrast cu un raport recent care arată că ameliorarea astmului alergic urmată de infecția cu H. polygyrus a implicat compoziția microbiotei și producția ulterioară de acizi grași cu lanț scurt pentru a promova răspunsurile celulei T reglatoare ale gazdei [43].
Identificarea modificărilor în comunitatea microbiană depinde în mare măsură de metodologiile utilizate. Astfel, o posibilă contribuție a microbiotei intestinale la efectele antiinflamatorii mediate de P28GST, dacă există, ar trebui să fie destul de subtilă sau să implice un alt mecanism, cum ar fi o bacterie neidentificată sau o asociere complexă a mai multor microbi cu și consecințe legate de metabolomic. Cu toate acestea, abordările noastre de transplant fecal nu au reușit să demonstreze că modificările microbiotei intestinale induse de P28GST + Adjuvant au fost în sine capabile să restabilească efectele antiinflamatorii induse de P28GST. Având în vedere compoziția foarte strânsă a microbiotei la donatori și șoareci naivi, chiar și la cei pre-tratați cu antibiotice, nu a fost, prin urmare, surprinzător faptul că nu s-au observat diferențe în ameliorarea colitei după transplantul fecal în ambele grupuri de receptori, indiferent de starea de imunizare.
Colectiv, am ajuns la concluzia că a existat (i) un impact redus al imunomodulării P28GST asupra microbiotei intestinale și (ii) lipsa unui rol major pentru o astfel de microbiotă în medierea efectelor de protecție. Acest lucru prezintă un interes major în perspectiva terapeutică a P28GST la pacienții cu IBD, scăzând riscul de antagonism datorat antibioticelor sau altor tratamente antimicrobiene. Mai mult, deși eterogenitatea intrinsecă a microbiomului intestinal în diverse populații umane poate orienta răspunsurile imune înnăscute și adaptative [29], faptul că microbiota nu a fost mediatorul efectelor benefice bazate pe P28GST ne determină să propunem un astfel de tratament pacienților, chiar dacă acestea sunt supuse disbiozei și dezechilibrului microbian, care ar putea diminua imunogenitatea în IBD. Acest lucru este încurajator, în timp ce anticipăm rezultate promițătoare ale unor noi studii clinice care vizează bolile inflamatorii intestinale. Mai mult, munca noastră oferă, de asemenea, perspective pentru utilizarea P28GST în alte patologii legate de imunitate.
Mulțumiri
Autorii ar dori să mulțumească cu recunoștință pacienților pentru participarea la studiul ACROHNEM, clinicienilor și tuturor membrilor personalului, în special Laurent Beghin și Patrick Gelé, pentru contribuțiile lor. De asemenea, suntem recunoscători lui Marie Delbeke (U 995 Inserm), Stéphanie Ferreira, Marie Clément (Genoscreen), Ségolène Caboche și Gael Even (PEGASE) pentru sfaturile lor tehnice, precum și Dominique Hughes și Thomas Belcher pentru corectarea sintaxei englezești.
- Beneficii, utilizări, efecte secundare, dozare și interacțiuni ale sănătății coralilor
- Efecte adverse corticosteroide - StatPearls - Bibliotecă NCBI
- CORDYCEPS Evaluări ale utilizatorilor pentru eficacitate, efecte secundare, siguranță și interacțiuni - WebMD
- Utilizări de estradiol, dozare; Efecte secundare
- Beneficii ale extractului de semințe de țelină, efecte secundare; Dozare