Tipul articolului: Articolul de revizuire
Afilieri: Departamentul de Biologie, Universitatea Lamar, Beaumont, TX, SUA
Corespondență: [*] Corespondență către: Maryam Vasefi, profesor asistent, Departamentul de biologie, Universitatea Lamar, clădirea Hayes Biology, camera 101A, P.O. Box 10037, Beaumont, TX 77710, SUA. Telefon: +1 409 880 7090; E-mail: [e-mail protejat] .
Cuvinte cheie: boala Alzheimer, dietă, sensibilitate la gluten, inflamație, microbiom, stres oxidativ
Abstract
Tulburările neurocognitive, cum ar fi boala Alzheimer (AD), afectează milioane de oameni din întreaga lume și se caracterizează prin declin cognitiv. Studiile la om și animale au arătat că răspunsul imunitar cronic și inflamația sunt factori importanți în patogeneza AD. Inflamația cronică poate accelera agregarea peptidelor β-amiloid și ulterior hiperfosforilarea proteinelor tau. Etiologia exactă a AD nu este clară, dar factorii genetici și de mediu, cum ar fi vârsta, istoricul familial și stilul de viață sunt legate de bolile neurodegenerative. Obiceiurile stilului de viață, cum ar fi dieta slabă, sunt asociate cu inflamația și ar putea accelera sau încetini progresia bolilor neurodegenerative. Aici oferim o revizuire a condițiilor potențiale și a factorilor care stimulează procesele inflamatorii în AD. Înțelegerea mecanismelor inflamatorii care influențează dezvoltarea AD poate ajuta la protejarea împotriva demenței și AD.
INTRODUCERE
Datorită îmbătrânirii populației la nivel global, se așteaptă ca numărul celor care trăiesc cu demență să crească de trei ori până în 2050 [1], amenințând o demență epidemică globală [2]. Boala Alzheimer (AD) este unul dintre cele mai frecvente tipuri de demență. Costurile anuale estimate pentru îngrijirea pacienților cu AD și demență vor crește de la 307 miliarde de dolari la 1,5 trilioane de dolari. O întârziere a apariției AD cu 1 până la 5 ani are ca rezultat un câștig economic de la 183.227 USD la 511.208 USD [3]. În plus față de câștigul economic, întârzierea AD este benefică sănătății individuale și publice.
AD este o tulburare neurodegenerativă care progresează lent, care se caracterizează prin plăci de amiloid-β (Aβ) și încurcături neurofibrilare care se acumulează în creier cu ani sau chiar decenii înainte de apariția simptomelor. Inflamația creierului asociată cu îmbătrânirea poate duce la creșterea producției de placă amiloidă și încurcarea tau și poate promova AD. Descoperirea căilor inflamatorii în creier a determinat unii cercetători să propună că mecanismele imunologice/inflamatorii joacă un rol fundamental în dezvoltarea AD [4-6]. Dovezile sugerează că pacienții cu AD suferă o inflamație cronică, care este condusă de și îmbunătățește dereglarea sistemului imunitar.
Impactul factorilor alimentari precum consumul de carbohidrați, uleiurile vegetale bogate în acizi grași omega-6 și acizii grași omega-3 poate avea efecte majore asupra răspunsului imun și a inflamației [16-18]. Dieta și afecțiunile alimentare pot provoca inflamații cronice, ceea ce crește riscul de demență și AD. Un stil de viață care include o dietă sănătoasă și o activitate fizică poate proteja împotriva declinului cognitiv și poate întârzia apariția AD [16, 19]. În această revizuire, condițiile legate de dietă și alimente care pot provoca inflamații cronice care pot fi legate de AD vor fi discutate pe baza principalelor lor mecanisme biologice de acțiune. Scopul acestei lucrări de revizuire este de a explora legătura dintre dietă și inflamație și efectul acesteia asupra stării cognitive. În scopuri de colectare a datelor, a fost utilizat ghidul PRISMA. Strategia inițială de căutare a identificat unele n = 1.426 lucrări; n = 120 de studii au fost incluse după examinarea rezumatului și n = 47 de articole au îndeplinit criteriile de includere. O nouă perspectivă asupra modului în care obiceiurile stilului de viață, cum ar fi dieta, se încadrează în patologia AD prin răspunsul inflamator cronic poate ajuta la conceperea de noi strategii pentru a întârzia progresia bolii.
VITAMINE
Vitamina B
Vitamina C
Este bine stabilit că persoanele cu insuficiență cognitivă ușoară și AD au niveluri plasmatice scăzute de acid ascorbic [26-29]. Vitamina C sau acidul ascorbic este teoretizată pentru a împiedica patologia AD și neurodegenerarea prin două mecanisme principale: modularea stresului oxidativ și neuroinflamarea [26, 30]. Proprietățile antiinflamatorii ale acidului ascorbic sunt atribuite în principal capacității sale de a bloca producția stimulată de lipopolizaharide de mediatori inflamatori [31], suprimând astfel MAPK și NF-κSisteme B [26, 32]. În plus, suplimentarea cu acid ascorbic reduce acumularea de placă amiloidă la modelele AD de șoarece [33-36]. Un studiu observațional a raportat că suplimentarea vitaminelor antioxidante (C și E) a fost legată de scăderea incidenței și prevalenței AD [37].
Alte acțiuni benefice includ protecția creierului împotriva stresului oxidativ mediat de glutamat sau excitotoxicitate [26, 38]. Eliberarea excesivă de glutamat duce la hiperactivarea receptorilor N-metil-d-aspartat (NMDA) și la afectarea neuronală. Cu toate acestea, acidul ascorbic previne excitotoxicitatea mediată de glutamat prin inhibarea legării glutamatului de receptorii NMDA [39-41].
Vitamina D
Vitamina E
Vitamina E exercită acțiuni neuroprotectoare prin modularea cogniției prin activitate antioxidantă și antiinflamatorie [49, 55]. Un studiu suplimentar al hipocampului de șobolan a constatat că deficitul de vitamina E îmbunătățește depunerea de Aβ prin reducerea expresiei genelor care codifică proteinele care participă indirect sau direct la clearance-ul Aβ, cum ar fi enzima care degradează insulina [56, 57]. Pentru prima dată, Santos și colegii au raportat că vitamina E (2000 UI/d vitamina E sau placebo timp de doi ani) încetinește progresia AD [58]. De atunci, mai multe studii clinice au investigat eficacitatea vitaminei E în tratamentul AD. Cu toate acestea, unele dintre studii nu prezintă niciun beneficiu [59-62].
Vitamina K
Dovezile arată că indivizii cu AD au adesea concentrații serice scăzute de vitamina K [63-65]. Mai mult, pacienții geriatrici care utilizează antagoniști ai vitaminei K ca medicamente anticoagulante suferă de tulburări cognitive mai frecvente decât pacienții cărora nu li s-au prescris aceste medicamente [66]. Vitamina K este implicată în dezvoltarea și supraviețuirea neuronilor prin efecte anti-apoptotice și antiinflamatorii mediate de gazul 6, proteina S și sfingolipidele [67]. Vitamina K poate reduce riscul de AD prin modularea metabolismului sfingolipidic, ducând la un clearance al Aβ crescut. Sfingolipidele sunt o clasă de molecule de lipide care conferă caracteristici specifice membranei, reglând astfel traficul subcelular și căile de semnalizare. Sfingolipidele pot favoriza acumularea de Aβ în compartimentele endozomale și lizozomale [68]. Deficitul de vitamina K poate scădea activitatea enzimelor care sunt implicate în metabolismul sfingolipidelor, ducând la un metabolism necorespunzător al sfingolipidelor și, în cele din urmă, la un deficit slab de Aβ și la un declin cognitiv [56]. Există o lipsă de studii clinice la om cu privire la relația dintre vitamina K și îmbunătățirea AD.
În ciuda unei baze teoretice promițătoare cu privire la rolul antioxidant și antiinflamator al vitaminelor, studiile clinice randomizate nu au demonstrat un efect neuroprotector al suplimentării vitaminelor asupra dezvoltării sau prevenirii AD. Tratamentul cu vitamine ar putea arăta un efect nesigur asupra AD din cauza diferențelor în 1) efectul antioxidant și antiinflamator al vitaminelor la fiecare persoană, 2) dieta și starea nutrițională a pacienților, 3) progresia bolii și 4) tipurile de deficit de vitamine al pacienților. Cu toate acestea, s-a stabilit că persoanele cu insuficiență cognitivă ușoară și AD pot avea niveluri plasmatice scăzute de una sau mai multe vitamine.
Tratamentul aleatoriu al persoanelor cu AD ușoară până la moderată cu vitamina C și E, α-acidul lipoic și coenzima Q3 au redus stresul oxidativ din creier; cu toate acestea, nu a influențat patologia amiloidă sau tau legată de biomarkerul lichidului cefalorahidian și a ridicat, de asemenea, problema potențială a declinului cognitiv mai rapid [69]. Cornelli a raportat că pacienții cu AD tratați cu un inhibitor al colinesterazei în combinație cu o doză mică de antioxidanți (carnozină, coenzima Q10, vitamina E, vitamina C, beta-caroten, seleniu, L-cisteină, vitaminele B6, B9 și B12 și Ginkgo biloba) a prezentat o îmbunătățire semnificativă [70]. Dovezile disponibile sunt insuficiente și nu susțin pe deplin rolul vitaminelor cu declin cognitiv în ceea ce privește prevenirea sau tratamentul AD și sunt necesare investigații suplimentare.
ECHILIBRUL ACIZILOR GRASI OMEGA-3/OMEGA-6
Dezechilibrul acizilor grași omega-3/omega-6 din dieta tipică occidentală provoacă procese inflamatorii periferice dăunătoare [71, 72]. Dovezile sugerează că acțiunile omega-3 promovează o stare antiinflamatoare, în timp ce acțiunile omega-6 cresc inflamația [71, 72]. Consumul crescut de acid gras omega-6 duce la supraproducția moleculelor de semnalizare derivate din omega-6 (eicosanoide), care atunci când sunt produse în cantități mari par să contribuie la apariția unei stări inflamatorii printr-o varietate de mecanisme, inclusiv eliberarea de pro - citokine inflamatorii [73]. Mai mult, creșterea omega-6 în dieta umană coincide cu creșterea prevalenței obezității, un factor de risc semnificativ pentru dezvoltarea și progresia AD care duce la o inflamație generalizată, sistemică [71, 72]. O analiză sistematică a 13 studii pe animale și 14 studii la om susține asocierea dintre acizii grași omega-3/omega-6 din dietă și riscul de a dezvolta AD [74]. Dovezile susțin rolul omega-3 ca acid gras antiinflamator în prevenirea declinului cognitiv în AD în stadiul incipient al bolii.
SENSIBILITATEA GLUTENĂ
Boala celiacă (CD) este o boală autoimună declanșată de ingestia de gluten care afectează aproximativ 1% din populație [75, 76]. Recent, CD a ajuns să fie înțeles ca fiind doar una dintre posibilele manifestări clinice ale bolilor sensibile la gluten [75, 77]. Sensibilitatea la gluten non-celiac (NCGS) este un sindrom caracterizat prin simptome legate de ingestia de gluten în absența CD sau alergie la grâu [77].
Sensibilitate non-celiacă la gluten
NCGS poate provoca patologia AD prin inițierea unui răspuns al sistemului imunitar suprazel în urma ingestiei de gluten care duce la o stare cronică de inflamație [77, 78]. Primele studii ale NCGS au indicat faptul că doar sistemul imunitar înnăscut a fost implicat în patogeneza sa [78, 79], dar studii recente au detectat prezența anticorpilor anti-gliadină care pot indica implicarea imunității adaptive [80, 81]. Complicațiile de diagnostic și simptomele ambigue contribuie la gestionarea pe scară largă a bolii NCGS, care prelungește activarea sistemului imunitar și inflamația asociată [81]. Dacă se acceptă faptul că NCGS promovează o stare inflamatorie cronică într-o metodă similară cu obezitatea sau traumatismul creierului [4], factori de risc recunoscuți pentru AD, atunci NCGS poate duce la neuroinflamare cerebrală și patogeneză AD.
Boala celiaca
La indivizii CD, susceptibilitatea genetică este prezentă sub formă de mutații specifice ale alelelor majore de histocompatibilitate (clasa II MHC) [82]. Moleculele MHC clasa II sunt prezente pe celulele care prezintă antigen, unde rolul lor este de a prezenta peptide antigenice altor celule imune, cum ar fi celulele T. Formele mutante ale genei pot lega peptidele glutenice și pot activa celulele T în mucoasa intestinului subțire [82, 83]. Odată activate, aceste celule T cresc producția de citokină IFN-γ, ceea ce duce la afectarea mucoasei intestinului subțire [82, 84, 85].
Persoanele cu afișare CD au crescut permeabilitatea intestinului subțire ca o consecință a patologiei autoimune [78]. Bacteriile și ciupercile care colonizează tractul digestiv secretă amiloizi, lipopolizaharide [31] și alte exsudate microbiene din membranele lor exterioare [86-90]. În condiții de permeabilitate intestinală crescută, aceste amiloizi microbieni și lipopolizaharide pot scăpa din tractul digestiv și pot induce sistemul imunitar să crească secreția de citokine pro-inflamatorii [88, 91, 92]. Astfel, permeabilitatea intestinală crescută în CD poate contribui la apariția unei stări inflamatorii periferice cronice și, astfel, la patogeneza AD. Pentru discuții suplimentare despre acest subiect, consultați următoarea secțiune despre microbiom.
MICROBIOMUL
Microbiomul influențează activitatea SNC, iar SNC influențează activitatea microbiomului [93, 94]. Tulburările care modifică compoziția microbiomului intestinal pot stimula diferite căi care, în cele din urmă, cresc riscul de AD. Microbiota intestinală poate fi perturbată în urma expunerii la tratament cu antibiotice, modificări ale dietei, medicamente antiinflamatoare nesteroidiene, aditivi alimentari, diferite condiții de sănătate și infecții patogene [88, 95-99].
Creșterea permeabilității intestinului și a secrețiilor bacteriene
Bacteriile și ciupercile care colonizează tractul digestiv uman secretă amiloizi, lipopolizaharide [31] și alte exsudate microbiene din membranele lor exterioare [86-90, 100]. De exemplu, Escherichia coli produc amiloizi extracelulari, fibre cret care facilitează aderența la suprafață. Produsele amiloide microbiomice, cum ar fi CsgA, crețul și peptidele Aβ42 sunt recunoscute de receptorii TLR2/TLR1 care sunt răspunsuri pro-inflamatorii mediate [90]. Oamenii par să susțină expunerea pe tot parcursul vieții la cantități mari de proteine amiloide secretate de microbiota intestinală, care pot contribui în cele din urmă la patogeneza AD în timpul îmbătrânirii [101-103]. Atât îmbătrânirea cât și dereglarea microbiotei intestinale contribuie la o creștere a permeabilității sau „scurgerii” intestinului [94, 104]; astfel, în anumite condiții, aceste amiloizi microbieni și lipopolizaharide pot scăpa din tractul digestiv și pot determina sistemul imunitar să crească secreția de citokine proinflamatorii [88, 91, 92]. Creșterea secreției de citokine proinflamatorii poate contribui la apariția rezistenței la insulină, un factor de risc recunoscut pentru AD [88, 105]. În plus, o creștere a stării inflamatorii generale poate contribui ea însăși la patogeneza AD.
Mai mult, amiloidele derivate din bacterii care ar putea scăpa ar putea provoca o creștere a ROS și activarea ulterioară a NF-κB, conducând la reglarea în sus a microARN-34a. NF-κB este un mediator esențial al răspunsurilor inflamatorii, inclusiv exprimarea genelor pro-inflamatorii, cum ar fi citokinele, activarea și diferențierea celulelor imune înnăscute, cum ar fi celulele T inflamatorii și activarea caspazelor inflamatorii, cum ar fi inflammasomul NLRP3 [106]. Mai mult, NF-κB crește expresia microARN-34, parând a regla în jos expresia receptorilor declanșatori exprimați pe celulele mieloide 2 (TREM2) [88]. Întrucât TREM2 participă direct la detectarea și eliminarea peptidelor Aβ40 și Aβ42, este probabil ca reglarea descendentă a acesteia să ducă la deteriorarea fagocitozei peptidice și la agregarea amiloidă îmbunătățită [88, 107, 108].
În plus, modificări ale cantității de neurotransmițători γ-acidul aminobutiric (GABA), serotonina (5-hidroxitriptamina), factorul neurotrofic derivat din creier și glutamatul datorită modificărilor stării microbiomului pot contribui la patogeneza AD [94, 109].
Ipoteza igienei
DISCUŢIE
Dieta mediteraneană este o dietă săracă în carbohidrați, cu cantități slabe de proteine. Kroemer și colegii săi caracterizează aportul excesiv de carbohidrați care au mediat efectele nocive asupra sănătății umane drept „carbotoxicitate”. Dietele cu conținut scăzut de carbohidrați, cu un consum adecvat de proteine, determină ketogeneza, care reprezintă conversia grăsimii corporale în cetone. Ketogeneza conferă proprietăți neuroprotectoare organismului prin reducerea inflamației și a stresului oxidativ și creșterea autofagiei [130].
Se știe puțin despre legătura dintre sensibilitatea la gluten și declinul cognitiv. Cu toate acestea, deficiența de nutrienți, inflamația și răspunsul imun puternic în creier pune pacienții cu CD la un risc mai mare de declin cognitiv.
După cum indică literatura de specialitate, inflamația contribuie la patogeneza AD. Căile inflamatorii pot accelera progresia AD [131] și a mai multor alte boli legate de vârstă [132]. O terapie antiinflamatoare ar trebui să fie benefică în întârzierea progresiei AD. Cu toate acestea, rezultatele sunt departe de a fi concludente [131]. Este important să știm că inflamația cronică este legată de neurobiologia și progresia AD [133] prin diferite mecanisme, cum ar fi producerea și eliminarea Aβ. Plăcile Aβ pot declanșa inflamația într-o buclă de feedback pozitiv [132].
CONCLUZIE
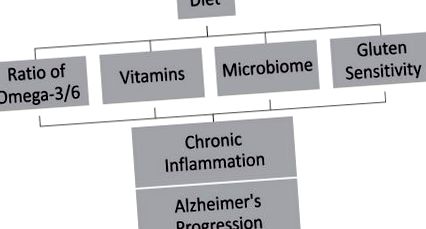
Dieta joacă un rol semnificativ în introducerea factorilor antioxidanți și antiinflamatori, în modelarea microbiomilor și în tratarea problemelor digestive, cum ar fi sensibilitatea la gluten, care ar putea scădea inflamația și progresia AD (Fig. 1). Evenimentele inflamatorii de-a lungul vieții unui individ sugerează prezența unei afecțiuni inflamatorii cronice. Efectele cumulative ale acestei inflamații cronice pot avea un impact asupra diferitelor etape ale AD [132]. Dezvoltarea unor abordări antiinflamatorii la obiceiurile stilului de viață poate încetini progresia sau poate întârzia apariția AD. Intervențiile privind comportamentul sănătății, cum ar fi aportul alimentar, pot întârzia sau încetini progresia AD [134-136] cu 3 până la 5 ani [3]. Educarea publicului cu privire la întârzierea AD prin detectarea precoce a bolii în combinație cu intervenția timpurie poate acționa ca metode eficiente de atenuare a AD. În plus, sunt necesare studii intervenționale pentru a lua în considerare dacă o dietă scăzută de antioxidanți și antiinflamatori contribuie la progresia AD și dacă o dietă bogată în antioxidanți și antiinflamatori poate reduce riscul de afectare cognitivă și AD.
Dieta poate accelera progresia bolii Alzheimer pe parcursul inflamației cronice.
CONFLICTUL DE INTERES
Autorii nu au niciun conflict de interese de raportat.
- Grăsimea, soarta și bolile De ce exercițiile fizice și dieta nu sunt suficiente de Peter Gluckman
- Boala ficatului gras este asociată cu severitatea pancreatitei acute A revizuire sistematică și
- Eczema Detox Dieta cu conținut scăzut de substanțe chimice pentru eliminarea inflamației pielii de Karen Fischer
- Boli hepatice grase la dieta copiilor și sfaturi pentru exerciții fizice pentru a preveni și inversa starea
- Supraexprimarea CYP2J2 atenuează boala hepatică grasă nealcoolică indusă de dieta bogată în grăsimi la șoareci