Abstract
Introducere
Țesutul adipos este un organ esențial și este principalul loc pentru stocarea energiei sub formă de triacilgliceroli (TG). Țesutul adipos alb (WAT) și țesutul adipos maro (BAT) sunt tipurile predominante la mamifere. Deoarece WAT și BAT au origini de dezvoltare diferite și majoritatea țesutului adipos uman este WAT, acest tip va fi punctul central al acestei revizuiri. În mod tradițional, studiile funcției WAT s-au rotit în jurul rolului său semnificativ în controlul homeostaziei energetice prin stocarea și eliberarea lipidelor ca răspuns la cererile de energie. Cu toate acestea, WAT are proprietăți suplimentare, inclusiv funcții secretoare (eliberarea de adipokine), care afectează sensibilitatea la insulină și homeostazia metabolică, contribuind la patogeneza obezității și a comorbidităților conexe [1].
WAT este distribuit pe tot corpul în mai multe depozite, fiecare cu funcții distincte. Dovezile sugerează că distribuția regională a WAT, mai degrabă decât obezitatea generală, poate fi un predictor mai puternic al riscurilor metabolice pentru sănătate. Acumularea de grăsime în partea superioară a corpului (și anume țesutul adipos visceral [TVA] dar și abdominal subcutanat [scABD]) conferă un risc mai mare de a dezvolta diabet zaharat de tip 2 și boli cardiovasculare, în timp ce în corpul inferior, gluteal subcutanat și femural subcutanat ( scFEM) grăsimea poate fi protejantă din punct de vedere metabolic [2]. Dimorfismul sexual în distribuția grăsimilor este, de asemenea, bine documentat: femeile, deși au, în medie, un procent mai mare de grăsime corporală decât bărbații, prezintă acumularea preferențială de grăsime în depozitele „protectoare” ale corpului inferior [3]. În schimb, bărbații au tendința de a depune mai multe grăsimi în depozitul TVA al corpului superior [4]. Diferențele de sex în distribuția grăsimilor și funcțiile distincte ale depozitelor de grăsime au fost discutate în recenziile anterioare [5, 6].
Deși majoritatea creșterii adipoase are loc în copilărie și adolescență, WAT își păstrează capacitatea de a se extinde în timpul maturității ca răspuns la fluctuațiile echilibrului energetic. Mărimea adipozității în timpul dezvoltării obezității este determinată de modificările dinamice ale sintezei și îndepărtării (adică a cifrei de afaceri) a celulelor adipoase (pre-adipocite și adipocite) și TG. În ciuda consecințelor negative asupra sănătății asociate cu obezitatea, se știe puțin despre cifra de afaceri WAT in vivo la om. Această revizuire oferă un scurt rezumat al constatărilor obținute din metodele in vitro, precum și o prezentare generală a două abordări in vivo care sunt puse în aplicare pentru a evalua cifra de afaceri a celulelor adipoase și a TG-urilor. În cele din urmă, se discută rolul fluctuației WAT în sănătatea și bolile metabolice.
Cifra de afaceri adipoasă
Expansiunea adipoasă
Cu toate acestea, rolul adipogenezei (adică hiperplazia) în riscurile pentru sănătate este discutabil. Observații recente au raportat o prevalență mai mare a celulelor grase mici la persoanele rezistente la insulină și la cei cu diabet zaharat de tip 2, comparativ cu persoanele sănătoase, sugerând expansiune hiperplazică [8, 14,15,16]. Important, am arătat că 8 săptămâni de supraalimentare cu 40% (
Creșterea în greutate de 7,6 kg) a dus la o afectare mai mare a sensibilității la insulină la indivizii care aveau adipocite mai mici la momentul inițial, comparativ cu cei care aveau adipocite mai mari [17]. Un alt studiu de supraalimentare umană a demonstrat că dimensiunea mai mică a adipocitelor la momentul inițial a prezis o scădere a sensibilității la insulină după o creștere în greutate de 3,2 kg în decurs de 4 săptămâni [18]. Aceste studii recente sunt contrare ipotezei expandabilității adipoase și indică faptul că o populație crescută de adipocite mici (sugerând hiperplazie) este asociată cu rezultate metabolice afectate de sănătate.
Diferențe de depozit în expansiunea adipoasă
Asocierile opuse ale distribuției de grăsime a corpului superior față de corpul inferior cu sănătatea metabolică se datorează probabil caracteristicilor intrinseci ale depozitelor WAT. Puține studii au evaluat diferențele regionale în adipogeneza la om. Au fost raportate diferențe de depozit în pre-adipocite cultivate din WAT, grăsimea scABD având o capacitate de proliferare și diferențiere mai mare decât grăsimea scFEM [19, 20] și TVA [21]. O altă evaluare a dimensiunii adipocitelor a sugerat expansiunea grăsimii specifice depozitului ca răspuns la supraalimentare: în principal hipertrofie în grăsimea scABD și în principal hiperplazie în grăsimea scFEM [22].
Diferențe de sex în expansiunea adipoasă
Studiile din anii 1980 au raportat expansiune hiperplazică (număr mai mare de adipocite) a depozitelor de corp inferior la femei și depozite abdominale la bărbați [23]. Analize mai recente ale dimensiunii celulelor grase sugerează că expansiunea țesutului adipos al corpului inferior este guvernată în primul rând de hiperplazie la femei, dar de hipertrofie la bărbați [24]. Un procent mai mare de adipocite diferențiate timpurii a fost identificat în depozitul scFEM al femeilor față de bărbați [20].
Moartea adipocitelor
Pe lângă expansiunea adipoasă, moartea adipocitelor este o componentă vitală a fluctuației adipoase [25]. Studiile pe rozătoare relevă un model oscilator de celularitate adipoasă, incluzând cicluri de hipertrofie, hiperplazie și moarte adipocitară, cu moarte adipocitară crescută la rozătoarele obeze [25, 26]. Datele la om sunt rare. Creșterea morții adipocitelor a fost implicată în obezitatea umană [25]. A fost raportat un răspuns crescut la stimulii apoptotici ai pre-adipocitelor TVA (față de grăsimea scABD) [27, 28]. Un studiu sugerează că pre-adipocitele scABD de la femeile obeze sunt mai susceptibile la apoptoză decât pre-adipocitele scFEM [20]. Până în prezent, niciun studiu nu a evaluat in vivo moartea adipocitelor la om și legătura sa funcțională cu distribuția grăsimilor și sănătatea metabolică.
Studii in vivo pentru măsurarea cifrei de afaceri adipoase
Metoda de etichetare 2 H
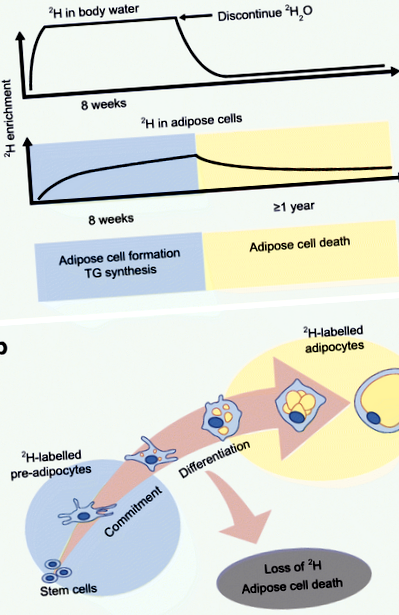
O metodă nouă a fost dezvoltată de laboratorul Hellerstein pentru a evalua cinetica adipoasă in vivo utilizând încorporarea izotopului deuteriu stabil în țesutul adipos [30]. Protocolul, care a fost validat la șoareci și apoi la oameni, include o creștere inițială de 2 H2O (apă grea) pentru a realiza îmbogățirea sistemică de 2 H a apei corpului, urmată de un aport zilnic suficient pentru a menține valorile de îmbogățire [30] (Fig. 1). Cei 2 H din apa grea sunt apoi încorporați în celulele adipoase, iar îmbogățirea izotopului este măsurată prin spectrometrie de masă și aplicarea analizei de distribuție a izotopomerilor de masă (MIDA). Măsurătorile sintezei ADN-ului marcat cu 2 H denotă pre-adipocite și adipocite nou formate (prin diferențiere pre-adipocite) [31], în timp ce încorporarea 2 H în fragmentul glicerol reprezintă sinteza TG [32].
Protocol de etichetare 2 H pentru a evalua in vivo adipos. (A) Metoda de marcare a deuteriului a fost validată pentru a furniza estimări in vivo ale formării celulelor adipoase, sintezei TG și morții adipocitelor la oameni prin încorporarea izotopului stabil 2 H în apa corpului și în țesutul adipos. 2 H se administrează ca 2 H2O în așa fel încât să se obțină o îmbogățire sistemică de 2 H a apei corpului aproape de platou, urmată de aport zilnic pentru a menține valorile de îmbogățire. Îmbogățirea izotopică a celulelor adipoase este măsurată prin spectrometrie de masă și aplicarea MIDA. (b) Îmbogățirea a 2 H în țesut adipos (pre-adipocite și adipocite) oferă măsuri de formare a celulelor adipoase și de moarte. Această cifră este disponibilă ca diapozitiv descărcabil
Hellerstein și colegii săi au aplicat abordarea de etichetare 2 H pentru a furniza dovezi in vivo că adipocitele sunt generate la om în timpul maturității [33]. Recent am evaluat cinetica in vivo în WAT subcutanat din depozitele scABD și scFEM utilizând o încorporare de 8 H de 2 săptămâni în celulele adipoase la femeile obeze [34]. Am raportat, pentru prima dată, diferențe de depozit în cinetica in vivo, cu formare mai mare de celule adipoase (pre-adipocite și adipocite) și rate de sinteză TG în depozitul scFEM în raport cu depozitul scABD [34, 38]. Aceste date demonstrează că cinetica in vivo a celulelor adipoase diferă între depozitele WAT la om și consolidează alte observații experimentale care implică coapsa ca un depozit mai eficient pentru extinderea și acomodarea lipidelor la femei [2, 5]. Interesant, ratele de formare a celulelor adipoase atât în depozitele scABD, cât și în scFEM au fost corelate pozitiv cu procentul de grăsime corporală, IMC și adipozitatea viscerală, în timp ce asociate negativ cu sensibilitatea la insulină [35]. Aceste date noi contestă ipoteza expandabilității țesutului adipos și oferă primele dovezi ale unei asocieri între fațete ale sănătății metabolice afectate și formarea in vivo mai mare, nu mai mică, a celulelor adipoase.
Laboratorul Hellerstein a fost, de asemenea, primul care a aplicat metoda de etichetare 2 H pentru a măsura direct sinteza TG și cifra de afaceri în WAT uman in vivo [33]. Timpul de înjumătățire TG a fost stabilit
6 luni [33], similar cu estimările anterioare realizate prin tehnici indirecte [36]. Alte laboratoare au aplicat abordarea de etichetare 2 H pentru a demonstra că cinetica TG în WAT joacă un rol semnificativ în metabolism, raportând că ratele in vivo ale sintezei TG au fost semnificativ mai mici la persoanele rezistente la insulină decât la persoanele sensibile la insulină [37]. Interesant este că recent am identificat diferențele de rasă și depozit în înlocuirea TG, cu o rată mai mare de sinteză TG la indivizii albi vs negri și în depozitul scFEM vs scABD [38]. Aceste date sunt interesante, deoarece au fost descrise diferențele de rasă în sănătatea cardiometabolică [39].
14 C metoda de întâlnire
Rotația in vivo a adipocitelor la om a fost, de asemenea, estimată prin măsurarea integrării 14 C atmosferice, eliberate din testele cu bombe nucleare în timpul Războiului Rece (1955-1963), în ADN-ul genomic al WAT [40]. După încetarea perioadei de testare a bombelor nucleare, nivelurile de 14 C din mediu au scăzut exponențial, iar 14 C au fost încorporate în plante. Consumul de plante sau de animale care au mâncat plante a dus la concentrații de 14 C în corpul uman care le reflectă pe cele din atmosferă la un moment dat. Prin urmare, această analiză retrospectivă a estimat modificările nete ale cifrei de afaceri adipoase pe o perioadă de aproximativ patru decenii prin măsurarea nivelurilor de 14 C în ADN prin spectrometrie de masă a acceleratorului și corelarea acestor valori cu datele atmosferice de 14 C.
Spalding și colab. Au raportat că
8,4% din adipocitele scABD in vivo sunt înlocuite în fiecare an, indiferent de vârstă sau gradul de obezitate [40]. Autorii au sugerat, de asemenea, că generarea adipocitelor și ratele de deces au fost în echilibru la persoanele cu obezitate cu debut precoce și că numărul total de celule adipoase este strict reglementat, chiar și cu creșterea sau pierderea în greutate. Aceste date sugerează că numărul total de adipocite poate fi stabilit în timpul copilăriei și adolescenței și constant în timpul maturității. Cu toate acestea, sunt necesare studii suplimentare pentru a evalua rotația grăsimilor la persoanele cu debut de obezitate mai târziu în viață, care se îngrașă treptat pe o perioadă prelungită de timp, deoarece pot apărea modificări ale numărului total de adipocite. Într-adevăr, un studiu a arătat că numărul total de adipocite a crescut în depozitul scFEM al femeilor în timpul supraalimentării [22]. Deoarece datele in vitro bazate pe indicele morfologiei adipocitelor susțin ipoteza expandabilității țesutului adipos (discutată mai sus), Arner și colab. Au observat relația valorilor morfologice cu generarea in vivo a adipocitelor [12]. Interesant este faptul că indivizii care prezintă o expansiune mai mare a grăsimii hipertrofice (indice de morfologie mai mare) au produs mai puține adipocite in vivo pe an decât indivizii care prezintă hiperplazie.
Spalding și colegii săi au aplicat, de asemenea, metoda de datare 14 C pentru a studia pe termen lung in vivo WAT lipid turnover. Vârsta medie a TG-urilor adipocitelor scABD, reflectată ca durata stocării TG în WAT până la îndepărtarea ireversibilă prin lipoliză (adică durata de viață a TG), a fost raportată a fi
1,6 ani [41]. Deoarece autorii au estimat vârsta adipocitelor ca fiind
9,5 ani, aceasta implică faptul că TG-urile au fost înlocuite de aproximativ șase ori în timpul duratei de viață a adipocitelor. Vârsta mai mică a TG a fost semnificativ asociată cu lipoliza adipocitelor in vitro mai mare (stimulată), implicând lipoliza ca un factor determinant important al îndepărtării TG. Interesant, nu a existat nicio diferență în vârsta TG între sexe sau între mărimile adipocitelor. Stocarea netă a TG a fost calculată pentru a reprezenta cantitatea de TG stocată în WAT în fiecare an. Indivizii obezi au depozitat TG mai mare și vârsta TG comparativ cu indivizii neobezi, ceea ce implică faptul că depozitarea ridicată și îndepărtarea redusă a TG adipoase pot fi factorii determinanți ai obezității [41]. Interesant, vârsta medie a TG, dar nu stocarea TG, a fost corelată cu rezistența la insulină, după cum a fost evaluată prin HOMA-IR. În ansamblu, Spalding și colegii săi propun că depozitarea și îndepărtarea lipidelor (TG), similar cu rotația adipocitelor, este constantă la vârsta adultă. Cu toate acestea, lipsa variației vârstei TG, astfel cum a fost evaluată pe termen lung, nu ignoră prezența modificărilor pe termen scurt în dinamica fluctuației lipidelor.
Perspective asupra abordărilor in vivo pentru măsurarea cifrei de afaceri adipoase
- Determinanți ai țesutului adipos uman Expresia genelor Impactul dietei, sexului, stării metabolice și Cis
- Țesutul adipos epicardic la baza complicațiilor obezității SpringerLink
- Modele dietetice și rezultate ale sănătății (cardiovasculare, metabolice, endocrine, neurologice, scheletice)
- Postul poate vindeca organismul uman de boli și poate inversa procesul de îmbătrânire
- Depozitarea grăsimilor ca țesut adipos din cartea Eating and Weight Management, de Stephen Gislason MD