Resurse pentru descoperirea drogurilor
- Acasă
- Despre CMC
- Știri
- ȘtiriCategorii
- Curs
- Publicații
- Resurse pentru descoperirea drogurilor
- Definiții de etapă
- Validarea țintei
- Identificarea loviturilor
- Identificarea plumbului
- Optimizarea plumbului
- Proprietăți ADME
- Absorbție și biodisponibilitate
- Distribuția și legarea proteinelor plasmatice
- Jumătate de viață
- Transportatori
- ABCB1
- Interacțiuni_transportoare
- Penetrarea creierului
- Metabolism
- CYP_interacțiuni
- Inhibarea CYP3A4
- Inhibarea CYP2D6
- CYP2C19 Inhibiție
- Inhibarea CYP2C9
- Aldehid oxidază
- Formulare
- Toxicitate preclinică
- Diverse
- Lista de verificare preclinică
- a lua legatura
- Feeduri jurnal
Distribuția unui medicament este adesea măsurată ca un volum de distribuție (Vdss) și este o măsură a volumului de lichid care ar trebui să conțină cantitatea de medicament prezentă în organism la aceeași concentrație ca cea măsurată în plasmă. Este important de reținut că volumele măsurate nu sunt volume fizice reale, ci volume aparente bazate pe diluarea medicamentului în plasmă. Cu toate acestea, volumele de lichid din diferite compartimente pot pune volumele de distribuție observate în context.
Volumul distribuției (L) = Cantitatea de medicament din organism (mg)/Concentrația plasmatică a medicamentului (mg/L)
Adesea acest lucru este normalizat la Kg greutate corporală, caz în care unitățile sunt L/Kg.
Volumele tipice de lichid pentru un om de 70 kg sunt (% și L)
| 60%, | 42 L |
| 40%, | 28L |
| 20%, | 14L |
| 4%, | 3L |
| 8%, | 5.5L |
Un medicament cu Vd ridicat are tendința de a părăsi plasma și de a intra în compartimentele extravasculare ale corpului, ceea ce înseamnă că este necesară o doză mai mare de medicament pentru a obține o concentrație plasmatică dată. (Vd ridicat duce la o distribuție a minereului către alte țesuturi). În schimb, un medicament cu Vd scăzut are tendința de a rămâne în plasmă, ceea ce înseamnă că este necesară o doză mai mică de medicament pentru a obține o concentrație plasmatică dată. (Vd scăzut înseamnă o distribuție mai mică către alte țesuturi).
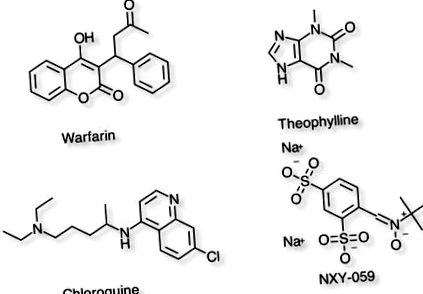
Exemple de compuși cu volum diferit de distribuție
| Warfarina | 8L | Reflectează un grad ridicat de legare a proteinelor plasmatice. | PPB = 99%, T1/2 = 37-89h |
| Teofilina | 30L | Reprezintă distribuția în apa totală a corpului. | PPB = 40%, T1/2 = 8h |
| Clorochina | 15000L | Molecule foarte lipofile care se împart în grăsime corporală | PPB = 55%, T1/2 = 1-2 luni |
| NXY-059 | 8L | Molecula hidrofilă foarte încărcată. | PPB = 30%, T1/2 = 2-4h |
Distribuția medicamentului de la plasmă la țesuturile țintă poate fi efectuată de o serie de factori, cum ar fi greutatea moleculară mare, dar poate cel mai important este legarea de proteinele plasmatice (PPB). Compușii care sunt legați pe scară largă de proteinele plasmatice vor avea un volum redus de distribuție (Vdss), pot avea timp de înjumătățire plasmatică lung (T1/2) și un clearance scăzut (Cl) atât de către ficat (hepatic), cât și de la rinichi (renal) rute. Legarea ridicată de proteinele plasmatice poate avea, de asemenea, un impact asupra eficacității, deoarece de obicei este fracția liberă de medicament care este responsabilă pentru acțiunea farmacologică.
Timpul de înjumătățire poate fi legat de volumul de distribuție utilizând următoarea ecuație
Timp de înjumătățire (ore) = 0,693 x (Volumul distribuției (L)/Clearance (L/oră)
Cea mai mare parte a eliminării medicamentului are loc prin ficat și rinichi, astfel încât medicamentele cu volum mare de distribuție vor avea majoritatea medicamentului în țesuturile din afara plasmei și, astfel, protejează împotriva clearance-ului.
Măsurarea legării proteinelor plasmatice
O modalitate rapidă de a vă face o idee dacă legarea proteinelor plasmatice poate fi o problemă este adăugarea de ser pe ecranul in vitro, dacă afinitatea aparentă scade este adesea dovada că liganzii se leagă de proteinele plasmatice, puteți adăuga și componentele purificate (de exemplu, albumina serică umană) pentru a vă face o idee despre proteinele care ar putea fi implicate.
Dializa de echilibru este cea mai larg acceptată metodă de evaluare a legării proteinelor plasmatice, deoarece efectele de legare nespecifice sunt minimizate în comparație cu alte metode, cum ar fi ultrafiltrarea, dar este un proces relativ lent, de la 4 la 24 de ore la 37 C. Pentru compuși foarte puternic legați, poate fi dificil de măsurat concentrația medicamentului nelegat, în aceste cazuri poate fi mai bine să folosiți 10% plasmă în tampon. Compușii foarte slab solubili pot da, de asemenea, rezultate anormale, la fel ca și compușii instabili în plasmă.
Ultrafiltrarea este potrivită pentru screeningul rapid și necesită foarte puțin compus. Compușii sunt incubați în plasmă timp de 1 oră, apoi centrifugați la 2700 rpm 10 minute. Supernatantul este apoi analizat pentru concentrarea medicamentului. Această metodă poate fi susceptibilă de legare nespecifică.
O publicație de la Universitatea din Washington DOI descrie un dispozitiv de microdializă ieftin pentru măsurarea legării de medicamente - proteine (DIYM).
Dispozitivul se bazează pe metoda standard de dializă de echilibru pentru a măsura fracția compusului cu greutate moleculară mică legat de proteine. Este construit dintr-o placă standard cu 96 de godeuri din polipropilenă, tuburi de dializă și rășină epoxidică cu vâscozitate redusă. Dispozitivul poate fi ușor pregătit pentru o mică parte din costul unui dispozitiv comercial, cu mai multe camere, cu micro-dializă.
Rezultatele obținute sunt de acord favorabil cu valorile literaturii.
| Dextrometorfan | 66,8 | 65 |
| Diclofenac | 98,0 | 99,5 |
| Mefloquine | 98,9 | > 98 |
| Metotrexat | 54.0 | 50.4 |
| Paclitaxel | 94.2 | 95 |
| Progesteron | 97,0 | 98 |
| Propranolol | 82,5 | 82 |
| Testosteronul | 93.3 | 98 |
Se utilizează standarde interne precum Warfarina, Propanalolul, Digoxina sau Diclofenacul. Poate fi utilizată și plasmă din diferite specii.
Rezultatele sunt de obicei exprimate ca fracțiune nelegată (fu), unde [D] este concentrația liberă a medicamentului și [DP] este concentrația complexului de proteine medicamentoase.
sau ca% Protein Binding
Până când medicamentul este mai mare de 90% legat, nu există de obicei probleme, odată ce ajungeți la> 99% legat, legarea proteinelor plasmatice este probabil să aibă un impact semnificativ.
Strategii de reducere a legării proteinelor plasmatice
Am compilat o bază de date cu date măsurate de legare a proteinelor plasmatice pentru molecule mici preluate din literatură, după cum arată graficul de mai jos, este clar că majoritatea moleculelor mici se leagă de proteinele plasmatice, multe dintre acestea fiind> 90% legat.
Diferitele clase de compuși sunt mai susceptibile de a avea probleme cu PPB, acizii tind să afișeze cea mai mare afinitate pentru proteinele plasmatice așa cum se arată în graficul de mai jos (preluat din discuția de Rupert Austin de la RSC MedChem School). Graficul prezintă un grafic de jurnal (% legat /% liber) versus LogD. În general, compușii mai lipofili prezintă o legare mai mare a proteinelor plasmatice, în cazul acizilor compuși cu LogD> 0 sunt legați aproape toți> 99%. Moleculele neutre și bazice necesită de obicei LogD mai mare de> 4 înainte ca legarea proteinelor plasmatice să devină o problemă. Au fost descrise mai multe modele in silico DOI în care lipofilicitatea și greutatea moleculară au efecte critice și independente asupra legării proteinelor plasmatice.
Principalele proteine plasmatice care pot interacționa cu medicamentele sunt:
- Albumină
- Glicoproteină alfa-1-acidă
- Lipoproteine
În general, medicamentele acide și neutre se leagă în principal de albumină, iar medicamentele bazice se leagă de glicoproteina acidă alfa-1 acidă sau de lipoproteine
Albumină
(MWt 66 KDa), (HSA) este cea mai abundentă proteină din plasma sanguină umană la 3,5 până la 5,0 g/dl. Este produs în ficat. Albumina cuprinde aproximativ jumătate din proteina serică din sânge (30 până la 50 g/L). Există aproape 100 de structuri cristaline de albumină, 58 cu liganzi legați, în baza de date cu proteine PDB. Un exemplu este 2vdb în care este legat S-Naproxen. S-a demonstrat că mutațiile din proteina albuminei au un efect asupra legării medicamentului DOI90466-V). Albumina serică umană are multiple situri de legare potențiale și acest lucru este ilustrat frumos în structura cu raze X a HSA complexată cu difunisal (verde) prezentată mai jos. DOI.
Glicoproteină alfa-1-acidă
(MWt 44 KDa), (AAG, AGP, Orosomucoid, ORM) are o concentrație plasmatică normală între 0,04-0,1 g/dl (1-3% proteină plasmatică). Este încărcat negativ la pH fiziologic și interacționează în principal cu medicamente de bază, inclusiv blocante ale receptorilor beta-adrenergici, antidepresive, neuroleptice și anestezice locale. Există o structură cristalină în PDB 3BX6, cavitatea ramificată, parțial hidrofobă și parțial acidă, împreună cu bucla probabil 1 flexibilă și cele două lanțuri laterale de zahăr la intrarea sa, explică spectrul divers de ligand al AGP, despre care se știe că variază cu modificări ale modelului de glicozilare. Structura cristalină a variantei A a glicoproteinei umane alfa1-acid și a complexului amitriptilin 3APV a fost recent depusă în PDB și subliniază că interacțiunile de stivuire pi sunt importante în legarea ligandului.
Tabelul principalelor proteine plasmatice
| 69 | 3.5-5.0 | Acid | menține presiunea osmotică coloidală și transportă molecule insolubile |
| 44 | 0,04-0,1 | De bază | proteină reactivă în fază acută |
| 200-3400 | Variază | De bază | Transportul acidului gras |
| 140 | 2.0-2.5 | Participă la sistemul imunitar | |
| 53 | 0,003-0,007 | Steroizi | |
| 400 | 0,2-0,4 | Coagularea sangelui |
Exemple de proteine specifice din sânge
Prealbumină, Alfa 1 antitripsină, Alfa 1 glicoproteină acidă, Alfa 1 fetoproteină, alfa2-macroglobulină, Gamma globuline, Beta 2 microglobulină, Haptoglobină, Ceruloplasmină, Complement component 3, Complement component 4, Lipoproteine, C-reactive protein (CRP), Lipoproteins chomomic, VLDL, LDL, HDL), Componenta serică amiloid P (SAP), Transferrin, Transistirină (TTR), Protrombină, MBL sau MBP,
Albumină
Ceftriaxonă (A), Clindamicină (A), Clofibrat (A), Dexametazonă (N), Diazepam (N), Diazoxid (A), Dicloxacilină (N), Digitoxină (N), Etopozidă (N), Ibuprofen (A)) Indometacină (A), Nafcilină (A), Naproxen (A), Oxacilină (A), Fenilbutazonă (A), Fenitoină (A), Probenecid (A), Adăugare salicilică (A), Sulfizoxaol (A), Tenipozid (N), Tiopental (A), Tolbutamidă (A), Acid valproic (A), Warfarină (A).
Albumină și AAG
Alprenolol (B), Carbamazepină (N), Disopiramidă (B), Eritromicină (B), Lidocaină (B), Meperidină (B), Metadonă (B), Verapamil (B).
Albumină și lipoproteine
Ciclosporină (N), Probucol (N).
Amitriptilină (B), Bupivacaină (B), Clorpromazină (B), Diltiazem (B), lmipramină (B), Nortriptilină (B), Perazină (B), Propanolol (B), Chinidină (B).
A = acid; B = Baza; N = Neutru.
Implicațiile legării de proteinele plasmatice
Eficacitatea medicamentelor poate fi compromisă prin legarea ridicată de proteinele plasmatice, deoarece doar fracția nelegată este disponibilă pentru legarea la ținta moleculară.
Eliminarea unui medicament poate fi afectată de legarea proteinelor plasmatice, în general, este doar medicamentul nelegat care este supus clearance-ului hepatic. În mod similar, clearance-ul renal este redus pentru compușii cu legare ridicată de proteinele plasmatice. Volumul de distribuție la starea de echilibru va fi, de asemenea, influențat de legarea de proteine și, prin urmare, timpul de înjumătățire plasmatică terminal.
Medicamentele pot concura pentru același loc de legare și, prin urmare, există potențialul interacțiunilor medicament-medicament, aceasta ar fi o preocupare specială pentru medicamentele puternic legate de proteine, care au un indice terapeutic scăzut, cum ar fi warfarina.
În timp ce proteinele plasmatice îndeplinesc funcții similare și sunt la concentrații similare între specii, diferențe mici în secvența proteinelor pot avea un impact asupra gradului de legare a proteinelor, astfel este recomandabilă evaluarea in vitro la mai multe specii.
Actualizat la 6 decembrie 2019
- Ghidul medicilor pentru dieta cu apă Scăderea în greutate Recenzii Proteine din zer Scăderea în greutate Femei Terapeutice
- Ai nevoie de proteine dacă tu; Re Încercarea de a tonifica alimentația sănătoasă SF Gate
- Izolat de proteine de vită alimentate cu iarbă 1 lb - Pulbere puternică din carne de vită
- Pierderea în greutate a medicilor - Shake sau budincă proteică a dietei cu banane tropicale (7Box) - NutriWise
- Proteina protejează împotriva creșterii în greutate