R.M. Banin
1 Departamentul de Științe Biologice, Universitatea Federală din São Paulo, Diadema, SP, Brazilia
B.K.S. Hirata
1 Departamentul de Științe Biologice, Universitatea Federală din São Paulo, Diadema, SP, Brazilia
ESTE. Andrade
2 Disciplina fiziologiei nutriționale, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
J.C.S. Zemdegs
2 Disciplina de fiziologie a nutriției, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
A.P.G. Clemente
4 Facultatea de nutriție, Universitatea Federală din Alagoas, Maceió, AL, Brazilia
A.P.S. Dornellas
2 Disciplina fiziologiei nutriționale, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
V.T. Boldarine
2 Disciplina fiziologiei nutriționale, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
D. Estadella
3 Departamentul de Biosciences, Universitatea Federală din São Paulo, Baixada Santista, SP, Brazilia
K.T. Albuquerque
5 Curs de nutriție, Universitatea Federală din Rio de Janeiro, Macaé, RJ, Brazilia
L.M. Oyama
2 Disciplina fiziologiei nutriționale, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
E.B. Ribeiro
2 Disciplina de fiziologie a nutriției, Departamentul de fiziologie, Universitatea Federală din São Paulo, São Paulo, SP, Brazilia
M.M. Telles
1 Departamentul de Științe Biologice, Universitatea Federală din São Paulo, Diadema, SP, Brazilia
Abstract
Introducere
Obezitatea a devenit o problemă majoră de sănătate publică la nivel mondial (1,2). S-a sugerat că nivelurile ridicate de adipozitate abdominală și aportul excesiv de grăsimi saturate promovează sindromul metabolic legat de obezitate (3-5) și că asocierea dintre obezitate, rezistența la insulină și dislipidemia potențează riscul bolilor cardiovasculare (6).
Extractul de Ginkgo biloba (GbE; un preparat standardizat numit EGb 761, care se obține din frunzele de G. biloba) este unul dintre extractele de plante cele mai utilizate în terapeutică (7). GbE (50: 1) conține aproximativ 24% glicozide flavonoide, 6% terpenoide (cum ar fi diterpenoidele A, B, C, M și J ginkgolide și sesquiterpene bilobalid), 7% proantocianidine și acizi organici cu greutate moleculară mică (8). S-au raportat proprietăți antioxidante, antiinflamatoare, vasodilatatoare și antiedematogene pentru această plantă (9,10).
Studiile au sugerat că aportul de GbE de către pacienții cu diabet zaharat de tip 2 (T2DM) reduce bolile circulatorii și îmbunătățește profilul glicemic (11,12). Glicemia redusă a fost raportată și la șobolanii diabetici induși de streptozotocină (13). S-a sugerat că aceste efecte benefice ar putea rezulta dintr-o stimulare semnificativă a funcției pancreatice a celulelor beta/producția de insulină (11) și dintr-o scădere semnificativă a nivelurilor de hemoglobină glicată la pacienții cu T2DM (14). În ciuda dovezilor pentru un efect pozitiv al GbE asupra homeostaziei glicemice, datele din literatură sunt rare despre acțiunea GbE asupra intoleranței la insulină legată de obezitate.
Astfel, este posibil să se speculeze că GbE ar putea îmbunătăți, de asemenea, insensibilitatea la insulină pe cascada de semnalizare a insulinei afectată de obezitate. În acest context, scopul prezentului studiu a fost de a evalua efectul GbE asupra ameliorării mai multor parametri legați de toleranța la insulină la șobolanii obezi induși în dietă.
Material si metode
Prezentul studiu a fost aprobat de Comitetul de etică pentru cercetarea animalelor de la Universitatea Federală din São Paulo (Procesul nr. 0321/11). S-au făcut toate eforturile pentru a minimiza suferința.
Animale
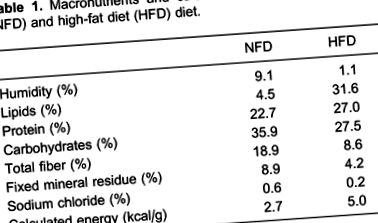
Șobolanii masculi Wistar (în vârstă de 2 luni) au fost repartizați aleatoriu într-un grup cu dietă normală cu grăsimi (NFD) sau cu un grup cu dietă bogată în grăsimi (HFD). Grupul NFD a fost hrănit cu chow de laborator cu pelete standard (Nuvilab ¯, Brazilia), care a furnizat 35,9% din energie sub formă de carbohidrați, 22,7% ca proteină și 4,5% ca grăsime, în timp ce grupul HFD a fost hrănit cu o dietă bogată în grăsimi, care a fost preparat prin adăugarea la chow-ul standard, 28% (greutate/greutate) grăsime, 10% (greutate/greutate) zaharoză, 20% (greutate) cazeină, pentru a obține conținutul de proteine din dieta de control și hidroxitoluen butilat în cantitatea de 0,4% (g/g) de ulei suplimentar. Aceasta a furnizat 19,5% din energie sub formă de carbohidrați, 23,2% ca proteină și 57,3% ca grăsime. Tabelul 1 prezintă compozițiile de macronutrienți și acizi grași din diete.
Animalele au fost găzduite patru într-o cușcă și întreținute în condiții controlate de iluminare (12: 12-h lumină-întuneric, luminile aprinse la 6:00 am) și temperatura (23 ± 1 ° C), cu acces gratuit la alimente și apă. Grupul NFD a rămas la dieta respectivă pentru întregul studiu, în timp ce, după 8 săptămâni, animalele HFD au fost împărțite în două subgrupuri, conform tratamentului de fitoterapie descris mai jos.
Tratamentul fitoterapiei
GbE a fost obținut din sudul Anhui Dapeng (China). GbE conținea glicozide flavonice (26,12%), terpenoide (6,86%), ginkgolidă A (2,20%), ginkgolidă B (1,11%), ginkgolidă C (1,05%) și bilobalidă (2,50%).
Tratamentul cu fitoterapie a fost efectuat timp de 14 zile. Grupul HFD a fost împărțit în două grupuri: HFD + Gb și HFD + V. Grupul HFD + Gb a fost gavat zilnic cu 500 mg/kg GbE diluat în 2 mL soluție salină 0,9% (ca vehicul), în timp ce grupurile HFD + V și NFD au fost gavate cu 2 mL numai din vehicul.
Măsurarea aportului alimentar și a greutății corporale
Atât greutatea corporală, cât și aportul alimentar de 24 de ore au fost măsurate săptămânal de la 2 la 4 luni. În timpul tratamentului de fitoterapie, animalele au fost adăpostite individual, iar aportul individual de hrană 24 de ore și greutatea corporală au fost măsurate săptămânal. Aportul zilnic de alimente a fost calculat ca diferență între cantitatea de mâncare oferită și mâncarea rămasă după 24 de ore.
Parametrii serici și greutatea tampoanelor de grăsime
Șobolanii au fost decapitați după o perioadă de post de 6 ore. Sângele a fost colectat, centrifugat la 1258 g timp de 15 minute la 4 ° C, iar serul a fost depozitat la -80 ° C până la analize. Concentrațiile de glucoză, triacilglicerol (TAG), colesterol total, LDL-colesterol și HDL-colesterol au fost determinate prin metode colorimetrice enzimatice folosind truse comerciale (Labtest Diagnóstica, Brazilia). Nivelurile de insulină au fost măsurate folosind un kit ELISA (Millipore®, SUA). Estimarea de evaluare a modelului de homeostazie a receptorului de insulină (HOMA-IR) a fost calculată din insulină de post (µU/mL) și glucoză de post (mmol/L), după cum urmează: HOMA-IR = (insulină × glucoză)/22,5.
Depozitele de țesut adipos retroperitoneal, mezenteric și epididimal au fost disecate și cântărite imediat.
Test de toleranță la insulină (ITT)
Probele de sânge din coadă au fost colectate înainte (0 min) și 5, 10, 15, 20, 25 și 30 min după o injecție intraperitoneală de insulină obișnuită (2 U/kg greutate corporală, Humulin ¯ Human Insulin, Eli Lilly do Brasil Ltda., Brazilia). O picătură de sânge a fost adăugată la benzile reactive, iar nivelurile de glucoză au fost măsurate cu ajutorul unui glucometru (One Touch Ultra, Johnson & Johnson, SUA).
Analize Western blot
Șobolanii au fost anesteziați cu tiopental sodic (80 mg/kg greutate corporală, intraperitoneal). Cavitatea abdominală a fost deschisă, vena portă a fost expusă și s-au injectat 6 µg de insulină. Mușchiul Gastrocnemius a fost îndepărtat înainte și la 90 de secunde după perfuzia de insulină și omogenizat în 1,0 mL tampon de solubilizare (100 mM Tris, pH 7,5, 0,1 mg/mL aprotinină, 2 mM fenilmetilsulfonil fluorură, 10 mM ortovanadat de sodiu, 100 mM fluorură de sodiu, 10 mM pirofosfat de sodiu și 10 mM EDTA). Triton X-100 a fost adăugat la o concentrație finală de 10%. Probele au fost centrifugate la 16.000 g timp de 40 min și cantități egale de proteine au fost separate folosind electroforeză pe gel de poliacrilamidă dodecil sulfat de sodiu 10%. Proteinele au fost apoi transferate în membranele de nitroceluloză printr-un aparat de transfer semi-uscat (p-Akt/Akt: protein kinază B, IR: receptor de insulină și PTP-1B: proteină tirozin fosfatază 1B) sau printr-un aparat de transfer umed (IRS-1) și IRS-2: substraturi ale receptorilor de insulină 1 și 2; Bio-Rad, SUA).
Legarea nespecifică a proteinelor la nitroceluloză a fost redusă prin preincubarea membranei peste noapte la 4 ° C în tampon de blocare (1% albumină serică bovină, 1 M Tris, pH 7,5, 5 M NaCl, 0,02% Tween-20). Membranele au fost apoi incubate peste noapte cu anticorpul primar împotriva fosfo-Akt (Ser-473 9271S, Cell Signaling, SUA), IR (sc-711), IRS-1 (sc-559), IRS-2 (sc-8299), și PTP-1B (sc-1718), obținut de la Santa Cruz Biotechnology (SUA). Toate membranele au fost apoi incubate cu anticorp secundar specific conjugat cu peroxidază de hrean (Cell Signaling 7074S pentru membranele incubate cu IR, IRS-1 și IRS2; Sigma-Aldrich, SUA, A-51420 pentru membranele incubate cu PTP-1B) urmată de chemiluminescență detectare (Amersham Biosciences, SUA). Aceleași membrane utilizate pentru fosfo-Akt au fost dezbrăcate și reprobate cu anticorpul împotriva Akt (Cell Signaling 9272S), urmat de incubare cu anticorp secundar specific conjugat cu peroxidază de hrean (Cell Signaling 7074S). Membranele utilizate pentru IR, IRS-1, IRS-2, Akt și PTP-1B au fost dezbrăcate și reprobate cu anticorpul împotriva β-tubulinei (Cell Signaling 2146S).
Analiza cantitativă a fost efectuată cu software-ul Scion Image (Scion Corp., SUA). În toate experimentele, cel puțin un eșantion din fiecare grup a fost analizat în paralel, iar rezultatele sunt raportate ca o schimbare procentuală în raport cu grupul NFD.
Analize statistice
- Efecte antidiabetice și antihiperlipidemice ale extractului etanolic Ferula assa-foetida oleo-gumă-rășină
- Extract de alge brune pe control glicemic și greutate corporală - Vizualizare text complet
- Efectele acute ale vibrațiilor întregului corp asupra inhibării la copii sănătoși
- Extract de portocale amare Culturism și creșteți energia și vă simțiți grozav, cu efecte secundare neplăcute
- Dureri ale corpului după intervenții chirurgicale bariatrice Efecte secundare și remedii