Subiecte
Abstract
Obiectiv
Boala Alzheimer (AD) este o problemă de sănătate globală, fără metode eficiente de ameliorare a progresului bolii. Proteina β amiloidă (Aβ) este larg acceptată ca biomarker cheie pentru AD. Sindroamele metabolice, inclusiv obezitatea și rezistența la insulină, sunt factori cheie de risc ridicat pentru AD. Akkermansia muciniphila (Akk), singurul microb reprezentativ al intestinului uman din gen Verrucomicrobia, poate preveni creșterea în greutate cauzată de o dietă bogată în grăsimi, poate repara integritatea deteriorată a barierei epiteliale intestinale, reduce nivelurile de endotoxine din sânge și îmbunătățește rezistența la insulină. Scopul acestui studiu este de a explora impactul administrării Akk la șoareci model AD în diferite diete.
Metode
Șoarecii APP/PS1 au fost hrăniți fie cu o dietă chow normală, fie cu o dietă bogată în grăsimi și au fost tratați cu Akk prin gavaj în fiecare zi timp de 6 luni. Au fost determinate efectele Akk asupra metabolismului glucozei, barierei intestinale și metabolismului lipidic la modelul de șoarece al AD. De asemenea, au fost analizate modificările patologiei creierului și neuroetologiei.
Rezultate
Akk a redus în mod efectiv nivelul glicemiei în post și diamin oxidazei serice și a atenuat reducerea celulelor mucusului colonic la șoarecii APP/PS1. După tratamentul cu Akk, șoarecii APP/PS1 au prezentat, evident, niveluri reduse de lipide din sânge, steatoză hepatică îmbunătățită și albire scapulară a grăsimilor brune. Mai mult, Akk a promovat reducerea nivelurilor de Aβ 40-42 în cortexul cerebral al șoarecilor APP/PS1, a scurtat timpul de studiu și a îmbunătățit rata de finalizare în testele cu labirint Y.
Concluzie
Akk a îmbunătățit în mod eficient toleranța la glucoză, disfuncția barierei intestinale și dislipidemia la șoarecii model AD. Rezultatele studiului nostru au sugerat că Akk ar putea întârzia modificările patologice din creier și ameliorarea afectării învățării spațiale și a memoriei la șoarecii model AD, care oferă o nouă strategie pentru prevenirea și tratamentul AD.
Introducere
Boala Alzheimer (AD) este o boală cu demență generalizată, cum ar fi afectarea memoriei, pierderea abilităților vizuale, afectarea performanței și modificări comportamentale. AD se caracterizează prin tulburări cognitive grave și modificări patologice semnificative la nivelul creierului. Β-proteina amiloidă (Aβ) este o peptidă produsă de proteina precursor Aβ (APP) prin proteoliza β- și γ-secretazei. Aβ40 și Aβ42 au o toxicitate puternică și sunt mai ușor de agregat și provoacă efecte de neurotoxicitate 1, care este larg acceptat ca un biomarker cheie pentru AD. Tratamentele actuale pentru AD ameliorează doar simptomele, dar nu pot atenua progresia bolii 2. Ca atare, diagnosticul precoce este cea mai eficientă metodă de tratament 3. În 2010, Alzheimer’s Disease International (ADI) a raportat că costul tratamentului și îngrijirii demenței la nivel mondial a ajuns la peste 818 miliarde de dolari. Experții speculează că populația pacienților cu AD ar putea ajunge la 30 de milioane până în 2050 4, din care 71% ar fi concentrate în țările în curs de dezvoltare, inclusiv China, India, Asia de Sud și regiunile Pacificului de Vest.
Recent, un număr mare de rapoarte au indicat că sindroamele metabolice, inclusiv obezitatea și rezistența la insulină, sunt factori cheie de risc ridicat pentru afectarea cognitivă și demența 5. Datele au sugerat că tinerii care sufereau de obezitate sau diabet aveau un risc mai mare de demență 6,7,8,9. Diabetul de tip 2 a crescut foarte mult riscul de AD, iar depunerea de proteine Aβ concurează cu insulina pentru receptorii de insulină, provocând rezistență la insulină 10,11,12,13. În plus, experimentele pe animale au arătat că sindromul metabolic, în special inflamația cronică de grad scăzut, ar putea crește modificările patologice specifice în AD 13,14,15, iar experții consideră că AD este o boală metabolică 16,17,18. Patogeneza AD nu a fost încă definită în mod clar. Multe studii au arătat că dezvoltarea rezistenței la insulină în creier apare la pacienții cu AD, care poate fi cauzată de depunerea de proteine Aβ, deoarece este asociată cu multiple caracteristici patologice 19,20. Prin urmare, mulți cercetători au crezut că o cale de insulină cerebrală disfuncțională ar putea fi o cauză parțială a AD 21 .
Akkermansia muciniphila (Akk) este singurul reprezentant Verrucomicrobia a microbilor intestinului uman care pot fi cultivați și poate fi detectat cu ușurință prin analiza metagenomică a intestinului uman. Având în vedere că abundența sa este strâns legată de sănătatea umană, A. muciniphila a primit o atenție tot mai mare 22. Există dovezi că abundența de A. muciniphila a fost semnificativ scăzută la nivelul intestinelor pacienților cu diabet de tip 2 23 și șoareci model AD 24. De asemenea, s-a arătat că A. muciniphila nu poate preveni doar creșterea în greutate la șoarecii cu dietă bogată în grăsimi, dar poate repara și integritatea barierei epiteliale deteriorate și poate îmbunătăți endotoxemia 25,26. Prin urmare, scopul specific al acestui studiu a fost de a evalua dacă tratamentul cu Akk ar putea îmbunătăți sănătatea modelelor animale cu AD, pentru a oferi o nouă strategie de prevenire și tratament a AD.
Metode
Model animal
Cultura și administrarea A. muciniphila
Tulpina chinezească A. muciniphila GP01 a fost izolat din scaun uman, așa cum a fost descris anterior 28, și a fost cultivat anaerob într-un mediu bazat pe mucină bazală. Concentrația bacteriană a fost calculată prin măsurarea valorilor OD la 600 nm. Șoarecii experimentali APP/PS1 au fost gavajați zilnic timp de 6 luni, fie cu 5 × 10 9 cfu de A. muciniphila în 200 uL PBS steril sau 200 uL PBS steril.
Șoarecii au fost anesteziați cu 1-3% izofluran în 100% O2. Șoarecii anesteziați au fost scanați într-un RMN de 7T pentru animale mici (PharmaScan70/16 SUA; BRUKER Biospin MRI GmbH) echipat cu bobine de suprafață sensibile și amplificator. Bunăstarea animalelor a fost asigurată prin utilizarea unui sistem de circulație a apei calde și a monitorizării fiziologice. Protocolul de imagine a inclus o secvență T2 cu următorii parametri: TR/TE: 2500/35 ms; FoV: 15 × 30 mm; dimensiunea imaginii: 256 × 256 mm; Grosimea feliei: 0,7 × 3,4 mm; timp de scanare: 2 min 4 s. Dimensiunea emisferelor cerebrale și a ventriculilor laterali de pe ambele părți ale șoarecelui poate fi evaluată prin RMN.
Imunohistochimie și histologie
Analize biochimice și ELISA
Nivelurile serice ale colesterolului total (Chol), trigliceridelor (TG), alaninei aminotransferazei (ALT) și aspartatului transaminazei (AST) au fost determinate folosind un analizor Roche Modular P 800. Nivelurile serice de diamin oxidază (DAO) (CUSABIO) și nivelurile de Aβ40 și Aβ42 (Invitrogen) în cortexul cerebral au fost măsurate cu kituri ELISA.
Test de toleranță la glucoză
Șoarecii APP/PS1 au fost la jeun timp de 12 ore și a fost măsurată glicemia în jeun. Glucoza (2 g/kg) a fost apoi administrată oral și nivelurile de glucoză din sânge au fost determinate cu un glucometru (Abbott Laboratories, Abbott Park, IL, SUA) la 15, 30, 60, 90 și 120 de minute.
Testele în câmp deschis și labirintul Y.
Analize Western blot
Hipocampii șoareci au fost omogenizați în TBS răcit suplimentat cu un cocktail inhibitor de protează și fosfatază (Thermo Fisher Scientific, Waltham, MA, SUA). Concentrațiile de proteine ale omogenizaților au fost determinate prin testul BCA (CWBIO). Probele au fost separate electroforetic pe geluri SDS - PAGE de 10 sau 12% și transferate în membranele PVDF (Millipore, Bedford, MA, SUA). Membranele au fost blocate cu lapte degresat 5% în TBS conținând 0,1% Tween-20 (TBS-T) timp de 1 oră și testate cu anticorpi primari (anticorp anti-UCP-1 ab10983) la 4 ° C peste noapte. Membranele au fost ulterior dezvoltate cu anticorpul secundar conjugat cu peroxidază de hrean și trusa ECL (Thermo Fisher Scientific). Cuantificarea densitometriei benzilor de proteine a fost analizată utilizând software-ul de imagistică IMAGE-PRO PLUS 6.0.
Amestecul de proteine a fost extras din țesuturile adipose maro scapulare în tampon RIPA (0,5% NP40, 0,1% doxiciclină de sodiu, 150 mM NaCl, 50 mM Tris.HCl [pH 7,4]) conținând un cocktail complet inhibitor de protează (Abcam). Membranele PVDF au fost sondate simultan cu anticorpii primari de UCP1 (Abcam) și β-tubulină (Abcam). Benzile de proteine au fost vizualizate cu reactivi de chimiluminiscență ECL (Thermo Fisher Scientific) și cuantificate folosind software-ul de imagistică IMAGE-PRO PLUS 6.0.
PCR în timp real
Pentru analiza abundenței Akk în fecale, ADN-ul bacterian fecal a fost extras prin trusa ADN Magen Hipure Stool. După ajustarea concentrației ADN-ului, PCR în timp real a fost efectuată folosind kitul de reactivi PrimeScript ™ RT (nr. Cat. RR820A, Takara, Dalian) urmând protocolul producătorului într-un sistem de PCR în timp real LightCycle480 (Roche, Germania). Procedura a inclus pre-denaturarea probelor de ADN la 95 ° C timp de 30 s, apoi 40 de cicluri de denaturare la 95 ° C timp de 5 s și recocire la 60 ° C timp de 30 s, topită la 95 ° C timp de 5 s și 60 ° C timp de 1 min, răcit în cele din urmă la 50 ° C timp de 30 s. Produsul fluorescent a fost detectat în ultima etapă a fiecărui ciclu. Cuantificarea relativă a fost calculată cu 2 −ΔΔCt, rezultatele au fost normalizate la gena 16 S rRNA.
Grundele au fost: Akkermansia muciniphila genă,
analize statistice
Toate probele au fost implicate în analiza statistică. Toate analizele au fost efectuate cu pachetul statistic pentru științele sociale versiunea 19.0 (SPSS) (IBM Corp, Armonk, NY, SUA). Datele au fost exprimate ca medie ± SEM. Semnificația statistică a fost determinată de cea a lui Student t-test (pentru compararea a două grupuri experimentale) sau ANOVA unidirecțional (pentru compararea a trei sau mai multe grupuri experimentale). Comparații cu p
Rezultate
Akk a reglat în mod eficient homeostazia glucozei și afectarea barierei intestinale la șoarecii APP/PS1
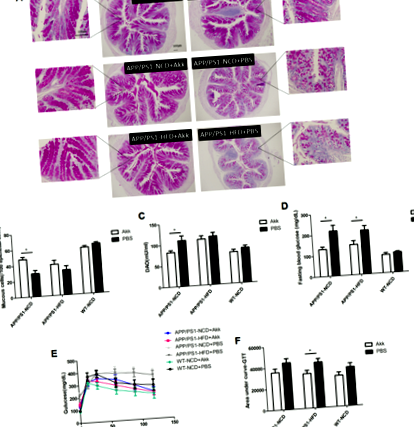
Pentru a evalua efectele Akk asupra barierei intestinale și a homeostaziei glucozei la un șoarece model AD, am comparat la șoarecii APP/PS1 tratați cu Akk și tratați cu PBS, hrăniți fie cu o dietă normală chow (NCD), fie cu o dietă bogată în grăsimi ( HFD). La șoarecii APP/PS1 tratați cu PBS, am constatat că nivelul glicemiei la jeun a fost mai mare și rezultatele OGTT au arătat, de asemenea, o creștere a zonei ASC (Fig. 1d - f, p FIG. 1: Akkermansia muciniphila homeostazie ameliorată a glucozei și restabilirea funcției de barieră intestinală.
Apoi, am explorat rolul posibil al Akk în funcția de barieră intestinală la șoarecii APP/PS1. Diamin oxidaza (DAO) este o enzimă intracelulară foarte activă în vilozitatea superioară intestinală la om și mamifere, are un rol în metabolismul histaminei și al diferitelor poliamine și este strâns legată de sinteza acidului nucleic și a proteinelor din celulele mucoasei (Fig. 1a, b, p FIG. 2: Akkermansia muciniphila tulburări ameliorate ale metabolismului lipidic.
Akk a redus depozitele de placă Aβ și nivelurile de Aβ în creierul șoarecilor APP/PS1
Analiza depunerii de proteine Aβ prin imunohistochimie a arătat că șoarecii APP/PS1 aveau mai multe plăci Aβ în hipocampus (Fig. 3a). Aria depunerii de proteine Aβ a crescut la șoarecii APP/PS1-HFD-PBS, dar a fost redusă la tratament cu Akk, deși nu a existat nicio diferență semnificativă statistic (Fig. 3b). În plus, am analizat și proteinele solubile Aβ 40 și Aβ 42 prin ELISA. La șoarecii APP/PS1-Akk, am detectat o reducere semnificativă a nivelurilor solubile Aβ 40 și Aβ 42 comparativ cu șoarecii APP/PS1-PBS (Fig. 3c, d, p FIG. 3: Akkermansia muciniphila depozite Aβ reduse și niveluri de Aβ în creierul șoarecilor APP/PS1.
Akk a îmbunătățit comportamentele afectate de cogniție și anxietate la șoarecii APP/PS1
Pentru a investiga capacitățile de învățare și memorie ale șoarecilor APP/PS1, a fost efectuat testul Y-labirint. Înainte de intervenție, toți șoarecii au primit testul Y-labirint timp de maximum 3 zile. Cu toate acestea, șoarecii APP/PS1-PBS au petrecut mai mult timp decât șoarecii WT-PBS la antrenament. După 6 luni de tratament cu Akk, șoarecii APP/PS1 au necesitat un timp de învățare semnificativ mai scurt decât grupul tratat cu PBS (Fig. 4a, p FIG. 4: Akkermansia muciniphila tulburări cognitive ameliorate și comportamente legate de anxietate la șoarecii model APP/PS1.
În testul în câmp deschis, nu au existat diferențe semnificative la compararea proporției de timp petrecut în districtul central între toate grupurile (Fig. 4c). Timpii de curățare a șoarecilor APP/PS1-PBS au fost mai mici decât cei ai șoarecilor WT-PBS (Fig. 4d, p
Discuţie
Principalele caracteristici patologice ale AD sunt formarea plăcilor senile (SP) și a încurcăturilor neurofibrile (NTF) în creier 42. Mai mult, componenta principală a SP este β-amiloidul (Aβ), care are un rol crucial în apariția și dezvoltarea AD și este o cale comună pentru diferiți factori de a induce AD 43. Proteina Aβ are un rol important în patogeneza AD. Barierele de auto-curățare și degradare ale proteinei Aβ conduc la plăci proteice. Proteina Aβ poate reduce clearance-ul proteinei Aβ de către macrofage, producând astfel un răspuns imun 44. Proteina Aβ poate promova, de asemenea, apoptoza neuronală. A existat o diferență majoră în compoziția microflorei intestinale între pacienții cu AD și subiecții normali, sugerând că compoziția microbiană poate avea un rol în dezvoltarea amiloidozei Aβ cerebrale 24. Merită menționat faptul că, în studiul nostru, depunerea de proteine Aβ a fost redusă în hipocampus și în cortexul cerebral al șoarecilor APP/PS1 tratați cu Akk.
Șoarecii APP/PS1 au arătat, de asemenea, o atenție redusă asupra lor și a mediului după evaluare prin testul în câmp deschis în studiul nostru, în acord cu studiile anterioare 27, iar aceste fenomene au fost atenuate prin tratamentul cu Akk. Rezultatele testului Y-labirint au arătat că o dietă bogată în grăsimi a agravat și mai mult afectarea învățării și capacitatea de memorie spațială la șoarecii APP/PS1. Cu toate acestea, aceste simptome au fost îmbunătățite semnificativ cu tratamentul cu Akk. Aceste rezultate sugerează că Akk poate crește celulele mucoasei și poate promova secreția de mucus pentru a repara bariera intestinală afectată, reducând astfel nivelurile de LPS și alte substanțe pro-inflamatorii, îmbunătățind nivelurile metabolice, ameliorând rezistența la insulină în creier, reducând depunerea de Aβ proteine și protejarea nervilor împotriva deteriorării.
În general, tratamentul cu Akk a îmbunătățit în mod eficient disfuncția barierei intestinale, tulburările metabolice ale glucozei și lipidelor și a ameliorat afectarea cognitivă prin reducerea nivelului de depunere a plăcii Aβ în creier. Aceste descoperiri sugerează că efectul ameliorator al tratamentului cu Akk asupra funcției cognitive poate fi atribuit reparării tulburărilor metabolice și, concomitent, incidenței reduse a patologiei Aβ. Descoperirile noastre vor oferi o nouă înțelegere a faptului că se așteaptă ca suplimentarea cu Akk să fie o nouă strategie pentru prevenirea și tratamentul AD.
Referințe
Kuhlmann, J., Andreasson, U. & Pannee, J. CSF Aá1-42: un biomarker Alzheimer excelent, dar complicat - o cale către standardizare. Clin. Chim. Acta 467, 27–33 (2016).
Stone, J. G. și colab. Frontiere în terapeutica bolii Alzheimer. Ther. Adv. Dis cronice. 2, 9–23 (2011).
- Efectele protectoare ale estrogenului asupra dezvoltării specifice genului a hipertensiunii induse de dietă Journal
- Efecte de protecție asupra modelelor experimentale de inflamație ale măslinului virgin suplimentat cu polifenol
- Prevalența obezității și fibrilației atriale, patogenia și efectele de prognoză ale pierderii în greutate și
- Utilizări, efecte secundare, interacțiuni, dozare și atenționare ale varzei moscii
- Dieta pentru frumusețea adormită Femeile iau sedative pentru a obține subțiri, riscând efecte secundare periculoase