Abstract
fundal
L-carnitina este un compus esențial care facilitează transportul acidului gras cu lanț lung prin membrana mitocondrială internă pentru β-oxidare. Cu toate acestea, efectul suplimentării cu L-carnitină rămâne să fie explorat pe deplin la pacienții cu boli renale cronice. Am urmărit în acest studiu să determinăm mai detaliat efectele multidirecționale ale suplimentării cu L-carnitină asupra parametrilor clinici.
Metode
Am administrat oral L-carnitină pentru a menține nivelurile de carnitină fără ser în intervalul normal (30 până la 70 μmol/L) timp de 6 luni la 21 pacienți cu hemodializă (HD) (vârstă, 74 ± 11 ani; timp la HD, 60 ± 84 luni).
Rezultate
Suplimentarea cu L-carnitină a crescut semnificativ transferina serică de la 155 ± 41 la 175 ± 48 mg/dL (p
fundal
Pierderea de energie proteică (PEW) cuprinde pierderi excesive de masă de proteine corporale și rezerve de energie și este asociată cu morbiditate și mortalitate ridicate la pacienții cu boli renale cronice (CKD) [1]. Există multe cauze ale PEW, cum ar fi aportul inadecvat de nutrienți, pierderi crescute de nutrienți din dializat, inflamație, stres oxidant, stres carbonilic, tulburări hormonale anabolice sau catabolice și acidemie [1].
L-carnitina este un compus natural care este sintetizat din lizină și metionină. L-carnitina este esențială în transferul acizilor grași cu lanț lung în mitocondrii pentru β-oxidare. Când se dezvoltă deficitul de carnitină, acizii grași cu lanț lung nu sunt disponibili pentru β-oxidare sau producerea de energie, ceea ce determină acumularea excesivă de lipide în organe precum mușchiul. Carnitina este, de asemenea, necesară pentru a menține funcția și morfologia țesutului adipos brun [2]. Aproximativ 95% din cantitatea de carnitină este prezentă în mușchiul scheletic și cardiac, 2-3% în ficat și rinichi și doar 0,5-1% în lichidul extracelular [3].
Pacienții dializați prezintă un risc deosebit de mare pentru deficitul de carnitină din cauza consumului redus de surse de carnitină dietetică, cum ar fi carnea roșie, reducerea biosintezei la rinichi și pierderea difuză din dializat. La pacienții cu hemodializă incidentă (HD), nivelul carnitinei plasmatice scade în prima săptămână de tratament, cu o scădere continuă în primele 12 luni de tratament [4]. Conținutul de carnitină al mușchiului scheletic scade, de asemenea, la pacienții cu hemodializă și este invers corelat cu timpul pe HD [4, 5].
Metabolismul mușchilor scheletici este dependent de carnitină, deoarece oxidarea acizilor grași este principala sursă de energie în celulele musculare. Cu toate acestea, rămâne să fie pe deplin determinat dacă suplimentarea cu L-carnitină îmbunătățește sau nu puterea musculară, capacitatea fizică și simptomele musculare.
Scopul prezentului studiu este de a clarifica în continuare efectul suplimentării cu L-carnitină asupra parametrilor clinici la pacienții cu HD. Am administrat prospectiv L-carnitină pe cale orală pentru a menține nivelurile de carnitină liberă în intervalul normal timp de 6 luni și am examinat mai detaliat impactul suplimentării cu L-carnitină asupra markerilor nutriționali, imunologici, inflamatori și cardiaci.
Metode
Pacienți
Acest studiu a fost realizat într-un singur centru de dializă (Organizația Spitalului Național Centrul Medical Yanai, Yamaguchi, Japonia). La început, 26 de pacienți cu HD, care și-au dat consimțământul, au fost înrolați în acest studiu. Nu a existat niciun pacient care să fi primit suplimente de L-carnitină înainte de intrare. Proiectul studiului a fost aprobat de către comitetele de revizuire a eticii corespunzătoare ale instituției în cadrul cărora a fost realizat studiul și a fost în conformitate cu prevederile Declarației de la Helsinki.
Toți pacienții au fost supuși la HD regulat folosind membrane dializere polisulfonice cu tampoane de bicarbonat timp de 3 până la 4 ore de trei ori pe săptămână.
Suplimentarea cu L-carnitină
Am modificat inițial doza inițială de L-carnitină orală în funcție de greutatea uscată (DW) pentru a menține nivelul seric în intervalul normal, fără risc, deoarece excesul de L-carnitină poate fi transformat de microbiota intestinală în trimetilamină-N-oxid (TMAO), un potențial promotor al arteriosclerozei coronare [6]. Când DW a fost mai mare de 50 kg, am administrat inițial 400 mg/zi o dată pe zi, în timp ce când DW a variat între 30 și 50 kg, am administrat 300 mg/zi. De asemenea, dacă DW a fost mai mică de 30 kg, am început cu doza de 200 mg/zi.
Am măsurat apoi nivelurile serice de carnitină prediaalizate în fiecare lună pentru primele 3 luni. Când concentrația totală de carnitină a depășit limita superioară normală (≥70 μmol/L), am scăzut doza cu 100 mg pe zi până la următoarea măsurare. În schimb, atunci când nivelul seric al carnitinei totale a fost mai mic decât limita inferioară (test de eliberare de 51 Cr împotriva K562 (o linie celulară de leucemie mielogenă extrem de nediferențiată și granulocitară din criza exploziei) ca celule țintă de referință cu incubare de 6 ore. exprimat ca raportul E (celula efectoare)/T (celula țintă) (intervale de referință; raportul E: T = 20: 1: 17,1-48,7% și raportul E: T = 10: 1: 8,9-29,5%). diferențierea (CD) 4/CD8 a fost implementată prin citometrie în flux cu utilizarea FACSCalibur) (BD Biosciences, San Jose, CA, SUA) și KX-21 (Sysmex, Kobe, Japonia). Receptor interleukin-2 solubil în ser (IL- 2R) a fost, de asemenea, măsurată folosind kituri de imunoanaliză legate de enzime (referință, 122-496 U/mL).
Nivelurile serice de seleniu, zinc și cupru au fost măsurate prin spectrofotometrie de absorbție atomică (domenii de referință; seleniu, 107-171 μg/dL; zinc, 59-135 μg/dL; și cupru, 66-130 μg/dL).
Evaluarea nutrițională
Greutatea corporală ideală (BW) a fost definită ca cea calculată de la înălțimea pacienților utilizând un indice de masă corporală (IMC) de 22,0 kg/m 2. IMC a fost calculat ca greutate uscată în kilograme împărțit la pătratul înălțimii în metri. Am calculat indicele de nutriție prognostic (PNI) al lui Onodera utilizând albumina serică, limfocitele totale (TLC) și BW uscat după cum urmează: PNI = [10 × albumine (g/dL)] + [0,005 × TLC] [8]. De asemenea, am determinat indicele de risc nutrițional geriatric (GNRI) după cum urmează: GNRI = [14,89 × albumina (g/dL)] + [41,7 × uscat/ideal BW]. Când DW a fost mai mare decât greutatea ideală, GNRI a fost calculat ca un raport DW/ideal BW identic cu 1,0 [9].
Am determinat rata catabolică normală a proteinelor (nPCR) și rata de generare a creatininei percentile (% CGR), care poate estima aportul de proteine din dietă și masa musculară scheletică, respectiv [7, 10].
Parametri antropometrici
La începutul și la sfârșitul studiului, am măsurat circumferința mijlocului (MAC) și grosimea tricepsului pliului cutanat (TSF) folosind etriere de pliere a pielii pe membrul neutilizate pentru accesul vascular după o sesiune HD. Am calculat circumferința musculară a brațului mediu (MAMC) folosind MAC și TSF după cum urmează: MAMC = MAC - (TSF × 3.14). Toate măsurătorile au fost efectuate de același cercetător instruit.
De asemenea, am determinat zona mușchilor coapsei prin tomografie computerizată (CT; Aquilion ONE TSX-301A, Toshiba, Tokyo, Japonia). Fiecare pacient a fost examinat în decubit dorsal, cu mușchiul coapsei relaxat. O imagine CT axială a fost obținută în punctul de mijloc al unei linii care se extinde de la marginea superioară a rotulei până la trohanterul mai mare al femurelor. Grosimea feliei a fost de 10 mm. Zona musculară a coapsei și zona osoasă a coapsei au fost determinate utilizând software-ul SCFM-001A (Toshiba, Tokyo, Japonia). Am folosit zona standardizată a mușchilor coapsei (TMA) împărțită la zona osului coapsei (TBA) pentru a evita influența dimensiunii corpului, un marker surogat al sarcopeniei coapsei [11].
Rezistența mânerului
Am măsurat rezistența mânerului pe partea superioară a brațului care nu a fost utilizată pentru accesul vascular chiar înainte de o sesiune HD folosind un dinamometru Smedley. Fiecare pacient a făcut două încercări de forță maximă, cu un interval de cel puțin 1 min între încercări. Cea mai mare înregistrare a fost luată ca citire a rezistenței mânerului.
Ecocardiografie în modul M
Ecocardiografia în modul M a fost efectuată într-o zi nedializată la intrarea în studiu și la 6 luni. Toate măsurătorile au fost efectuate de același medic instruit.
Funcția sistolică a ventriculului stâng a fost evaluată ca fracție de ejecție (EF) și scurtare fracționată (FS). EF și FS au fost calculate după cum urmează: EF (%) = (volumul diastolic ventricular stâng (LVEDV) - volumul sistolic final ventricular stâng (LVESV))/LVEDV × 100 și FS (%) = (ventricular stâng end-diastolic ) dimensiune (LVDd) - dimensiunea sistolică finală a ventriculului stâng (LVD))/LVDd × 100.
Masa ventriculară stângă (LVM) a fost calculată după cum urmează: LVM (g) = 1,04 × [(LVDd + sept interventricular (IVS) + grosimea diastolică a peretelui posterior ventricular stâng (LVPW)) 3 - LVDd 3] - 14. LVM a fost ajustat în funcție de suprafața corpului în metri pătrați și exprimat ca indicele de masă ventriculară stângă (LVMI).
Raze x la piept
Raportul cardiotoracic (CTR) a fost măsurat pe o radiografie toracică chiar înainte de terapia HD de către un cercetător instruit.
analize statistice
Pentru analiza statistică, a fost utilizat JMP (Versiunea 11.1.1, SAS Institute, Cary, NC, SUA). Rezultatele descriptive au fost exprimate ca media ± deviație standard (SD). Analizele parametrice au fost efectuate folosind Student’s t-test și Wilcoxon t testul a fost utilizat pentru analize non-parametrice. O valoare de p
Rezultate
Caracteristici bazale
În timpul urmăririi, deoarece am pierdut cinci pacienți din cauza decesului (n = 4) și infecție acutăn = 1), am analizat în cele din urmă un total de 21 de pacienți.
Tabelul 1 prezintă caracteristicile bazale. Vârsta medie a fost de 73,5 ± 11,6 ani, cu un timp mediu la HD de 60 ± 84 luni. Cauzele bolii renale în stadiul final au fost următoarele: nefropatie diabetică în nouă, nefroscleroză hipertensivă în patru, glomerulonefrită cronică în două, altele în trei și necunoscute în trei.
Nivelurile de carnitină
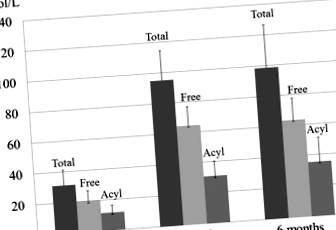
Suplimentarea cu L-carnitină a normalizat nivelul seric total, liber și acilcarnitină la 3 luni. Nivelurile totale de carnitină au crescut de la 31,1 ± 10,0 la 98,6 ± 27,9 (normal, 45,0-91,0) (p FIG. 1
Modificări ale nivelului seric total, liber și acilcarnitină după suplimentarea cu 6 luni de L-carnitină. Suplimentarea cu L-carnitină timp de 6 luni a normalizat nivelurile totale de carnitină de la 31,1 ± 10,0 la 98,6 ± 27,9 (normal, 45,0–91,0), nivelurile de carnitină liberă de la 19,8 ± 6,6 la 63,3 ± 14,3 (normal 36,0–76,0) și acilcarnitina niveluri de la 11,4 ± 4,9 la 35,3 ± 15,9 (normal, 6,0-23,0) μmol/L
Doza finală de L-carnitină a fost de 191 ± 114 mg/zi (4,0 ± 2,1 mg/kg DW/zi). Nu s-a găsit nicio diferență în doza de L-carnitină între pacienții cu HD cu funcție renală reziduală conservată (3,8 mg/kg DW/zi, n = 7) și cei fără (4,5 mg/kg DW/zi, n = 14).
Parametri nutriționali
În ciuda DW identic, s-au găsit creșteri semnificative în transferina serică (p Tabelul 2 Efectele suplimentării cu L-carnitină asupra parametrilor nutriționali
Parametri antropometrici
TSF a crescut semnificativ de la 0,4 ± 0,3 la 0,6 ± 0,3 cm (p Tabelul 3 Efectele suplimentării cu L-carnitină asupra parametrilor imunologici, inflamatori și oligoelemente
Oligoelemente
Seleniul seric a scăzut semnificativ de la 60,4 ± 13,9 la 52,4 ± 12,2 μg/L în timpul urmăririi (p = 0,01). Nivelurile serice de zinc și cupru nu s-au modificat (Tabelul 3).
Parametrii cardiaci
L-carnitina a crescut la FS de la 42,2 ± 11,4 la 46,1 ± 9,8% (p Tabelul 4 Efectele suplimentării cu L-carnitină asupra parametrilor cardiaci
Discuţie
În acest studiu, am administrat oral L-carnitină pentru a menține nivelurile serice de carnitină liberă în intervalul normal timp de 6 luni, monitorizând cu atenție și modificând doza în primele 3 luni. Ca rezultat, am menținut nivelurile de carnitină liberă în intervalul normal, în ciuda unei doze relativ mai mici (3,8 până la 4,5 mg/kg BW/zi) comparativ cu doza recomandată (5 până la 10 mg/kg BW/zi).
De asemenea, am arătat că regimul suplimentării cu L-carnitină a avut mai multe efecte benefice asupra parametrilor nutriționali, imunologici și cardiaci, după cum urmează.
Efecte asupra nutriției
S-a raportat că suplimentarea cu L-carnitină îmbunătățește starea nutrițională la pacienții cu HD. Administrarea orală de L-carnitină a crescut nPCR independent de doza de dializă [12]. L-carnitina a îmbunătățit, de asemenea, parametrii nutriționali, cum ar fi transferina serică și albumina la pacienții cu HD [13, 14]. Administrarea intravenoasă de L-carnitină (2 g) la sfârșitul unei sesiuni HD crește și diametrele morfologice ale fibrelor musculare scheletice [15]. Tratamentul cu L-carnitină a prevenit deteriorarea ratei maxime a consumului de oxigen (VO2 max) [16].
În acest studiu, L-carnitina a crescut semnificativ proteinele serice care leagă retinolul și transferina la 6 luni mai târziu. În plus, tratamentul a crescut amoniacul seric în ciuda limitelor normale, indicând posibilitatea ca L-carnitina să mărească producția de amoniac prin ciclul de uree prin creșterea aportului de alimente. Cu toate acestea, nPCR, un marker indirect al aportului de proteine din dietă, a rămas mai scăzut în timpul studiului. L-carnitina, de asemenea, nu a îmbunătățit alți parametri nutriționali, cum ar fi GNRI și PNI. Nu a existat nicio diferență în zona masei musculare, puterea mânerului și% CGR. Aceste descoperiri sugerează în mod convingător că tratamentul oral cu L-carnitină timp de 6 luni pentru menținerea carnitinei fără ser în intervalul normal nu a atenuat starea nutrițională slabă.
În schimb, TSF a crescut semnificativ după tratament. Cu toate acestea, din moment ce raportul TMA/TBA, un marker al suprafeței masei scheletice a coapsei, a fost destul de redus de la 9,1 ± 3,0 la 8,8 ± 3,1, în ciuda nicio creștere a greutății corporale, s-ar putea explica prin modificările compoziției regionale a corpului datorate sarcopeniei progresive la brațul superior.
Efecte asupra răspunsului imun
Activitatea celulelor NK joacă un rol important în mecanismul de apărare împotriva infecțiilor și tumorilor. La pacienții cu HD, activitatea celulelor NK este fie redusă, fie neschimbată [17]. Un raport mai mare CD4/CD8, un marker al producției de Ig de către celulele B, este, de asemenea, asociat cu un răspuns serologic mai bun la vaccinarea împotriva hepatitei B [18].
L-carnitina poate restabili modificările legate de vârstă ale funcției neutrofilelor, cum ar fi activitatea chimiotactică și fagocitară in vitro [19]. Tratamentul cu L-carnitină a împiedicat, de asemenea, colita experimentală indusă de agenți prin abrogarea atât a răspunsurilor imune înnăscute, cât și adaptative la șoareci [20]. În plus, L-carnitina poate reduce nivelurile apoptotice ale celulelor CD4 + și CD8 + [21].
În studiul de față, suplimentarea cu L-carnitină a crescut semnificativ activitatea celulelor NK la raporturi E/T de 10: 1 și 20: 1, dar a devenit evidentă la 6 luni. Deci, vor fi necesare cel puțin mai mult de 3 luni pentru a restabili activitatea celulelor NK după terapia cu L-carnitină. Deficiența de seleniu este potențial asociată cu imunitatea celulară la pacienții cu HD [17]. Cu toate acestea, seleniul seric a fost destul de scăzut de la 60,4 ± 13,9 la 52,4 ± 12,2 μg/L după suplimentare, sugerând nicio asociere a deficitului de seleniu cu activitatea restabilită a celulelor NK.
Efecte asupra parametrilor cardiaci
L-carnitina previne dezvoltarea fibrozei ventriculare și a insuficienței cardiace cu EF conservat în bolile cardiace hipertensive [22]. L-carnitina blochează, de asemenea, disfuncția ventriculară stângă indusă de deficiența vitaminei B și atenuează creșterea determinată de dietă a BNP seric [23]. La pacienții cu insuficiență cardiacă cronică, nivelurile plasmatice de carnitină sunt corelate cu% FS, EF și LVMI [24]. O meta-analiză a arătat, de asemenea, că L-carnitina este asociată cu o reducere cu 27% a mortalității prin toate cauzele și cu o reducere cu 40% a simptomelor anginoase la pacienții care suferă de infarct miocardic acut [25].
S-a raportat că tratamentul oral cu L-carnitină a îmbunătățit semnificativ funcția ventriculară stângă [26, 27], în timp ce a redus LVMI [28]. În acest studiu, am confirmat că suplimentarea cu L-carnitină a determinat o creștere semnificativă a% FS concomitent cu o reducere a BNP. În schimb, L-carnitina nu a modificat LVMI. Motivul acestei discrepanțe rămâne necunoscut, dar se poate datora parțial perioadei mai scurte de suplimentare decât în studiul anterior (12 luni) [28].
Efecte asupra inflamației
O legătură între inflamație și deficitul de carnitină a fost bine sugerată la pacienții cu HD. Cu toate acestea, rezultatele a două recente studii de meta-analiză care implică studii controlate randomizate nu au coincis; un studiu [29] a arătat că L-carnitina a scăzut semnificativ CRP seric, în timp ce celălalt nu a dezvăluit niciun efect [30].
În acest studiu, L-carnitina orală nu a modificat nivelul seric al CRP, în timp ce a crescut mai degrabă nivelul seric al IL-6 după 6 luni. Deoarece se raportează că administrarea orală de 1000 mg/kg BW de L-carnitină a scăzut CRP seric și IL-6 [31, 32], poate fi necesară o doză mai mare pentru a atenua răspunsul inflamator legat de uremie.
Limitări de studiu
Există mai multe limitări la acest studiu. În primul rând, acest studiu nu a fost realizat într-un mod controlat randomizat, iar numărul pacienților a fost clar mic. Deci, sunt necesare studii viitoare care implică mai multe eșantioane pentru a confirma asocierea tratamentului cu L-carnitină și parametrii clinici. În al doilea rând, am comparat pur și simplu o mulțime de markeri clinici înainte și după tratamentul cu L-carnitină. Deci, rămâne necunoscut dacă aceste modificări imunologice și ecocardiografice pot duce sau nu la efecte benefice asupra rezultatelor clinice. În al treilea rând, deoarece am administrat L-carnitină pe cale orală la o doză relativ mică, efectul său poate fi limitat în comparație cu administrarea intravenoasă. În al patrulea rând, nu am măsurat indicele masei scheletice apendiculare utilizând impedanța bioelectrică (BIA) sau absorptiometria cu raze X cu energie duală, deci nu am putut confirma cu precizie prezența sarcopeniei. În cele din urmă, atrofia musculară progresează în timp, deci va fi necesar să se evalueze efectul L-carnitinei pe termen lung.
Concluzii
Am arătat că suplimentarea cu L-carnitină a avut mai multe efecte asupra parametrilor clinici. L-carnitina a crescut activitatea celulelor NK după tratamentul de 6 luni. A existat o creștere semnificativă a% FS cu o scădere a BNP. Constatările au sugerat că L-carnitina poate îmbunătăți parametrii funcționali sistolici imunologici și legați de VS. În schimb, L-carnitina nu ameliorează markerii sarcopenici și nu reduce răspunsul inflamator. Deci, viitorul ECR bine conceput este evident necesar pentru a confirma acțiunile multidirecționale ale suplimentării cu L-carnitină la pacienții cu HD regulat.
- Efectele unei înlocuiri a mesei asupra compoziției corpului și a parametrilor metabolici la subiecții cu
- NECESITĂȚI DE ENERGIE PENTRU RECUPERAREA EFECTELOR DIAREII - Managementul nutrițional al diareei acute
- Găsiți cel mai bun) Diagrama obiectivului de scădere în greutate Efecte secundare ale suplimentului Vulcan Gnc - Camp Como
- Steroizii obișnuiți pentru astm corelați cu efectele secundare ale glandelor suprarenale Articolul AMP Reuters
- Efecte secundare ale glucofagului Frecvente, severe, pe termen lung