Abstract
Scop
Nutriția maternă slabă sensibilizează la dezvoltarea bolilor metabolice și a obezității la vârsta adultă de-a lungul mai multor generații. Prevalența crește atunci când descendenții sunt hrăniți cu o dietă bogată în grăsimi (HF) după înțărcare. Acest studiu își propune să determine dacă astfel de profiluri metabolice pot fi transmise generației a doua și chiar agravate atunci când mamele au fost expuse la supranutriție, cu atenție la diferențele sexuale potențiale.
Metode
Șobolanii Wistar însărcinați au fost supuși ad libitum (control) sau 70% regim alimentar restricționat (FR) în timpul gestației (F0). La înțărcare, femelele F1 au fost alocate a trei protocoale alimentare: (1) dieta standard înainte și în timpul gestației și alăptării, (2) dieta HF înainte și dieta standard pe tot parcursul gestației și alăptării și (3) dieta HF înainte și pe tot parcursul gestație și lactație. Descendenții F2 au fost studiați între 16 și 32 de săptămâni.
Rezultate
Descendenții FR-F2 din dieta standard au prezentat adipozitate normală și nu au avut modificări metabolice semnificative la vârsta adultă. Dieta maternă HF a dus la efecte specifice sexului, cu tulburări metabolice mai evidente la descendenții de control expuși la dieta HF în timpul gestației și alăptării. Puii de control au prezentat intoleranță la glucoză asociată cu rezistența la insulină la femei. Ficatele de sex feminin au supraexprimat genele de lipogeneză și cele ale bărbaților, genele implicate în oxidarea lipidelor. Expresia genică a fost semnificativ atenuată la ficatul FR. Activitatea fizică crescută asociată cu niveluri crescute de corticosteron a fost observată la femelele FR în dieta standard și la toate femeile de la mame supraalimentate.
Concluzii
Subnutriția maternă în timpul gestației (F0) îmbunătățește sănătatea metabolică a descendenților din a doua generație cu efecte mai benefice la femei.
Introducere
Ipoteza originii dezvoltării sănătății și bolilor (DOHaD) afirmă că malnutriția, mai ales atunci când apare în perioadele fetale și/sau neonatale, crește riscul dezvoltării bolilor metabolice la vârsta adultă [1,2,3]. Descendenții trebuie să fie gospodăriți din punct de vedere nutrițional pentru a se adapta la maree față de o nutriție deficitară în așteptarea unor condiții nutriționale viitoare identice cu mediul matern [4, 5]. Orice nepotrivire de mediu cu predicțiile are ca rezultat o inadaptare și crește riscul de boală la indivizi [6,7,8]. Dovezile experimentale și epidemiologice sugerează că riscul nu este limitat doar la indivizii expuși, ci și la generațiile ulterioare, chiar dacă condițiile nutriționale sunt favorabile [9,10,11,12,13]. Transmiterea intergenerațională a bolilor contribuie astfel la pandemia de obezitate și diabet în lume. Descendenții (nepoții) persoanelor subnutrite prenatal au o adipozitate crescută și sunt predispuși la boli cronice ulterior [14]. De acord, modelele animale au arătat că malnutriția în uter și/sau în timpul alăptării a crescut și riscul de obezitate, intoleranță la glucoză, rezistență la insulină și diabet de tip 2 în generația următoare [15,16,17,18,19,20, 21].
Au fost observate diferențe de sex în moștenirea bolilor programate, bărbații fiind adesea mai afectați decât femeile [13, 17, 22, 23]. Dimorfismul sexual se explică parțial prin faptul că traiectoria de creștere a făturilor masculine și feminine este diferită atât în sarcinile normale, cât și în cele patologice. Viteza de creștere este accelerată la fetuții masculi și menținută atunci când se confruntă cu un mediu advers în detrimentul sănătății viitoare. În schimb, fetușii de sex feminin au o creștere mai lentă, permițându-le să se adapteze mai bine la tulburările intrauterine cu prognostic de supraviețuire favorabilă pe termen lung [13, 14]. Placenta contribuie la adaptări specifice sexului la perturbările sarcinii [24, 25].
Folosind un model de șobolan, am raportat anterior că descendenții masculi de la mamele cu restricție alimentară prenatală (restricție calorică 70%, animale FR30) prezintă restricții de creștere intrauterină, greutate redusă la naștere și dezvoltă adipozitate, intoleranță la glucoză și hipertensiune cu îmbătrânirea [26, 27], în special atunci când este hrănit cu o dietă bogată în grăsimi (HF) după înțărcare [28,29,30]. Deși femelele FR-F1 sunt mai puțin susceptibile la apariția bolilor metabolice comparativ cu bărbații [31, 32], sub cerințele fiziologice ale sarcinii, ele pot prezenta în timpul gestației tulburări metabolice precum intoleranța la glucoză și diabetul gestațional [13]. Astfel, gestația poate demonta disfuncțiile metabolice la femeile predispuse, mai ales dacă mamele însărcinate sunt supra-hrănite. La rândul său, aceasta induce un mediu intrauterin suboptim pentru fătul F2 în curs de dezvoltare și îi compromite sănătatea viitoare la maturitate.
Nutriția maternă în timpul alăptării joacă un rol critic în determinarea fenotipului metabolic al descendenților [33,34,35], iar obezitatea maternă și/sau dieta maternă HF afectează compoziția lipidică a laptelui matern [36]. Acest lucru sugerează că expunerea la dieta hipercalorică la femeile sensibile în timpul gestației și/sau alăptării poate crește vulnerabilitatea la boli metabolice în generația ulterioară de F2.
În studiul de față, am evaluat transmiterea intergenerațională a rezultatelor bolii programate prin descendența maternă. Mamele însărcinate, F0, au fost expuse la subnutriție pe tot parcursul gestației. Femelele F1 de la mame cu restricție alimentară (FR) au fost alocate fie dietelor standard, fie HF la înțărcare și crescute pentru a produce generația F2. Aici, am testat ipoteza conform căreia generația FR-F2, născută de femelele F1 pe dietă HF, anterior și/sau în timpul gestației și alăptării a fost mai afectată. Prin urmare, am stabilit dacă subnutriția maternă în timpul gestației (1) a crescut riscul de a dezvolta boli metabolice la descendenții F2, (2) a accentuat efectele induse de dieta HF a femelelor F1 și (3) a indus diferențele sexuale.
Materiale și metode
Animale
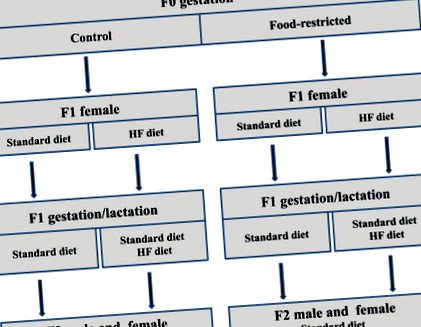
Proiectare experimentală care prezintă schema de reproducere și strategiile nutriționale pentru a doua generație (F2). Dieta la mamele F0 în timpul sarcinii este denumită martor (C, ad libitum) sau hrană restricționată (FR, 30% din aportul zilnic) (prima literă). Dieta la descendenții femelei F1 este denumită dietă standard (S) sau dietă bogată în grăsimi (HF) și este alocată înainte de gestație (a doua literă) sau în timpul gestației (a treia literă) și a alăptării (a patra literă)
Test de toleranță orală la glucoză
După un post peste noapte, s-a injectat d-glucoză (2 mg/g greutate corporală) per os la șobolanii conștienți. Nivelurile de glucoză din sânge au fost măsurate folosind ACCU-CHEK Performa (Roche Diagnostics, Meylan, Franța) la 0, 30, 60, 90 și 120 de minute prin puncția cozii. Aria totală sub curbă (ASC) a fost calculată utilizând metoda trapezoidală (GraphPad Prismv6.01, La Jolla, CA, SUA). Evaluarea modelului de homeostazie pentru rezistența la insulină (HOMA-IR) a fost calculată așa cum s-a descris anterior [37].
Analiza plasmatică
Nivelurile plasmatice de insulină și corticosteron au fost determinate folosind kituri ELISA comerciale specifice șobolanilor (DRG International, Inc, SUA; Bertin Pharma, Montigny-le Bretonneux, Franța; Immunodiagnostic Systems Ltd, Boldon, Marea Britanie). Concentrațiile de acizi grași neesterificați în plasmă (NEFA) și trigliceride (TG) au fost analizate folosind kituri de testare enzimatică (Wako Chemicals, Neus, Germania; Sobioda, Montbonnot, Franța).
Conținutul de trigliceride hepatice
Trigliceridele hepatice au fost extrase conform unei metode descrise anterior, cu unele modificări [38]. Lipidele au fost extrase prin tehnica izopropanol - hexan - apă/hexan - dietil eter. Trigliceridele au fost măsurate utilizând reactivul trigliceridic Infinity (Thermo Fisher Scientific, MA, SUA). Trioleina (Sigma-Aldrich, St. Louis, MO, SUA) a fost utilizată ca standard.
Reacție în lanț cantitativă în timp real a polimerazei
ARN total a fost extras din probe de ficat congelate rapid (20 mg), utilizând minikit-ul RNeasy (Qiagen, Crawley, Marea Britanie). ARN (1 μg), a fost transcris invers prin utilizarea kitului de transcripție inversă ThermoScript cDNA (Invitrogen Life Technologies, Carlsbad, CA, SUA). Experimentele PCR în timp real au fost efectuate printr-un sistem Light-Cycler 2700 (Roche Biochemicals, Franța). Toate probele de ADNc au fost analizate în duplicat și reacția a fost efectuată cu QuantiTect SYBR Green PCR Master Mix (Qiagen). Cuantificarea relativă a fiecărei gene a fost calculată după normalizare la β-actină (gena de menaj) utilizând metoda comparativă a ciclului de prag. Primerii utilizați sunt enumerați în Tabelul 2 suplimentar.
analize statistice
Analizele statistice au fost efectuate folosind GraphPad Prism v6.01.Comparații multiple au fost efectuate utilizând analiza varianței Kruskal-Wallis urmată de testul post-hoc Mann-Whitney. Valorile greutății corporale și ale testului de toleranță la glucoză pe cale orală (OGTT) au fost analizate printr-o analiză a varianței repetate în două direcții (RM-ANOVA) cu testul Bonferroni post hoc. Diferențele dintre valorile masculine și feminine au fost analizate cu nepereche t test cu corecția lui Welch. Datele sunt exprimate ca medie ± SD sau mediană, cu interval intercuartilic, după caz. Semnificația a fost determinată la P valoare
Rezultate
Efectele subnutriției materne asupra creșterii și metabolismului descendenților F2
Efectele dietei bogate în grăsimi materne asupra creșterii și metabolismului la descendenții F2
Dimorfism sexual biologic
În general, descendenții masculi în vârstă de 32 de săptămâni au avut niveluri mai ridicate de insulină plasmatică și TG și valori HOMA-IR în comparație cu descendenții feminini, indiferent de descendență și dieta barajului F1. În schimb, nivelurile plasmatice de NEFA au fost mai mari la femele decât la iepe, indiferent de dieta barajului F1 în linia C, nu în linia FR.
Discuţie
Concluzionăm că descendenții FR-F2 născuți de mamele F1 care urmează o dietă de control sau care au primit o dietă HF prezintă un risc scăzut de boli metabolice, indicând faptul că subnutriția in utero (F0) pare să aibă un impact favorabil asupra sănătății metabolice a descendenților din a doua generație. . Această constatare contestă ipoteza că fenotipul economisitor face un individ mai sensibil la bolile cronice. Cel puțin, aceste rezultate sugerează o susceptibilitate redusă la boli la descendenți atunci când sunt asociați cu descendența maternă. Raportăm dovezi că profilul metabolic este îmbunătățit la femeile FR-F2 și că modelul de exprimare a genei în ficat este predictiv al bolilor hepatice grase, susținând diferențele de sex în fiziopatologia bolilor metabolice [60]. Dimorfismul sexual arată că femelele descendente pot fi mai puțin vulnerabile la influența mediului nutrițional în perioadele timpurii de dezvoltare. Diferențele sexuale pot avea impact asupra apariției și gravității patologiilor și astfel pot compromite speranța de viață a individului.
În acest context, studiile pe animale ar trebui efectuate în mod sistematic atât la bărbați, cât și la femei, pentru a proiecta intervenții terapeutice specifice sexului, care vizează prevenirea bolilor metabolice și îmbunătățirea sănătății generațiilor viitoare.
Referințe
Barker DJ (2007) Originile teoriei originilor dezvoltării. J Intern Med 261: 412-417
- Efectul complexității dietei creșei și a vârstei de înțărcare
- Efectul cătinei asupra fibrozei hepatice Un studiu clinic
- Efectul tărâței de orez nesaponificabile asupra dietei bogate în grăsimi - obezitatea indusă la șoareci - Șuncă - 2015 - Jurnal
- Efectul conținutului de vitamina A al dietei asupra structurii părului SpringerLink
- Efectul hrănirii prelungite a morcovilor cruzi asupra conținutului de vitamina A din ficat și rinichi la câine - R