Subiecte
Abstract
Introducere
Obezitatea este o boală metabolică caracterizată prin dezechilibru energetic și acumulare excesivă de grăsime. Cu toate acestea, mecanismele care cauzează boala nu au fost încă pe deplin elucidate. Se știe că factorii genetici, dieta slabă și stilul de viață sedentar sunt principalele cauze ale obezității, dar doar 16% dintre indivizii obezi sunt obezi genetic. O ipoteză propune că factorii de mediu sunt principala cauză a obezității, deși nu au fost clarificați exact factorii de mediu care duc la obezitate. Ipoteza obezogenilor sugerează că substanțele chimice care afectează endocrin (EDC) din mediu sunt principala cauză a obezității 1,2 .
Esterii ftalatici (PAE), care sunt utilizați pe scară largă la fabricarea materialelor plastice au fost implicați ca EDC și studiile au sugerat că expunerea la doze mici de PAEs poate fi asociată cu obezitatea. Un studiu transversal pe 5149 de subiecți efectuat de Studiul Național de Sănătate și Nutriție (NHANES) a găsit o asociere semnificativă statistic a indicelui de masă corporală (IMC) și circumferința taliei cu ftalați 3. Într-un studiu prospectiv al adulților în vârstă de 70 de ani de la Universitatea Uppsala din Suedia, sa constatat că rezistența la insulină este strâns corelată cu expunerea la metaboliții ftalatului 4. Acest studiu a dezvăluit că metaboliții ftalatului pot interfera cu metabolismul glucozei prin calea receptorilor cu proliferator activat de Peroxisom (PPAR). Există, de asemenea, dovezi că mono (2-etilhexil) ftalatul (MEHP) interferează cu transformarea biologică a țesutului adipos, perturbă sistemul hormonal endocrin și determină neregularitatea sistemului de control hipotalamic - hipofizar - suprarenal pentru a promova formarea grăsimilor printr-un varietate de căi biologice, inclusiv interferența cu hormoni steroizi sau tiroidieni și activarea PPARs 5 .
Materiale și metode
Animale și tratamente
Șoarecii SPF C57BL/6J cu vârsta de 8 săptămâni au fost obținuți de la Laboratory Animal Center din cadrul Universității Jilin (Changchun, Jilin, China). Șoarecii au fost hrăniți cu o dietă standard care conținea (g%): 22,60% proteine, 50,87% carbohidrați, 3,37% lipide, 3,33% fibre, 6,88% minerale și 12,95% apă și au fost menținuți la 22 ± 1 ° C cu o lumină de 12 ore/ciclu întunecat și hrană și apă ad libitum. Experimentul pe animale a fost realizat în conformitate cu Ghidul Institutelor Naționale de Sănătate pentru Îngrijirea și Utilizarea Animalelor de Laborator și a fost aprobat de Comitetul de Îngrijire și Utilizare a Animalelor din cadrul Universității Beihua.
Măsurători ale compoziției corpului
La sfârșitul studiului de 21 de săptămâni, compoziția corporală a șoarecilor a fost analizată cu precizie în ceea ce privește grăsimea corporală totală și masa slabă utilizând analizorul de compoziție a corpului animalelor mici (Minispec LF-50, Bruker, Germania).
Teste de toleranță la glucoză și insulină
La sfârșitul săptămânii 21, șoarecii au postit timp de 18 ore pentru un test de toleranță la glucoză sau 6 ore pentru un test de toleranță la insulină. Sângele a fost dobândit din vena cozii și s-a măsurat nivelul glicemiei în repaus (timpul 0) folosind ultraglucometre One-Touch (Life Scan). Animalelor li s-a administrat apoi fie 2 g/kg glucoză, fie 0,75 U/kg insulină (Humulin regulat, Eli Lilly și Company) prin injecție intraperitoneală. Curbele glicemiei au fost trasate pe baza glucozei din probele de sânge prelevate la 15 min, 30 min, 60 min și 120 min după injectare, iar aria de sub curbă (ASC) a fost calculată.
Studii de colivie metabolică
Animalele individuale au fost adăpostite în cuști cu un ciclu de întuneric/lumină de 12 ore la temperatura camerei (22 ± 1 ° C). Aportul bazal de alimente și apă, eliminarea urinei și a fecalelor, consumul de oxigen (VO2), producția de dioxid de carbon (VCO2) și activitatea locomotorie au fost determinate în această perioadă de sistemul calorimetric TSA (TSA System, Germania) și Cheltuielile energetice (EE) )) și coeficientul respirator (RQ) au fost calculate utilizând acești parametri. Temperatura a fost măsurată în anus.
Chimii serice și hepatice
Probele de sânge au fost centrifugate la 3000 rpm timp de 10 min pentru a obține serul, iar țesuturile hepatice au fost omogenizate. Insulina serică de post și leptina serică de post au fost măsurate cu kituri ELISA de la Dingguo Changsheng Biotechnology (Beijing, China). Nivelurile serice de TG, TC, acizi grași liberi (FFA), TG hepatic și hepatic TC au fost determinate folosind seturi de testare corespunzătoare (Nanjing Jiancheng Bioengineering Institute, Nanjing, Jiangsu, China).
Analiza histologică
Țesuturile au fost fixate în paraformaldehidă 4% (pH 7,4) timp de 24 de ore la temperatura camerei, încorporate în parafină și secționate în felii groase de cinci micrometri. Secțiunile WAT și pancreasul au fost colorate cu hematoxilină și eozină (Dingguo Changsheng Biotechnology, Beijing, China), iar secțiunile ficatului au fost colorate cu roșu ulei O (Wuhan Goodbio technology Co., Ltd., Wuhan, China). Imaginile au fost realizate cu o cameră digitală (DP20, Olympus, Tokyo, Japonia) pentru a evalua histopatologia țesuturilor.
PCR în timp real pentru a măsura expresia
ARNm total al țesutului adipos maro (BAT) a fost izolat cu RNAiso plus (TaKaRa Dalian Biotechnology, Dalian, China). Transcrierea inversă a fost efectuată de Prime Script RT Reagent Kit (TaKaRa Dalian Biotechnology, Dalian, China). PCR cantitativă în timp real folosind SYBR Premix Ex Taq Mix (TaKaRa Dalian Biotechnology, Dalian, China) a fost realizată într-un sistem ABI Q6 în timp real de PCR (ABI, Carlsbad, CA, SUA). Volumul total de reacție a fost de 7, l, inclusiv 0,25 (l din fiecare primer (10 uM), 2 (l de ADNc diluat de zece ori, 3,5 (l de SYBR Premix Ex Taq și 1 (l de H2O fără RNază). Condițiile specifice de reacție au fost: 2 minute la 95 ° C, urmate de 40 de cicluri de 15 s la 95 ° C și 1 min la 60 ° C. Rezultatele au fost normalizate la niveluri de β-actină (Metoda 2 -Ct). Primerii utilizați au fost obținuți de la Sangon Biotech (Shanghai, China) și sunt enumerați în Tabelul 1.
Analiza Western blot
BAT a fost separată, congelată în azot lichid și depozitată la - 80 ° C până la utilizare. Pentru analiza Western blot, probele au fost omogenizate în tampon RIPA conținând 0,1% PMSF (KeyGEN BioTECH, Nanjing, China), centrifugate (12.000 ×g, 15 min, 4 ° C) și supernatantul a fost colectat. Conținutul de proteine a fost determinat folosind un kit BCA (Thermo Fisher Scientific, San Jose, CA, SUA). Cantități egale de proteine (60 μg/bandă) au fost separate pe geluri SDS-PAGE de 8% și apoi transferate pe membranele PVDF. După blocarea cu 5% lapte degresat timp de 2 ore la temperatura camerei, membranele au fost incubate cu următorii anticorpi primari: β-actină (1: 500, Santa Cruz, CA, SUA); Decuplarea proteinei 1 (UCP1) (1: 1000, Santa Cruz); Proteina de imunoglobulină de legare (Bip) (1: 1000, Santa Cruz); CCAAT/proteină omologă de legare a amplificatorului (Chop) (1: 1000, Santa Cruz) în TBS-T conținând 3% BSA peste noapte la 4 ° C. Membranele au fost apoi incubate cu anticorp secundar conjugat cu HRP (diluție 1: 5000, Dingguo Changsheng Biotechnology, Beijing, China) la 37 ° C timp de 2 ore. După trei spălări în TBS-T, imaginile au fost detectate folosind un sistem de detectare chemiluminiscentă (Tanon Image System Ver.5200, Shanghai, China).
analize statistice
Toate datele au fost prezentate ca media ± Std Dev și semnificația statistică determinată de analiza unică a varianței (ANOVA) urmată de testul diferenței cele mai puțin semnificative (LSD) Fisher, utilizând software-ul statistic SPSS (software SPSS 13.0, SPSS Inc, Chicago, IL, STATELE UNITE ALE AMERICII). Semnificația statistică a fost considerată a fi P
Rezultate
Depozite de țesut adipos
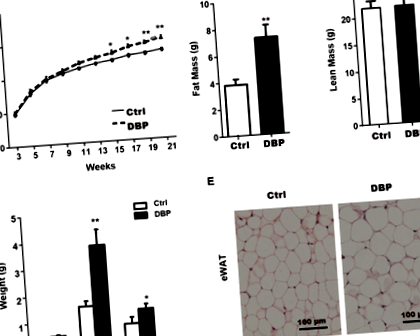
Creșterea și dezvoltarea tuturor șoarecilor au fost normale pe parcursul perioadei experimentale, dar greutățile corporale din grupul DBP au fost semnificativ mai mari decât cele din grupul Ctrl de la 15 la 21 de săptămâni (Fig. 1A). Comparativ cu grupul Ctrl, la 21 de săptămâni, masa grasă, țesutul adipos alb epididimal (eWAT) și țesutul adipos alb inghinal (iWAT) din grupul DBP au fost semnificativ crescute (Fig. 1B, D). În timp ce masa slabă și țesutul adipos maro (BAT) nu au prezentat nicio diferență statistică între grupurile Ctrl și DBP la 21 de săptămâni (Fig. 1C, D). Colorarea H&E a arătat că volumul adipocitelor care constituie eWAT în grupul DBP a fost semnificativ mai mare decât în grupul Ctrl (Fig. 1E).
Tulburare metabolică a glucozei
Testul de toleranță la glucoză a arătat că ASC a glicemiei a fost semnificativ mai mare în grupul DBP comparativ cu grupul Ctrl și a fost mai mare la 30 min și 60 min, așa cum se arată în fig. 2A. În plus, testul de toleranță la insulină a arătat niveluri mai ridicate de glucoză în sânge în grupul DBP decât la martori la 15 min, 30 min și 60 min după injectarea insulinei (Fig. 2B), indicând faptul că expunerea la DBP ar putea duce la rezistență la insulină. În plus, nivelurile de insulină și leptină serice de post au fost ambele semnificativ crescute la șoarecii expuși la DBP (Fig. 2C, D).
Secțiunile pancreatice colorate cu H&E au arătat că dispunerea celulelor insulei din grupul DBP era dezordonată, limita era neclară, iar dimensiunea și forma nucleelor insulei erau neregulate. În plus, unele celule insulare din grupul DBP au prezentat degenerescență vacuolară (Fig. 2E).
Metabolizarea lipidelor
Pentru a investiga efectul expunerii la DBP asupra metabolismului lipidic, am măsurat mai mulți indicatori biochimici relevanți. Rezultatele au arătat că, în comparație cu grupul Ctrl, serul TG, TC și FFA, precum și TG și TC hepatice au fost semnificativ crescute în grupul DBP (Fig. 3A - C, E, F). Mai mult, în feliile de ficat colorate cu roșu ulei O, acumularea de picături lipidice a fost mai mare la hepatocitele șoarecilor expuși DBP comparativ cu grupul Ctrl (Fig. 3D).
Metabolismul energetic
Pentru a examina dacă creșterile în greutatea corporală și conținutul de WAT după descendenții expunerii in utero DBP au fost legate de aportul sau activitatea alimentară, am efectuat un test în cușcă metabolică. Rezultatele prezentate în Fig. 4A - C, F arată că consumul de oxigen, producția de dioxid de carbon, consumul de energie și activitatea locomotorie în grupul DBP au fost ușor mai mici decât în grupul Ctrl, dar diferențele dintre cele două grupuri nu au fost semnificative. De asemenea, nu au existat diferențe statistice între cele două grupuri în ceea ce privește consumul de alimente sau RQ (Fig. 4D, E), dar temperatura anală a fost mai mică în grupul DBP (Fig. 4G).
Inhibarea expresiei UCP1 și a stresului reticulului endoplasmatic (ER)
Pentru a investiga dacă UCP1 a fost implicat în obezitatea observată la descendenții expuși la DBP, nivelurile relative de mARN ale UCP1, receptorul activat cu proliferatorul Peroxisomului γ coactivator 1α (Pgc-1α), factorul de transcripție domeniu PR conținând 16 (Prdm16) și moartea celulară inducerea efectorului A (Cidea) asemănător factorului de fragmentare a ADN-ului la șoareci a fost analizată prin RT-PCR, iar expresia proteinei UCP1 a fost evaluată prin Western blot. Așa cum se arată în FIG. 5A, B, nivelurile relative de mARN ale UCP1, Pgc-1α, Prdm16 și Cidea au fost semnificativ reduse, iar expresia proteinei UCP1 a fost mai mică la descendenți cu expunere intrauterină la DBP. Pentru a investiga dacă această obezitate a fost asociată cu stresul ER, expresia Bip și Chop a fost măsurată prin RT-PCR și Western blot. Rezultatele au indicat că expunerea intrauterină la DBP a crescut expresia Bip și Chop, determinată atât de nivelurile relative de mARN cât și de proteine (Fig. 5C, D).
TUDCA a ameliorat obezitatea la șoareci prin inhibarea stresului ER
Pentru a investiga în continuare dacă stresul ER este implicat în obezitatea indusă de DBP, șoarecii au fost tratați cu TUDCA. Greutatea corporală la șoarecii expuși la DBP a fost semnificativ mai mare decât la martorii din zilele 1-14 (Fig. 6A), dar tratamentul ulterior cu TUDCA (DBP + TUDCA) a redus greutatea corporală la șoareci de la 7 la 14 zile, fără a modifica corpul greutate la șoarecii Ctrl + TUDCA. În comparație cu martorii, șoarecii expuși la DBP au avut un conținut total mai mare de grăsimi și ASC mai mare pentru glucoza din sânge, dar tratamentul cu TUDCA (DBP + TUDCA) a restabilit acești parametri la niveluri similare cu cele găsite la șoarecii Ctrl. În cele din urmă, comparativ cu șoarecii salini DBP +, șoarecii tratați cu TUDCA (DBP + TUDCA) au prezentat niveluri relative de ARNm scăzute pentru Bip și Chop și o expresie mai mare a proteinei UCP1, sugerând că stresul reticulului endoplasmatic participă la obezitatea indusă de DBP prin suprimarea UCP1. 6D, E).
Discuţie
EDC-urile pot perturba funcția programată a căii de semnalizare endocrină și pot interfera sau bloca secreția, sinteza, eliberarea, legarea, activarea, inactivarea și metabolismul hormonilor normali. Manifestările specifice sunt: întreruperea hormonilor majori de control al greutății precum catecolamina, hormonul tiroidian, estrogenul, insulina, hormonul de creștere, leptina, testosteronul și corticosteroizii; sensibilitate hormonală modificată, în special pentru dopamină, serotonină și angiotensină; și întreruperea proceselor metabolice. Împreună, aceste efecte pot duce la deteriorarea țesuturilor și a organelor, în special la nivelul nervilor și mușchilor 12,13,14,15,16, chiar și la niveluri scăzute de expunere. În studiul nostru, șoarecilor însărcinați li s-a administrat DBP a fost din a 12-a zi de gestație până în a 7-a zi după naștere, o perioadă critică în diferențierea țesutului adipos, a organelor de reproducere și a sistemului imunitar. În acest stadiu de dezvoltare, făturile și nou-născuții sunt foarte sensibili la perturbatorii endocrini ai mediului 17.18, care pot trece prin barierele sanguine materne pentru a ajunge la placentă și la laptele matern.
O teorie importantă în domeniul endocrinologiei mediului este efectul dozei mici de EDC, care poate arăta o relație nonmonotonă a „U” sau „U” inversat. De exemplu, expunerea prenatală și postnatală la doze mici la Bisfenol A (BPA) (1 mg/L apă potabilă) a indus obezitate și hiperlipidemie la șoarecii descendenți, în timp ce acumularea de grăsime nu a fost evidentă cu expunerea la doze mari la BPA (10 mg/L). L apă potabilă) 18. În mod similar, creșterea în greutate și creșterea grăsimii au fost observate la descendenții masculi la șoareci tratați cu doze mici de MEHP (0,05 mg/kg corp), dar nu și cu doze mari (0,5 și 0,25 mg/kg corp) 19. În plus, un studiu recent a arătat 20 că dozele mici de genisteină au dus la acumularea de grăsimi în țesuturile adipoase, dar dozele mari au inhibat acumularea de grăsimi în țesuturile adipoase, în special la bărbați. Mai mult, acumularea de grăsime cauzată de genisteină a fost asociată cu rezistența la insulină. Pe baza acestor studii anterioare, am utilizat o doză mică de DBP (1/20 de LD50 oral la șoarece) pentru expunerea intrauterină în acest studiu.
Deoarece metaboliții ftalaților sunt liganzi cunoscuți ai PPAR 21, aceștia pot afecta echilibrul glucozei in vivo. Prin deteriorarea bypass-ului semnalului PPAR, acestea sunt implicate în diferite stadii ale homeostaziei glucozei, participă la metabolismul glucozei, afectează secreția de insulină 22 nivelul circulației grăsimilor și cantitățile de depozite de grăsime viscerală și subcutanată 23. Măsurătorile de greutate, greutatea abdominală și volumul celulelor grase sunt principalele criterii pentru evaluarea obezității. În prezentul studiu, descendenții cu expunere intrauterină la DBP au prezentat câștiguri semnificativ mai mari în greutatea corporală de la 15 la 21 de săptămâni postnatale, comparativ cu șoarecii din grupul de control. Deși nu a existat nicio schimbare semnificativă în BAT între cele două grupuri, greutățile eWAT și iWAT au crescut semnificativ în grupul DBP, cu aproape de două ori mai mult eWAT, care reprezintă grăsime viscerală, decât s-a observat la șoarecii neexpuși.
Studii recente au arătat că proteina reactivă chaperonă 4-butirat (4-PBA) și TUDCA promovează plierea proteinelor în ER și mențin astfel homeostazia proteinelor 48,49. Alte studii au arătat că șaperonele pot reduce rezistența la leptină cauzată de stresul ER in vitro și pot crește sensibilitatea la leptină la șoarecii obezi 50. La șoarecii obezi, 4-PBA poate reduce rezistența la leptină mediată de stresul ER și TUDCA poate reduce rezistența la insulină în țesutul adipos al șoarecilor obezi, poate menține homeostazia glicemiei, crește sensibilitatea la insulină și reduce bolile hepatice grase prin reducerea stresului ER fără a afecta greutatea corporală 51. Pentru a verifica în continuare dacă stresul ER este implicat în obezitatea indusă de DBP, am tratat o parte din șoarecii expuși la PIB cu TUDCA. Am constatat că expresia markerilor de stres ER Bip și Chop la șoarecii expuși la DBP a fost semnificativ redusă prin tratamentul cu TUDCA, probabil prin inhibarea stresului ER. Mai mult decât atât, am constatat scăderi ale conținutului total de grăsimi și ale ASC ale glicemiei și crește expresia UCP1 la șoarecii expuși la DBP tratați cu TUDCA. Prin urmare, se pare că stresul ER este implicat în metabolismul lipidic și poate legat de nivelurile de UCP1.
În concluzie, expunerea intrauterină la doze mici de DBP ar putea induce stresul ER, care inhibă expresia UCP1, scăzând astfel consumul de energie de către BAT și afectând metabolismul lipidelor și zaharurilor, ducând în cele din urmă la obezitate la descendenți. Prin urmare, DBP poate fi un potențial inductor chimic al obezității și al bolilor metabolice conexe.
Acest studiu are unele limitări. În primul rând, este necesar un studiu suplimentar pentru a examina mecanismele exacte prin care expunerea intrauterină la doze mici de DBP induce stresul ER la descendenți. În al doilea rând, rămâne de confirmat dacă stresul ER inhibă UCP1 prin căi directe sau indirecte. În al treilea rând, sunt necesare experimente in vitro pentru a defini mecanismele moleculare implicate în dereglarea metabolică asociată cu expunerea la DBP.
- Deficitul de leucotrien A4 hidrolază protejează șoarecii de obezitatea indusă de dietă prin creșterea energiei
- O perioadă limitată de masă împiedică obezitatea la șoarecii predispuși să câștige în greutate The Scientist Magazine®
- O perioadă limitată de masă împiedică obezitatea la șoarecii predispuși să câștige în greutate The Scientist Magazine®
- Impactul obezității asupra ovotoxicității indusă de 7,12-dimetilbenz un antracen la șoareci
- Răspunsuri hematologice și de fază acută la obezitatea indusă de dietă la șoarecii IL-6 KO - ScienceDirect