Capacitatea de căldură măsoară cantitatea de căldură necesară pentru a crește temperatura unui obiect sau sistem cu un grad Celsius.
obiective de invatare
Explicați entalpia într-un sistem cu volum și presiune constante
Chei de luat masa
Puncte cheie
- Capacitatea de căldură este cantitatea fizică măsurabilă care caracterizează cantitatea de căldură necesară pentru a modifica temperatura unei substanțe cu o cantitate dată. Se măsoară în jouli per Kelvin și este dat de.
- Capacitatea de căldură este o proprietate extinsă, în funcție de dimensiunea sistemului.
- Capacitatea de căldură a majorității sistemelor nu este constantă (deși poate fi adesea tratată ca atare). Depinde de temperatura, presiunea și volumul sistemului luat în considerare.
Termeni cheie
- capacitate termică: Cantitatea de energie termică necesară pentru a crește temperatura unui obiect sau unitate de materie cu un grad Celsius; în unități de jouli pe kelvin (J/K).
- entalpia: cantitatea totală de energie dintr-un sistem, incluzând atât energia internă, cât și energia necesară pentru a-și deplasa mediul
Capacitate de căldură
Capacitatea de căldură (de obicei notată cu un C capital, adesea cu indicii), sau capacitatea termică, este cantitatea fizică măsurabilă care caracterizează cantitatea de căldură necesară pentru a schimba temperatura unei substanțe cu o cantitate dată. În unități SI, capacitatea de căldură este exprimată în unități de jouli pe kelvin (J/K).
Capacitatea termică a unui obiect (simbolul C) este definită ca raportul dintre cantitatea de energie termică transferată unui obiect și creșterea rezultată a temperaturii obiectului.
Capacitatea de căldură este o proprietate extinsă, deci se adaptează la dimensiunea sistemului. O probă care conține cantitatea de substanță de două ori mai mare decât o altă probă necesită transferul de două ori mai multă căldură (Q) pentru a obține aceeași schimbare de temperatură (ΔT). De exemplu, dacă este nevoie de 1.000 J pentru a încălzi un bloc de fier, ar fi nevoie de 2.000 J pentru a încălzi un al doilea bloc de fier cu masa de două ori mai mare decât primul.
Măsurarea capacității de căldură
Capacitatea de căldură a majorității sistemelor nu este o constantă. Mai degrabă, depinde de variabilele de stare ale sistemului termodinamic în studiu. În special, depinde de temperatura însăși, precum și de presiunea și volumul sistemului și de modalitățile prin care presiunile și volumele au fost permise să se schimbe în timp ce sistemul a trecut de la o temperatură la alta. Motivul pentru aceasta este că lucrarea de presiune-volum realizată sistemului crește temperatura acestuia printr-un alt mecanism decât încălzirea, în timp ce lucrarea de presiune-volum realizată de sistem absoarbe căldura fără a crește temperatura sistemului. (Dependența de temperatură este motivul pentru care definiția caloriilor este în mod formal energia necesară pentru a încălzi 1 g de apă de la 14,5 la 15,5 ° C în loc de în general cu 1 ° C.)
Prin urmare, pot fi efectuate diferite măsurători ale capacității de căldură, cel mai frecvent la presiune constantă și volum constant. Valorile astfel măsurate sunt de obicei subscrise (de p și respectiv V) pentru a indica definiția. Gazele și lichidele sunt de obicei măsurate la volum constant. Măsurătorile sub presiune constantă produc valori mai mari decât cele la volum constant, deoarece valorile presiunii constante includ, de asemenea, energia termică care este utilizată pentru a munci substanța împotriva presiunii constante pe măsură ce temperatura acesteia crește. Această diferență este deosebit de notabilă în gazele în care valorile sub presiune constantă sunt de obicei cu 30% până la 66,7% mai mari decât cele cu volum constant.
Relații termodinamice și definiția capacității de căldură
Energia internă a unui sistem închis se modifică fie prin adăugarea de căldură la sistem, fie prin efectuarea lucrărilor de către sistem. Reamintind prima lege a termodinamicii,
[latex] \ text = \ delta \ text- \ delta \ text [/ latex].
Pentru lucrări ca urmare a creșterii volumului sistemului, putem scrie,
Dacă căldura este adăugată la volum constant, atunci al doilea termen al acestei relații dispare și se obține cu ușurință
Aceasta definește capacitatea de căldură la volum constant, CV. O altă cantitate utilă este capacitatea de căldură la presiune constantă, CP. Cu entalpia sistemului dată de
ecuația noastră pentru dU se schimbă în
și, prin urmare, la o presiune constantă, avem
Căldura specifică
Căldura specifică este o proprietate intensivă care descrie cantitatea de căldură care trebuie adăugată unei anumite substanțe pentru a-i crește temperatura.
obiective de invatare
Rezumați relația cantitativă dintre transferul de căldură și schimbarea temperaturii
Chei de luat masa
Puncte cheie
- Spre deosebire de capacitatea totală de căldură, capacitatea specifică de căldură este independentă de masă sau volum. Descrie cât de multă căldură trebuie adăugată unei unități de masă a unei substanțe date pentru a-i crește temperatura cu un grad Celsius. Unitățile cu capacitate termică specifică sunt J/(kg ° C) sau echivalent J/(kg K).
- Capacitatea de căldură și căldura specifică sunt corelate cu C = cm sau c = C/m.
- Masa m, căldura specifică c, modificarea temperaturii ΔT și căldura adăugată (sau scăzută) Q sunt legate de ecuația: Q = mcΔT.
- Valorile căldurii specifice depind de proprietățile și faza unei substanțe date. Deoarece nu pot fi calculate cu ușurință, acestea sunt măsurate empiric și disponibile pentru referință în tabele.
Termeni cheie
- capacitate termică specifică: Cantitatea de căldură care trebuie adăugată (sau îndepărtată) dintr-o masă unitară a unei substanțe pentru a-și modifica temperatura cu un grad Celsius. Este o proprietate intensivă.
Căldura specifică
Capacitatea de căldură este o proprietate extinsă care descrie câtă energie termică este necesară pentru a crește temperatura unui sistem dat. Cu toate acestea, ar fi destul de incomod să măsurăm capacitatea de căldură a fiecărei unități de materie. Ceea ce ne dorim este o proprietate intensivă care depinde doar de tipul și faza unei substanțe și poate fi aplicată sistemelor de dimensiuni arbitrare. Această cantitate este cunoscută sub numele de capacitatea de căldură specifică (sau pur și simplu, căldura specifică), care este capacitatea de căldură pe unitate de masă a unui material. Experimentele arată că căldura transferată depinde de trei factori: (1) Schimbarea temperaturii, (2) masa sistemului și (3) substanța și faza substanței. Ultimii doi factori sunt încapsulați în valoarea căldurii specifice.
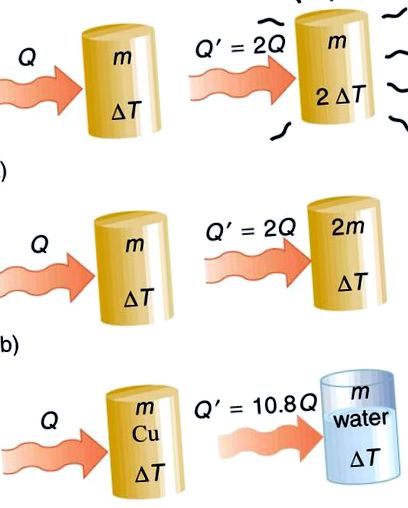
Transfer de căldură și capacitate specifică de căldură: Căldura Q transferată pentru a provoca o schimbare de temperatură depinde de magnitudinea schimbării de temperatură, de masa sistemului și de substanța și faza implicate. (a) Cantitatea de căldură transferată este direct proporțională cu schimbarea temperaturii. Pentru a dubla schimbarea de temperatură a masei m, trebuie să adăugați de două ori căldura. (b) Cantitatea de căldură transferată este, de asemenea, direct proporțională cu masa. Pentru a provoca o schimbare echivalentă de temperatură într-o masă dublată, trebuie să adăugați de două ori căldura. (c) Cantitatea de căldură transferată depinde de substanță și de faza acesteia. Dacă este nevoie de o cantitate Q de căldură pentru a provoca o schimbare de temperatură ΔT într-o anumită masă de cupru, va dura de 10,8 ori cantitatea de căldură pentru a provoca schimbarea de temperatură echivalentă în aceeași masă de apă, presupunând că nu se schimbă faza în niciuna dintre substanțe.
Capacitate specifică de căldură: Această lecție leagă căldura de o schimbare de temperatură. Discutăm despre modul în care cantitatea de căldură necesară pentru o schimbare de temperatură este dependentă de masă și de substanța implicată, iar această relație este reprezentată de capacitatea de căldură specifică a substanței, C.
Dependența de schimbarea temperaturii și a masei sunt ușor de înțeles. Deoarece energia cinetică (medie) a unui atom sau a unei molecule este proporțională cu temperatura absolută, energia internă a unui sistem este proporțională cu temperatura absolută și numărul de atomi sau molecule. Deoarece căldura transferată este egală cu modificarea energiei interne, căldura este proporțională cu masa substanței și cu schimbarea temperaturii. Căldura transferată depinde și de substanță, astfel încât, de exemplu, căldura necesară pentru creșterea temperaturii este mai mică pentru alcool decât pentru apă. Pentru aceeași substanță, căldura transferată depinde și de fază (gaz, lichid sau solid).
Relația cantitativă dintre transferul de căldură și schimbarea temperaturii conține toți cei trei factori:
unde Q este simbolul transferului de căldură, m este masa substanței și ΔT este schimbarea temperaturii. Simbolul c înseamnă căldură specifică și depinde de material și fază.
Căldura specifică este cantitatea de căldură necesară pentru schimbarea temperaturii de 1,00 kg de masă cu 1,00ºC. Căldura specifică c este o proprietate a substanței; unitatea sa SI este J/(kg⋅K) sau J/(kg⋅C). Reamintim că schimbarea temperaturii (ΔT) este aceeași în unități de kelvin și grade Celsius. Rețineți că capacitatea totală de căldură C este pur și simplu produsul capacității de căldură specifice c și a masei substanței m, adică.,
unde ϱ este densitatea substanței și V este volumul acesteia.
Valorile căldurii specifice trebuie în general căutate în tabele, deoarece nu există o modalitate simplă de a le calcula. În schimb, ele sunt măsurate empiric. În general, căldura specifică depinde și de temperatură. Tabelul de mai jos prezintă valorile reprezentative ale căldurii specifice pentru diferite substanțe. Cu excepția gazelor, dependența de temperatură și volum a căldurii specifice a majorității substanțelor este slabă. Căldura specifică a apei este de cinci ori mai mare decât cea a sticlei și de zece ori cea a fierului, ceea ce înseamnă că este nevoie de cinci ori mai multă căldură pentru a crește temperatura apei în aceeași cantitate ca pentru sticlă și de zece ori mai multă căldură pentru a crește temperatura. de apă ca pentru fier. De fapt, apa are una dintre cele mai mari călduri specifice din orice material, care este importantă pentru susținerea vieții pe Pământ.
Incalziri specifice: Enumerate sunt căldurile specifice ale diferitelor substanțe. Aceste valori sunt identice în unități de cal/(g⋅C) .3. cv la volum constant și la 20,0 ° C, cu excepția celor menționate, și la 1,00 atm presiune medie. Valorile din paranteze sunt cp la o presiune constantă de 1,00 atm.
Calorimetre
Calorimetria este măsurarea căldurii reacțiilor chimice sau a modificărilor fizice.
- Capacitate specifică de căldură
- Valurile de căldură ale furtunii perfecte și întreruperile de curent în cultura publică din Buenos Aires, Duke University Press
- Creșteți căldura cu hreanuri bune Decizii
- Caracteristici specifice bolii de reflux gastroesofagian asociate cu obezitatea și excesul de greutate - PubMed
- Condiții specifice CLTNW Site nou