Abstract
fundal
Supraalimentarea reduce performanța de ouat la găinile de reproducție pentru pui, care este asociată cu obezitatea, steatoza hepatică și inflamația sistemică. Pentru a dezlega mecanismele subiacente care guvernează efectul regimurilor de hrănire asupra metabolismului energetic și a producției de ouă, a fost efectuată o abordare transcriptomică pentru screeningul genelor exprimate diferențial (DEG) în țesuturile ovarelor, hepatice și adipoase ale puii broiler sub libere și hrănirea restricționată.
Rezultate
A arătat că 289, 388 și 204 DEG au fost identificate în adipos, ficat și respectiv ovar. Aceste DEG-uri s-au îmbogățit semnificativ în calea fagozomilor, transportul lipidelor, activitatea și activitatea rezervorului de nutrienți în ovar; biosinteza hormonului steroid și metabolismul xenobioticelor prin căile citocromului P450 în țesutul adipos; și căile metabolice, receptorul activat al proliferatorului peroxizomului (PPAR) și calea de semnalizare Jak-STAT în ficat. Receptorul de estrogen 1, identificat ca unul dintre hub-urile importante prin construirea unei rețele PPI, a fost reglat în grupul ad libitum, ceea ce ar face ca mai multe apolipoproteine să fie transferate în ovar.
Concluzii
Expresie înaltă a VTG-uri, APOB, CYBB și CTSS în ovar ar induce excesul de depozit lipidic, stresul oxidativ și deteriorarea potențială a ovulației. Rezultatele noastre contribuie la înțelegerea efectelor regimurilor de hrănire asupra reglării metabolice în timpul producției de ouă de găini de reproducție pentru pui și oferă, de asemenea, noi dovezi ale reglării metabolice din procesele integrate de mai multe țesuturi.
fundal
Scopul acestei cercetări a fost investigarea genelor și a reglementărilor acestora în ceea ce privește capacitatea de reproducere dependentă de nutriție a crescătorilor de pui de carne de la întregul nivel al transcriptomului. În acest studiu, profilurile de expresie ale țesutului ovar, hepatic și adipos au fost investigate între ad libitum și găini broiler cu hrană limitată utilizând tehnologia ARN-seq. Rezultatele descrise aici vor oferi un avans semnificativ în cunoștințele noastre despre relația dintre aportul de hrană, metabolismul lipidic și funcția ovariană la găinile broiler.
Rezultate
Profiluri de expresie genică
Am analizat sistematic datele secvențiale din 18 probe, care au inclus 3 țesuturi (adipos, hepatic și ovar) de la 6 găini (3 găini din grupul ad libitum și 3 găini din grupul de hrănire restricționată). În medie, 367,3 milioane de citiri brute au fost detectate în 6 probe din fiecare țesut. După filtrare, aproximativ 81% citiri curate în fiecare probă au fost mapate la genomul Gallus_gallus-5.0 și au fost utilizate pentru analiza ulterioară a expresiei genice. Au existat aproximativ 80% citiri în mod unic și 1% multiple aliniate la genom în fiecare probă (Tabelul 1). În medie, au fost detectate expresia a 12.382, 13.157 și 10.651 gene din țesuturile adipoase, ovare și hepatice, stabilind pragul pentru numărul de citiri al fiecărei gene peste 1 număr pe milion în fiecare probă, cel puțin un grup de tratament. Toate aceste gene exprimate au fost utilizate pentru analiza expresiei diferențiale.
Gene exprimate diferențial
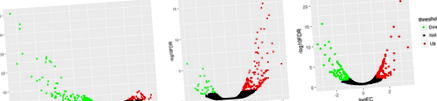
Genele de expresie diferențială au fost analizate între grupul de hrănire ad libitum și restrâns în 3 țesuturi (FDR Fig. 1
Ontologia genică și adnotarea funcțională a DEG-urilor
Pe baza adnotării DEGs, analiza îmbogățirii fiecărui țesut din termenii GO ai procesului biologic și calea KEGG au fost rezumate în Fig. 2 și fișierul suplimentar 4: Tabelul S4, setarea pragului la FDR Fig. 2
Analiza GO și ieșirea căii KEGG a DEG-urilor între ad libitum și grupul de alimentare restricționat. (a) ovar, (b) țesut adipos, (c) ficat. TA, Proces biologic; CC, componentă celulară; MF, funcție moleculară
Verificarea experimentului ARN-seq
Nivelul de ARNm de DEG obținut prin ARN-seq din ovar, ficat și țesuturi adipoase între grupurile ad libitum și furaje restricționate a fost examinat în continuare prin qRT-PCR. Figura 3 a arătat nivelurile de expresie a zece gene selectate aleatoriu din DEG. Pentru analiza ARN-seq, expresia lui CHGB, GAL, SST, APOB, SOST, CHAC1 și SIK1 au fost reglementate în jos în grupul ad libitum de câte o jumătate până la trei ori și expresia lui ANGPTL4, RRM2 și ACTC1 au fost reglate în sus în grupul ad libitum de două până la patru ori (Fig. 3a). Rezultatele qRT-PCR au arătat că expresiile acestor gene au fost în concordanță cu rezultatele analizei ARN-Seq și s-a găsit o corelație ridicată prin compararea rezultatelor a două metode (Fig. 3b). Prin urmare, datele qRT-PCR au verificat că rezultatele din ARN-Seq au fost fiabile.
Analiza de comparație și corelație a genelor exprimate diferențial între qRT-PCR și ARN-seq. (a) Compararea nivelului de gene exprimate diferențial din qRT-PCR și ARN-seq. (b) Corelația genelor exprimate diferențial între qRT-PCR și ARN-seq. CHGB, cromogranina B; APOB, apolipoproteina B; SOST, sclerostin; FATĂ, galanină și GMAP; SST, somatostatină; ACTC1, actină, alfa, mușchiul cardiac 1; CHAC1, Gamma-glutamilciclotransferaza 1 specifică pentru glutation ChaC; SIK1, kinaza 1 inductibilă a sării; ANGPTL4, angiopoietină ca 4; RRM2, subunitatea de reglare ribonucleotid reductază M2. Expresia genică a fost normalizată ca schimbare a pliurilor folosind ARN ribozomal 18S (n = 3 pe grup)
Rețea de interacțiune proteină/proteină a DEG-urilor
Software-ul Cytoscape a fost folosit pentru a vizualiza rețelele PPI ale DEG-urilor (Fig. 4). Este compus din 123 noduri și 159 margini în adipos, 172 noduri și 373 margini în ficat și 100 noduri și 153 margini în ovar. În figură, nodul reprezintă DEG, iar muchia reprezintă PPI a două DEG. Au fost 2 (lanțul beta fibrinogen (FGB), albumina (ALB)) și 3 gene (ALB, Proto-oncogene Spi-1 (SPI1), plasminogen (PLG)) identificate ca gene hub în adipos și ovar cu un grad de interacțiune ≥10, respectiv, și 24 gene hub în ficat.
Rețea PPI pentru DEG-uri în țesuturile adipoase, ovare și hepatice. (a) adipos; (b) ovar; (c) Ficat. În rețea, diferența de grad de interacțiune este arătată de culoare. Punctul galben indică faptul că nodul are un grad de interacțiune ≥10 considerat ca gene hub. Punctul negru indică faptul că nodul este gena expresiei diferențiale. PPI, interacțiune proteină/proteină; DEG-uri, gene exprimate diferențial
Discuţie
Hrănirea restricționată a crescătorilor de pui a fost utilizată pe scară largă pentru a îmbunătăți creșterea excesivă în greutate corporală și eficiența mai mică a producției de ouă [5,6,7,8]. Conform raportării anterioare, găina crescătoare de broiler pentru hrănire fără restricții în perioada de ouat accelerează maturarea foliculară ovariană, care perturbă performanța reproductivă sau măresc ouăle care nu pot fi stabilite [1, 16, 26]. S-a sugerat că motivul alimentării nerestricționate care afectează producția de ouă a găinilor crescătoare de pui a fost în principal aportul excesiv, ducând la aportul excesiv de energie [10, 27, 28]. În ciuda cerințelor sale ridicate de energie, în special formarea gălbenușului, în funcție de metabolismul lipidelor, găinile crescătoare de pui sunt o toleranță biologică redusă la supraalimentare [19]. Astfel, este demn de investigat mecanismele moleculare care stau la baza care guvernează metabolismul lipidelor asupra producției de ouă, în special despre efectul stării nutriționale [16].
În țesutul adipos, analiza STRING a arătat că DEG-urile s-au îmbogățit cel mai mult pe căile „biosintezei hormonilor steroizi” și „metabolismului xenobioticelor prin citocromul P450” și funcția moleculară a activității rezervorului de nutrienți (Fișa suplimentară 4: Tabelul S4). Țesutul adipos este una dintre glandele endocrine majore și este considerat a fi unul dintre principalele locuri de sinteză extra-gonadică a estrogenului [43,44,45]. Am constatat că DEG-urile din aceste două căi erau în principal reglementate în jos (fișier suplimentar 2: Tabelul S2) în grupul ad libitum comparativ cu grupul cu hrănire restricționată. Rolul semnalelor hormonale și metabolice din țesutul adipos trebuie studiat mai departe în legătură cu funcția reproductivă la păsările de curte.
Analiza STRING în ficat a arătat că DEG-urile s-au îmbogățit în principal la 9 căi KEGG, așa cum știm cu toții căile metabolice, au fost implicate căile de semnalizare Jak-STAT și căile de semnalizare PPAR (Fișier suplimentar 4: Tabel S4). Mai mult, prin construirea unei rețele PPI pentru DEG-uri din hrană ad libitum vs hrănire restricționată, s-au găsit 24 de gene hub-uri (Fig. 4). Dintre acestea, receptorul de estrogen 1 (ESR1 sau ER-α) a fost implicat în căi metabolice. Ficatul este unul dintre organele responsabile în principal de estrogeni, iar expresia receptorilor de estrogen hepatic (ER) este strict reglementată de funcțiile de reproducere și de homeostazia energetică [46,47,48]. În ficat, sinteza proteinelor din gălbenușul de ou este foarte dependentă de estrogen și mediată de ER [49]. Apolipoproteinele sintetizate pot fi transferate prin sânge către ovocitele în curs de dezvoltare [50]. În studiul nostru, nivelurile de ARNm de ESR1 au fost supra-reglementate în grupul ad libitum în comparație cu grupul de hrănire restricționat, care poate crește sinteza precursorilor de proteine, cum ar fi VTG II și APOV1, astfel încât maturarea foliculară accelerată a ovarelor și să conducă la perturbarea performanței reproductive sau la creșterea ouălor care nu pot fi stabilite.
Concluzie
Depozitul de gălbenuș de ou se referă la sinteza, absorbția, transportul și metabolismul lipidelor din procesele multi-țesuturilor integrate. Ad libitum va induce excesul de depozit de gălbenuș de ou și producerea de ouă defecte sau nedezolvabile la găinile de reproducție pentru pui. În acest studiu, am identificat DEG-uri cheie, principalul proces de biologie și reglarea căii prin compararea ad libitum cu hrănirea restricționată. Niveluri ridicate de ESR1 ARNm în ficat va face ca mai multe apolipoproteine să fie transferate în ovar. Expresie înaltă a VTG-uri, APOB, CYBB și CTSS în ovar va induce excesul de depozit lipidic, stresul oxidativ și potențialele daune ale ovulației. Toate aceste rezultate pot dezvălui mecanismul molecular al producției scăzute de ouă a găinilor crescătoare de pui la ad libitum. Cu toate acestea, ar trebui investigate studii suplimentare cu privire la rolul semnalelor hormonale și metabolice ale țesutului adipos în legătură cu funcția reproductivă la găinile de reproducție pentru pui.
Metode
Managementul animalelor și pregătirea țesuturilor
O turmă de pui crescători de pui Arbor Acres (AA) au fost crescuți în conformitate cu specificațiile AA Breider Management Guide pentru a atinge greutatea țintă până la 21 săptămâni. de vârstă (http://ap.aviagen.com/brands/arbor-acres/). De la 22 săpt. în vârstă, patruzeci de pui au fost împărțiți în două grupuri și transferați în cuști individuale de ouat. Un grup a fost hrănit ad libitum cu rația 11,74 MJ/kg de energie metabolizabilă și 17 g proteină brută/100 g furaj (grupa ad libitum), iar celălalt grup a fost hrănit continuu cu ghidul de mai sus (grup restricționat). Accesul la apă nu era restricționat în perioada de creștere. Găinile au fost hrănite cu un program de iluminat conform recomandărilor companiei de crescători. În perioada de așezare, programul de iluminare a fost de 14 h lumină: 10 h întuneric. Până la 30 săpt. la vârstă, 3 găini selectate aleatoriu din fiecare grup au fost anesteziate cu izofluran înainte de necropsie. La necropsie au fost colectate țesuturi hepatice, grase abdominale și stromale ovariene, inclusiv foliculi mici. Probele de țesut au fost congelate imediat în azot lichid și depozitate la - 80 ° C pentru transcriptom mai departe și analize qRT-PCR.
Extracția ARN-ului
ARN-ul total a fost extras din 18 probe (incluzând adipos, ficat și ovar, 6 indivizi din fiecare țesut) prin reactiv TRIzol LS (Invitrogen, SUA). Puritatea și concentrația ARN au fost evaluate cu spectrofotometrul NanoPhotometer® (IMPLEN, CA, SUA) și Qubit® RNA Assay Kit în Qubi t® 2.0 Flurometer (Life Technologies, CA, SUA). Integritatea ARN-ului a fost verificată folosind kitul de testare ARN Nano 6000 al sistemului Bioanalyzer 2100 (Agilent Technologies, CA, SUA) și toate numărul de integritate ARN au fost mai mari de 9,0.
Pregătirea bibliotecii și secvențierea transcriptomului
Bibliotecile ADNc au fost construite folosind NEBNext® Ultra ™ RNA Library Prep Kit pentru Illumina® (NEB, SUA). Sistemul Agilent Bioanalyzer 2100 a fost utilizat pentru a măsura calitatea bibliotecilor din 18 probe. O platformă Illumina® HiSeq 2500 la Novogene Bioinformatics Technology Co. Ltd. (Beijing, China) a fost utilizată pentru a secvența toate bibliotecile, iar lungimea de citire a capătului asociat este de 125 bp.
Citește controlul calității, alinierea și adnotarea
Am folosit FastQC (versiunea 0.11.5) pentru a efectua controlul calificat al citirilor brute [51]. Am eliminat adaptoarele și citirile de calitate scăzută. După filtrare, citirile au fost mapate la genomul de referință Gallus_gallus-5.0 folosind TopHat v2.1.1. [52] încorporează algoritmul bowtie v2.0.6 [53]. Ulterior, analizele au fost efectuate în cadrul R (versiunea 3.4.0) folosind pachetele GenomicFeatures [54] pentru calculul suprapunerilor și GenomicAlignments [54] pentru numărarea citirilor scurte mapate în regiunile genomice pe Gallus gallus fișierul genom GTF.
Identificarea genei de expresie diferențială
Genele exprimate diferențial (DEG) au fost analizate utilizând marginea pachetului R R [55]. Pentru normalizare a fost utilizată media redusă a valorii M (TMM), iar modelul liniar generalizat (binom negativ) a fost utilizat pentru ajustarea modelului. Gene cu rata de descoperire falsă (FDR) Ⓡ Premix Ex Taq ™ II (Tli RNaseH Plus, Takara, Japonia) a fost utilizată pentru a determina expresia a 10 mARN. Reacția qRT-PCR a fost efectuată în sistemul de PCR în timp real ABI 7300 (Applied Biosystems, Foster City, CA). Secvențele de exemplu (TSINGKE Biotech, China) sunt furnizate în fișierul suplimentar 1: Tabelul S1. Volumul mixt total PCR de 15 μl din fiecare godeu conținea 7,5 μl SYBR1 Fast qPCRMix (Takara, Japonia), fiecare primer înainte și invers 0,8 μl (10 μmol/L), 0,3 μl ROX Reference Dye, 1 μl șablon ADNc și restul a fost H2O fără RNază. Reacția PCR a fost efectuată după cum urmează: 30 s la 95 ° C, urmată de câte 40 de cicluri fiecare timp de 5 s la 95 ° C și temperatura de recoacere a fiecărui primer timp de 34 s și 30 s la 72 ° C. Metoda 2 −ΔΔCT a fost utilizată pentru a calcula expresia genei țintă și 18S a fost folosit ca control intern.
Analiza rețelei de interacțiune proteină/proteină a DEG-urilor
Baza de date STRING a fost realizată pentru a analiza rețeaua de interacțiune proteină/proteină (PPI) a DEG-urilor. Cel puțin o conexiune cu o proteină și un scor mediu de încredere (≥0,4) au fost stabilite ca criterii de limită. Rețelele din ficat, adipos sau ovar au fost construite conform interacțiunii cunoscute la pui prin lista genelor extrase din baza de date. Software-ul Cytoscape (versiunea 3.4.0) [57] a fost folosit pentru a vizualiza rețelele PPI. Gradul pentru fiecare genă a fost calculat prin analiza structurii topologice a rețelei PPI. Gena cu gradul ≥10 a fost considerată ca gene hub din rețea.
- Identificarea genelor și căilor cheie asociate cu obezitatea la copii
- Lipidele materne în timpul sarcinii sunt asociate cu o reactivitate crescută a cortizolului descendent în
- Microbiota colonică umană asociată cu dieta, obezitatea și pierderea în greutate - PubMed
- Probleme de sănătate asociate cu obezitatea adulților HealthLink BC
- Hiperfosfaturie asociată cu hipercalciuria la pacienții cu piatră de calciu renală - Rezumat -