Shinsuke Ishigaki
1 Departamentul de Neurologie, Școala de Medicină a Universității din Nagoya, Nagoya, Japonia
2 Departamentul de Terapie pentru Tulburări Neurologice Intractabile, Școala de Medicină a Universității Nagoya, Nagoya, Japonia
Gen Sobue
3 Centrul de cercetare a creierului și minții, Universitatea Nagoya, Nagoya, Japonia
4 Divizia de cercetare a demenței și a bolilor neurodegenerative, Universitatea Nagoya Școala de Medicină, Nagoya, Japonia
Abstract
Introducere
Scleroza laterală amiotrofică (SLA), caracterizată prin pierderea neuronală motoră selectivă în sistemul nervos central și degenerescența lobară frontotemporală (FTLD), care se distinge prin modificări de caracter, comportamente anormale, tulburări de limbaj și demență progresivă, au fost recent recunoscute ca două capete ale spectrului unei boli (Robberecht și Philips, 2013). Această noțiune este susținută de determinanții genetici care stau la baza FTLD/ALS familială (Renton și colab., 2014) și de liniile de dovezi care arată o continuitate patologică între ALS și FTLD (Riku și colab., 2014). Proteinele de legare a ARN (RBP), cum ar fi răspunsul tranzactiv (TAR), proteina de legare a ADN-ului 43 (TDP-43) și fuzionate în sarcom (FUS), leagă genetic și patologic cele două boli neurodegenerative de o singură stare de boală (Van Langenhove și colab.)., 2012). Aceste gene sunt cauzale pentru SLA și FTLD familiale și sunt semnele patologice ale FTLD/ALS atât familiale cât și sporadice în care sunt observate incluziuni TDP-43 sau FUS-pozitive (Kwiatkowski și colab., 2009; Lagier-Tourenne și Cleveland, 2009; Vance și colab., 2009; Mackenzie și colab., 2011; Strong și Volkening, 2011). În plus, FTLD a fost, de asemenea, clasificat ca o tauopatie caracterizată printr-o acumulare de proteine tau fosforilate asociate cu microtubuli (Tau) în neuronii afectați (Seelaar și colab., 2011).
Această revizuire oferă o imagine de ansamblu a descoperirilor recente care relevă efectele pierderii funcționale a FUS asupra patogeniei FTLD/ALS. În primul rând, pierderea FUS în nucleu duce la izoforme Tau dezechilibrate din cauza omiterii insuficiente a exonului 10 în gena MAPT. În al doilea rând, pierderea FUS în citoplasmă determină o stabilitate scăzută în ARNm GluA1 și SynGAPα2 rezultând o maturare aberantă a coloanelor dendritice. În plus, rezumăm rolurile FUS în întreținerea neuritei și transportul axonal și oferim o scurtă privire de ansamblu asupra tranziției fazei lichide FUS, care poate modifica diversele sale funcții fiziologice și poate contribui la dezvoltarea efectelor celulare toxice în condiții patologice. Astfel, proprietățile funcționale ale FUS pot influența mai multe procese celulare ale neuronilor și/sau celulelor gliale a căror disfuncție ar putea fi cea mai plauzibilă explicație pentru toxicitatea neuronală mediată de pierderea FUS.
Pierderea cantitativă și calitativă a funcției FUS
Deși rapoartele recente au sugerat că pierderea funcției FUS în neuronii motori ar putea să nu contribuie la degenerarea neuronilor motorii în SLA (Scekic-Zahirovic și colab., 2016; Sharma și colab., 2016), liniile de dovezi sugerează că pierderea- funcția FUS în neuronii cerebrali poate contribui la disfuncția neuronală și neurodegenerare în FTLD. Șoarecii cu deficiență de FUS generați fie prin tăcere, fie prin eliminarea FUS prezintă deficiențe de comportament (Kino și colab., 2015; Udagawa și colab., 2015). Cu toate acestea, recuperarea FUS de tip sălbatic la șoarecii tăcuți cu FUS a salvat fenotipurile comportamentale, în timp ce un mutant asociat bolii nu (Ishigaki și colab., 2017).
Deși patologia FUS este detectată atât în cazurile de SLA, cât și în cele de FTLD, majoritatea mutațiilor cauzatoare de boală în cadrul FUS sunt asociate cu cazuri de SLA. Cu toate acestea, s-a dovedit că un subset de cazuri SLA familiale și sporadice care implică mutații genice FUS au disfuncție cognitivă sau întârziere mintală (Bäumer și colab., 2010; Huang și colab., 2010; Yan și colab., 2010; Belzil și colab., 2012; Yamashita și colab., 2012). Mai mult, s-a observat un spectru de deficiențe cognitive într-o subpopulație considerabilă de pacienți cu SLA (Swinnen și Robberecht, 2014). Luate împreună, datele clinice și rezultatele modelului șoarecilor tăiați cu FUS susțin ipoteza că disfuncția FUS are ca rezultat tulburări cognitive timpurii.
Luate împreună, aceste constatări indică faptul că atât pierderile cantitative cât și calitative ale funcției FUS sunt implicate probabil în patogeneza FTLD/ALS și ar trebui să ofere indicii pentru terapii care clarifică proprietățile funcționale ale FUS.
Funcția FUS în nucleu: reglarea splicingului alternativ și a transcrierii
Deoarece FUS joacă un rol în mai multe aspecte ale metabolismului ARN, deteriorarea transcriptomului ar putea fi cea mai plauzibilă explicație pentru toxicitatea neuronală mediată de pierderea FUS. În sprijinul acestui fapt, au fost identificate numeroase molecule asociate funcției neuronale în profilele transcriptomului reglementate de FUS (Ishigaki și colab., 2012; Lagier-Tourenne și colab., 2012; Rogelj și colab., 2012; Fujioka și colab., 2013; Honda și colab., 2013; Nakaya și colab., 2013). Modificarea expresiei genelor și/sau îmbinarea alternativă a acestor gene poate avea un impact mare asupra funcției neuronale care contribuie la neurodegenerarea observată în FTLD/ALS. Speculăm că întreruperile funcționalității FUS ar putea duce la un efect parțial mai degrabă decât la daune fatale prin modificarea izoformelor sau a nivelurilor de expresie ale acestor gene. Astfel, este posibil ca neurodegenerarea să rezulte numai după ce întreruperea transcripțională declanșată de pierderea funcționalității FUS atinge un prag critic, astfel încât expresia genelor individuale și evenimentele de îmbinare alternative să nu fie critice de la sine.
Țintele suplimentare ale saltării exonului mediată de FUS ar putea contribui, de asemenea, la patogeneza FTLD/ALS. Printre aceste gene se află însăși FUS în care îmbinarea mediată de FUS la exonul 7 contribuie la autoreglarea expresiei cu varianta sărită a exonului 7 care suferă o degradare mediată fără sens (NMD). Funcția de reglare automată este deficitară în mutanții FUS asociați cu SLA (Zhou și colab., 2013).
Alte gene reglementate de FUS, cum ar fi NTNG1 sau BRAF, care ar putea fi importante pentru supraviețuirea celulelor neuronale, au fost identificate în mai multe rapoarte (Orozco și Edbauer, 2013). Sunt necesare studii suplimentare pentru a evalua semnificația acestora în patogeneza FTLD/ALS.
Funcția FUS în coloana vertebrală dendritică: stabilizarea ARNm
În timp ce FUS este îmbogățit în nucleu, un procent din proteină este localizat la soma și procesele neuronale (Fujii și Takumi, 2005; Aoki și colab., 2012; Yasuda și colab., 2013). Mai mult, în dendrite multe proteine de legare a ARN-ului, inclusiv FUS, sunt implicate în mecanismele de traducere locale pentru a regla funcția sinaptică și morfologia (Fujii și Takumi, 2005; Qiu și colab., 2014; Sephton și colab., 2014). Legarea FUS la 3'UTR a mARN-urilor țintă este un factor determinant important al eficienței translaționale și al stabilității ARNm (Colombrita și colab., 2012; Lagier-Tourenne și colab., 2012; Rogelj și colab., 2012). Astfel, aceste descoperiri sugerează că funcția citoplasmatică a FUS poate fi implicată în reglarea stabilității, traducerii și transportului ARNm.
Masuda și colab. a raportat că FUS participă la mecanismul alternativ de poliadenilare cu ARN născut care leagă FUS și interacționează cu complexele CPSF și CSTF (Masuda și colab., 2015). În plus, am arătat că FUS reglează stabilitatea ARNm GluA1 în cooperare cu CPSF6, PAN2 și PABP, în timp ce controlează și stabilitatea ARNm a SynGAPα2, o izoformă a SynGAP1, cu proteine ELAVL într-o manieră dependentă de lungimea 3'UTR. Silențierea FUS a redus numărul spinelor dendritice mature atât in vitro, cât și in vivo. Recuperarea expresiei fie a GluA1, fie a izoformei SynGAPα2 la șoarecii deficienți în FUS ameliorează parțial comportamentele anormale și maturizarea afectată a coloanei dendritice cauzată de epuizarea FUS, sugerând că stabilitatea mRNA GluA1 mediată de FUS și controlul expresiei isoforme specifice SynGAPα2 este esențială pentru acestea. fenotipuri (Udagawa și colab., 2015; Yokoi și colab., 2017).
Aceste rezultate, luate împreună, sugerează că pierderea controlului regulator al stabilității ARNm a moleculei sinaptice ca răspuns la funcționalitatea FUS afectată determină disfuncție sinaptică și ar putea duce la afectări post-sinapse în FTLD/ALS.
Menținerea morfologiei neuronale de către FUS
Se știe că tulburările post-sinapsice în tulburările neurodegenerative, inclusiv FTLD/ALS, pot fi o schimbare patologică timpurie (Sephton și Yu, 2015; Herms și Dorostkar, 2016). De exemplu, defectarea proteinei Tau în compartimentul somatodendritic este recunoscută ca un eveniment patologic timpuriu în boala Alzheimer (AD) și alte tauopatii (Ballatore și colab., 2007; Hoover și colab., 2010). În mod similar, șoarecii transgenici FUS R521G au prezentat o reducere a arborilor dendritici și a coloanelor vertebrale mature (Sephton și colab., 2014), iar supraexprimarea FUS R521C a prezentat defecte dendritice și sinaptice însoțite de îmbinarea deteriorată a Bdnf (Qiu și colab., 2014).
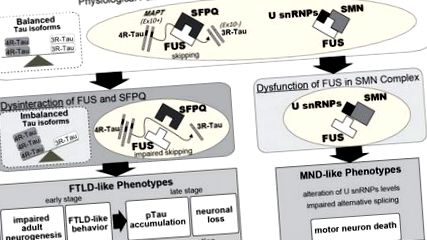
S-a demonstrat că lungimea neuritei este redusă în neuronii corticali primari tăiați cu FUS, dar poate fi recuperată prin supraexprimarea FUS de tip sălbatic, în timp ce mutanții asociați bolii nu au avut niciun efect (Ishigaki și colab., 2017). În mod similar, neuronii derivați de iPSC la pacienții cu SLA familială care adăpostesc mutații în FUS au prezentat nevriți mai scurți în comparație cu martorii (Ichiyanagi și colab., 2016). Mai mult, salvarea prin co-tacerea 4R-Tau a ameliorat efectele toxice ale silențierii FUS asupra lungimii neuritei (Ishigaki și colab., 2017). Astfel, disfuncția FUS induce morfologie neuronală anormală, care poate fi atribuită modificărilor izoformelor tau. Într-adevăr, 4R-Tau funcționează în suprimarea dinamicii microtubulilor prin stabilizarea interacțiunilor microtubulilor și supraexprimarea 4R-Tau a afectat lungimea neuritei într-o manieră dependentă de doză (Panda și colab., 2003; Ishigaki și colab., 2017). Astfel, anomaliile morfologice la neurite ar putea fi unul dintre primii biomarkeri și ar putea fi astfel folosiți în ecrane terapeutice sau ca instrument de diagnosticare.
Reglarea funcției axonale de către FUS
Unele studii au implicat FUS în reglarea funcției neuronale pre-sinaptice cu mutanți FUS asociați bolii care afectează rolul său de reglementare (Sasayama și colab., 2012; Armstrong și Drapeau, 2013; Schoen și colab., 2015). Errichelli și colab. a raportat că expresia circulară a ARN-ului, care este implicată în ghidarea axonilor, a fost afectată la neuronii motori ai șoarecilor FUS KO (Errichelli și colab., 2017). Au fost raportate defecte de transport axonal pentru mutațiile asociate ALS/FTLD ale FUS (Baldwin și colab., 2016; Chen și colab., 2016). Mai mult, Guo și colab. a constatat că transportul axonal a fost afectat de mutațiile asociate bolii ale FUS la neuronii motori umani derivați de iPSC (Guo și colab., 2017). Deoarece defectele de transport axonal apar la șoareci care poartă mutații în SOD1 care cauzează ALS și la Drosophila care poartă mutații în TDP-43 și C9orf72 (Williamson și Cleveland, 1999; Baldwin și colab., 2016), este necesară o investigație suplimentară pentru a clarifica patomecanismul în aval comun.
Tranziția în fază lichidă a FUS și a funcțiilor sale patologice și fiziologice
Studii recente au dezvăluit o nouă proprietate proteică a FUS, tranziții de fază lichid-lichid care duc la formarea diverselor organite fără membrană proteică. S-a demonstrat că FUS suferă o separare de fază lichid - lichid înainte de a se transforma în forma insolubilă a proteinei, proces care este promovat de mutații, fosforilare sau prezența ARN (Murakami și colab., 2015; Patel și colab., 2015; Chong și Forman-Kay, 2016; Monahan și colab., 2017). Similar cu hnRNPA2, domeniul de complexitate scăzută (LCD) din regiunea C-terminală a FUS este responsabil pentru separarea fazei lichid - lichid (Xiang și colab., 2015; Murray și colab., 2017). Alte proteine care leagă ARN, cum ar fi TDP-43, TIA1, TAF15 și proteinele repetate dipeptidice sintetizate din mutantul C9orf72 conțin, de asemenea, LCD-uri (Boeynaems și colab., 2017; Harrison și Shorter, 2017). Mai mult, s-a raportat că Tau suferă, de asemenea, o separare de fază lichid - lichid în soluție cu 4R-Tau mai predispus la formarea de picături lichide decât 3R-Tau (Ambadipudi și colab., 2017).
Aceste descoperiri sugerează puternic o legătură biochimică între proteinele care leagă ARN și alte proteine care se formează amiloid, inclusiv Tau și asocierea acestuia cu procesarea ARN în bolile neurodegenerative. Deoarece aceste constatări s-au bazat pe experimente in vitro, este necesară o investigație suplimentară pentru a clarifica dacă/cum tranzițiile de fază lichid-lichid sunt asociate cu funcția biologică și dacă tranzițiile care apar în citoplasma coloanelor vertebrale dendritice și/sau nucleul utilizează aceleași sau un proces molecular diferit.
Concluzii
Pierderea funcțională a FUS în nucleu și citoplasmă poate provoca disfuncții neuronale și degenerare. În nucleu, FUS reglează îmbinarea și transcrierea alternativă. De exemplu, exon 10 sărind de MAPT, care este reglementat de FUS în complex cu SFPQ, generează două izoforme de proteină Tau, 3R-Tau și 4R-Tau. FUS reglementează, de asemenea, transcrierea unui număr de gene, inclusiv Ntng1, Braf1 și Fus în sine. Pe de altă parte, FUS citoplasmatic stabilizează mARN-urile implicate în coloana dendritică, cum ar fi GluA1 și SynGAP. Luate împreună, deficiențele funcționale cauzate de deficiența FUS pot afecta funcția neuronală și morfologia și, ulterior, pot duce la comportamente aberante și neurodegenerare. În plus, FUS a fost implicat și în utilajul de transport al axonilor, care este afectat de mutațiile asociate bolii în FUS.
Contribuțiile autorului
SI: Concepție și proiectare, scriere de manuscrise, editare și proiectare de figuri. GS: Concepție și proiectare, scriere de manuscrise și editare.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricărei relații comerciale sau financiare care ar putea fi interpretată ca un potențial conflict de interese.
Mulțumiri
Această lucrare a fost susținută de Mext Grant - proiect în ajutor, Cercetare științifică în domeniul inovării (Îmbătrânirea proteinelor cerebrale și controlul demenței), de Mext Grant-in-Aid pentru cercetare științifică în domenii inovatoare (Rețea cuprinzătoare de știință a creierului), de Mext KAKENHI numărul de grant 15K09310 și de CREST de la JST.
Această lucrare a fost, de asemenea, susținută de cercetarea integrată privind tulburările neuropsihiatrice și cercetarea integrată privind proiectele depresiei, demenței și tulburărilor de dezvoltare desfășurate în cadrul Programului strategic de cercetare pentru științele și creierul creierului/MINDS al Agenției japoneze pentru cercetare și dezvoltare medicală.
- Pierderea în greutate medicală și gestionarea greutății Melbourne FL; Karine Romain APRN Functional Integrative
- Cum să slăbești ca acest inginer software în vârstă de 24 de ani, Weight Loss Inspirations GQ India
- Keto vs Macro Care este un plan de dietă macro superioară pentru pierderea rapidă în greutate • IIFYM • Calculați-vă macro-urile
- Keto Slabire Cvs Cele mai bune recenzii Pitt County Wildlife Club
- Acasă Sibley Pierdere în Greutate