Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Institutul pentru Biotehnologie Moleculară Jena, D-07708 Jena, Germania
Institutul pentru Biotehnologie Moleculară Jena, D-07708 Jena, Germania
Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Departamentul de Biologie Moleculară, Universitatea Vanderbilt, Nashville, TN 37235, SUA
Institutul Jacques Monod (CNRS, Universite Paris 6, Universite Paris 7), 75351 Paris Cedex 05, Franța
Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Autorul corespunzator. Fax: (7) (38) 3233 3677 Căutați mai multe lucrări ale acestui autor
Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Institutul pentru Biotehnologie Moleculară Jena, D-07708 Jena, Germania
Institutul pentru Biotehnologie Moleculară Jena, D-07708 Jena, Germania
Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Departamentul de Biologie Moleculară, Universitatea Vanderbilt, Nashville, TN 37235, SUA
Institutul Jacques Monod (CNRS, Universite Paris 6, Universite Paris 7), 75351 Paris Cedex 05, Franța
Institutul de Chimie Bioorganică, Divizia Siberiană a Academiei de Științe din Rusia, 630090 Novosibirsk, Rusia
Autorul corespunzator. Fax: (7) (38) 3233 3677 Căutați mai multe lucrări ale acestui autor
Abstract
Proteina de replicare umană A este o proteină heterotrimerică implicată în diferite procese de metabolizare a ADN-ului. Pentru a înțelege contribuția proteinei de replicare A subunități individuale la legarea ADN-ului, le-am exprimat separat ca proteine de fuziune a proteinelor solubile de legare a maltozei. Folosind o construcție de ADN care avea o grupă fotoreactivă încorporată la capătul 3 ′ - capătului de grund, arătăm că subunitatea p70 de la sine este legată în mod eficient de grund la concentrații fiziologice. În schimb, reticularea subunității p32 a necesitat două concentrații mai mari de proteine. În niciun caz subunitatea p14 nu a fost marcată deasupra fundalului. p70 pare a fi subunitatea predominantă pentru a lega ADN monocatenar și această interacțiune poziționează subunitatea p32 la capătul 3 ′ - primer.
1. Introducere
Deși pare clar că p70 se leagă predominant de regiunea ssDNA și contactele p32, dacă este deloc, exemplul terminal, nu se știe cum fiecare dintre subunitățile unice contribuie în sine la legarea ADN-ului. Aici, demonstrăm că este în principal subunitatea p70 care poate contacta ADN-ul pe cont propriu și că contactele p32 sunt disponibile numai în complex prin poziționarea de către subunitatea p70.
2. Materiale și metode
2.1 Materiale
ADN polimeraza β (pol β) recombinantă de mamifer a fost purificată așa cum este descris [4]. RPA a fost exprimat în Escherichia coli și purificat așa cum este subliniat [5, 6]. Markerii de masă moleculară a proteinelor colorate în curcubeu au fost de la Amersham, markerii precolorați din New England Biolabs și scara de 10 kDa de la Gibco BRL. Polinucleotid kinaza T4 a fost achiziționată de la New England Biolabs. [γ‐ 32 P] ATP a fost de la ICN. Oligonucleotidele sintetice au fost obținute de la GENSET. Nensorb −20 coloane provin de la Du Pont. NAB-4-dUTP a fost sintetizat conform lui Wlassoff și colab. [7]. Subunitățile RPA individuale au fost exprimate ca proteine de fuziune a proteinei de legare a maltozei (MBP) și izolate așa cum va fi descris în altă parte.
2.2 Teste de schimbare a benzii
Analize de deplasare de bandă conținute într-un amestec de 10 μl, 20 mM HEPES - KOH pH 7,8, 5 mM MgCl2, 1 mM DTT, 0,1 mM EDTA, 200 ng (corespunzător 0,083 pmol) ADN M13mp18 (Pharmacia) și cantitățile indicate de RPA sau Proteine de fuziune MBP subunitate RPA. După 30 de minute la 37 ° C, proba a fost suplimentată cu 2 μl tampon de încărcare (10 mM HEPES - KOH pH 7,5, 1 mM EDTA, 25% Ficoll 400, 0,1% albastru de bromofenol) și electroforezat într-un gel de agaroză 1% în TAE tampon (Tris-acetat 40 mM, EDTA 1 mM). Gelul a fost colorat cu 0,5 μg/ml bromură de etidiu și ADN-ul a fost vizualizat pe un transiluminator UV.
Testele de deplasare a benzii au fost, de asemenea, stabilite folosind oligonucleotide marcate cu 5 ′. În aceste cazuri, testul conținea 2 fmol (10.000 cpm) din oligonucleotida indicată în locul ssDNA M13mp18. După incubare, probele au fost separate pe geluri de poliacrilamidă 10% în TBE (Tris - borat 89 mM, acid boric 89 mM) la 160 V până când colorantul albastru de bromofenol a migrat pe jumătate în gel. Gelul a fost uscat și expus la pelicule cu raze X.
2.3 Marcarea radioactivă a primerilor oligonucleotidici
Primerii defosforilați au fost fosforilați la capătul 5 ′ cu polinucleotid kinază T4 așa cum este descris [8]. [Γ‐ 32 P] ATP nereacționat a fost îndepărtat prin trecerea amestecului peste o coloană Nensorb - 20 folosind protocolul sugerat de producător.
2.4 Exemplu - recoacere șablon
Primer - șabloanele au fost recoapte la un raport molar de 1: 1, mai întâi prin încălzirea amestecului la 90 ° C timp de 1 min, care a fost apoi lăsat să se răcească încet la temperatura camerei. Secvențele exemplului și șablonului utilizate au fost următoarele: 5 ′ - GGTTCGATATCGTAGTTCTAGTGTATAGCCCCTACC - 3 ′, 3 ′ - CACATATCGGGGATGG - 5 ′
2.5 Exemplu de alungire în prezența analogilor dNTP fotoreactivi
Condițiile pentru alungirea oligonucleotidelor de către analogii fotoreactivi ai dNTP au fost identice cu cele utilizate pentru fotocrosslinking. Sinteza ADN-ului a fost inițiată prin adăugarea de polimerază și efectuată timp de 30 de minute la 25 ° C. Reacția a fost încheiată prin adăugarea a 10 pl de 90% formamidă, 50 mM EDTA și 0,1% albastru de bromofenol. Amestecul a fost încălzit timp de 3 minute la 80 ° C și produsele au fost analizate prin electroforeză urmată de autoradiografie.
2.6 Reticulare fotochimică
RPA și subunitățile sale individuale au fost marcate cu un primer fotoreactiv sintetizat in situ folosind NAB-4-dUTP într-o reacție de alungire a primerului catalizată de pol β. Amestecurile de reacție (10 μl) conțin următoarele componente standard: 50 mM Tris - HCI, pH 7,8, 10 mM MgCl2, 50 mM KCl, 2 μM pol β, 0,8 μM șablon - 5 ′ - [32 P] primer și 10 μM NAB ‐4 - dUTP. Concentrațiile RPA sau ale subunităților RPA individuale au fost cele indicate. Amestecurile de reacție au fost incubate la 25 ° C timp de 30 de minute pentru a permite alungirea primerului. Apoi, amestecurile au fost observate pe parafilm care a fost plasat pe gheață și UV - iradiat timp de 20 de minute cu un monocromator Baush și Lomb echipat cu o lampă de mercur cu presiune superioară HBO W producând lumină UV de 315 nm. Reacțiile au fost oprite prin adăugarea de tampon Laemmli și încălzire. Probele proteice-ADN reticulate fotochimic au fost separate prin electroforeză pe gel de dodecil sulfat-poliacrilamidă (SDS-PAGE) [9] și analizate prin autoradiografie sau cu un Phosphorimager.
3. Rezultate
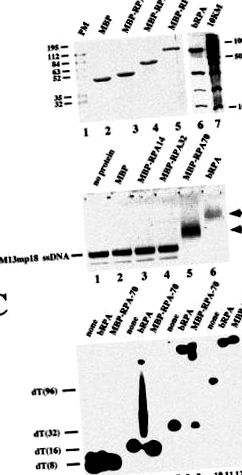
Pentru a dezlega rolurile subunităților individuale în timpul legării ADN-ului, ne-am propus să le exprimăm separat și să le folosim în experimente de reticulare scoase din contextul complexului heterotrimeric. S-a raportat mai devreme că încercările de exprimare a subunităților RPA în mod individual într-o formă solubilă nu au avut succes [10]. Pentru a crește solubilitatea subunităților, le-am exprimat ca proteine de fuziune MBP (Fig. 1A). Am putut exprima toate proteinele de fuziune într-o formă solubilă. Părțile de fuziune ale acestor proteine își pot schimba proprietățile biologice. Într-adevăr, subunitățile RPA de fuziune nu se pot asocia în structura heterotrimerului, dar sugerăm că acestea păstrează activitatea de legare a ADN-ului. Trebuie remarcat faptul că masa moleculară a fiecărei proteine de fuziune MBP crește la 48 kDa în comparație cu cea naturală.
În experimentele de schimbare a benzii, am detectat activitatea de legare a ADN-ului pentru a fi asociată cu subunitatea p70 condensată, dar nu și cu celelalte două subunități (Fig. 1B). Proteina MBP-RPA70 părea să interacționeze mai puțin bine cu ADNs de lungime mai mică decât proteina heterotrimerică (Fig. 1C). Așa cum era de așteptat, nici una dintre proteine nu a interacționat cu o oligonucleotidă 8-mer (benzile 2 și 3). Astfel de complexe au fost raportate în cazul heterotrimerului ca fiind instabile și detectabile numai în testele de deplasare a benzii după reticulare [11]. Cu toate acestea, în timp ce RPA a reușit să se lege de un 16-mer destul de stabil, proteina de fuziune p70 nu a fost (comparați benzile 5 și 6). Frotiul de sub banda deplasată în banda 5 trebuie să fie datorat moleculelor de ADN care au pierdut RPA în timpul electroforezei datorită legării instabile a RPA. În plus, legarea la un 32-mer părea a fi mai puțin stabilă în cazul proteinei de fuziune p70 (comparați benzile 8 și 9). În timp ce se detectează o singură bandă deplasată cu heterotrimerul, un frotiu este vizibil pentru proteina de fuziune. Doar cu un 96-mer legarea părea a fi la fel de eficientă pentru ambele proteine (comparați benzile 11 și 12).
După caracterizarea proprietăților de legare a ADN-ului proteinelor de fuziune MBP, le-am folosit în experimentele de reticulare. În acest studiu a fost utilizat un derivat arylazido substituit pe bază de dUTP, denumit NAB-4-dUTP (Fig. 2). Acest analog nu este doar un substrat eficient al pol β [2], dar, în plus, permite efectuarea iradierii UV cu lumină la lungimi de undă mai mari de 310 nm, ceea ce depășește cu mult absorbția maximă a acizilor nucleici și a proteinelor. Am elaborat condiții care ne-au permis să introducem un singur dNMP fotoreactiv în capătul 3 ’- al unui primer marcat cu 5’‐ 32 P folosind o reacție de alungire a primerului catalizată de pol β [12]. FIG. 3 arată clar că exemplul inițial (banda 1) este consumat în reacție și numai produsul final este obținut atât în prezența TTP (banda 2), cât și a NAB - 4 - dUTP (banda 3). Mobilitatea scăzută a exemplului alungit văzut cu analogul (comparați benzile 2 și 3) este o consecință a volumului grupului fotoreactiv al NAB - 4 - dUTP [13] .
Am arătat anterior că subunitățile p70 și p32 ale RPA pot fi reticulate cu oligonucleotide fotoreactive sintetizate in situ de ADN polimeraze cu NAB-4-dUTP ca substrat. Când s-au aplicat duplexuri ADN parțiale cu cozi de șablon extinse, o etichetare mai intensă a p32 a avut loc peste p70, în timp ce contrariul era adevărat dacă coada șablonului era scurtă [2, 12]. În schimb, în nici o condiție, s-a observat o reticulare remarcabilă a subunității p14. S-a emis ipoteza că subunitatea p70 interacționează cu coada monocatenară a șablonului ADN și poziționează subunitatea p32 aproape sau departe de capătul 3 ′ al primerului în funcție de dimensiunea extensiei monocatenare utilizată. Subunitatea p14 este localizată relativ departe de capătul 3 ′ - al exemplului, indiferent de ce tip de șablon este utilizat [2] .
Pentru experimentele de reticulare, am ales concentrații relevante din punct de vedere fiziologic (0,4 μM) ale subunităților RPA individuale și ale heterotrimerului RPA [1] (Fig. 4). Proteina de fuziune a subunității p70 a fost legată încrucișat de primerul marcat fotoreactiv 5'‐ 32 P (banda 2). Creșterea concentrației de proteine a condus la cantități mai mari de produs reticulat (comparați banda 2 cu banda 7). În schimb, adăugarea fie a aceleiași cantități de fuziune p32, fuziunea p14 sau MBP singură nu a dus la reticularea lor (benzile 3, 4 și 5). Rețineți că fiecare proteină legată covalent de exemplu rulează cu o masă moleculară care este cu 6-8 kDa mai mare decât cea pentru proteina nemodificată în timpul SDS-PAGE și fiecare subunitate de fuziune MBP-RPA are o masă moleculară aparentă de 48 kDa mai mare decât cea a cel nativ. Când polipeptidele p70, p32 și p14 au fost adăugate împreună, a fost din nou doar proteina de fuziune p70 care a fost reticulată. Eficiența reticulării a fost în aceeași măsură ca cea observată numai cu această subunitate (comparați banda 6 la 2). Vrem să subliniem că subunitățile nu se asociază între ele dacă sunt combinate individual (datele nu sunt prezentate). Într-adevăr, s-a constatat mai devreme că subunitățile trebuie coexprimate pentru a construi complexul heterotrimeric [10, 14] .
Dacă am crește concentrațiile de proteine pentru subunitățile p32 în intervalul a două ordine de mărimi, adică la 50 μM, am observat reticularea specifică a acestei subunități într-o măsură care a depășit în mod clar reticularea MBP care a servit drept control negativ (comparați benzile 8 și 10). În schimb, nu a fost detectată nicio marcare deasupra fundalului proteinei de fuziune p14 (comparați benzile 9 și 10). Dacă toate cele trei subunități au fost prezente la concentrații mari, a avut loc o marcare slabă atât cu proteinele de fuziune p70, cât și cu cele de p32. Din nou, nu s-a observat nicio reticulare cu proteina de fuziune p14 (banda 11). Rețineți că ambele subunități se încrucișează mai puțin bine decât se observă cu subunitățile individuale (comparați benzile 7 și 8 cu banda 11) sau în cazul p70 dacă toate cele trei proteine de fuziune erau prezente în cantități mai mici (comparați benzile 5 și 11). Acest lucru se datorează probabil unei competiții între p70 și p32 pentru aceleași site-uri de legare sau suprapuse.
Un model total de reticulare diferit a fost dezvăluit dacă complexul heterotrimeric este utilizat în studiile de reticulare (banda 1). Aici, ambele subunități p70 și p32 au fost încrucișate eficient, cu toate acestea, cu o preferință clară pentru această din urmă subunitate. Eficiența reticulării a depășit în mod clar cele observate la subunitățile individuale. Acest lucru este, de asemenea, revelat de o competiție mai eficientă a pol β de către heterotrimer comparativ cu cele observate la subunitățile unice (comparați banda 1 cu benzile 7 și 8).
4. Discutie
Interacțiunea RPA cu ADNs a fost studiată intens folosind diverse tehnici, inclusiv cristalografia cu raze X [1]. S-a arătat că RPA ar putea adopta diferite configurații, în funcție de lungimea disponibilă a ssDNA. Cu toate acestea, una dintre întrebările importante referitoare la funcția RPA rămâne încă de investigat, adică modul în care interacționează cu structura ADN care operează la furca de replicare. În acest sens, este important să dezlegăm modul de legare a RPA cu ADN în timpul sintezei ADN-ului naștent și să determinăm relația dintre RPA și ADN polimeraze în jurul capătului 3 '- capătul exemplului în creștere.
Un pas înainte în această direcție a fost utilizarea tehnicilor de reticulare [2, 3]. Un model al modului de legare RPA la un duplex ADN cu un șablon șablon extins peste capătul 3 ′ a fost sugerat de noi mai devreme pe baza datelor de reticulare [2]. În acest model, subunitatea p70 este responsabilă de legarea la regiunea monocatenară și de poziționarea subunității p32 în raport cu capătul primerului. Orientarea subunității p32 către capătul 3 ′ - al exemplului este puternic dependentă de conformația RPA care la rândul său este modulată de lungimea extensiei șablonului [12]. În acest raport, am dorit să investigăm proprietățile de legare a ADN-urilor subunităților unice pentru a testa ipoteza că subunitatea p70 este cea care face contactele cruciale cu ADN-ul și că prin modul său de legare poziționează celelalte subunități. Într-adevăr, datele experimentale obținute anterior susțin că subunitatea p70 este responsabilă în primul rând de legarea la ADNs [1] .
Utilizând proteine de fuziune MBP solubile ale subunităților RPA individuale, arătăm aici că este predominant subunitatea p70 care interacționează singură cu ssDNA, deși afinitatea proteinei de fuziune p70 pentru SSDNA mai scurte părea să fie mai mică în comparație cu proteina trimerică (Fig. 1). Ar putea fi influența părții de fuziune a MBP - RPA70. În plus, demonstrăm că p70 singur sau necomplexat cu celelalte două subunități RPA pot interacționa cu o coadă șablon extinsă a unui duplex ADN la concentrații de proteine relevante fiziologic (0,1-1 μM) [15], astfel cum a fost dezvăluit prin reticularea p70 la dNMP fotoreactiv. porțiune introdusă în capătul 3 ′ al exemplului (Fig. 4).
Reticularea subunității p32 la primerul fotoreactiv a fost detectată numai la concentrații foarte mari de proteine (50 μM) care ar putea fi consecința legării ADN-ului p32 prin domeniul său de legare a ADN-ului [16, 17]. Nu putem exclude în mod concludent faptul că reticularea p32 observată reflectă doar interacțiuni nespecifice cu ADN-ul. Dar credem că este mai puțin probabil decât o legătură specifică. În primul rând, etichetarea a fost peste nivelurile de fond și, în al doilea rând, p32 ar putea concura cu p70 dacă este utilizat la concentrații mai mari. Rapoartele anterioare au arătat că această activitate de legare a ADN-ului este dezvăluită numai dacă p32 este într-un complex cu celelalte două subunități sau dacă este trunchiată [18, 19]. Astfel, se pare că activitatea de legare a ADN-ului subunității p32 este greu accesibilă în subunitatea unică și devine disponibilă în proteina trimerică numai după ce p70 este legat de ADN.
Nu am obținut nicio reticulare peste nivelurile de fond pentru proteina de fuziune p14, chiar și atunci când am folosit concentrații crescute ale proteinei. Concluzionăm că subunitatea p14 nu este implicată într-o interacțiune directă cu ADN și speculăm că rolul său constă în asamblarea oligomerului RPA.
Datele noastre sugerează că cea mai mare subunitate RPA este responsabilă în principal de legarea ssDNA și că acest eveniment are ca rezultat orientarea corectă a celorlalte polipeptide RPA în raport cu joncțiunea șablon ADN - primer. Dacă p32 intră în contact doar cu grundul sau în plus SSDNA rămâne de determinat.
Mulțumiri
Această lucrare a fost susținută parțial de Grantul INTAS N 96‐1778 și de un Grant de la Fundația Rusă pentru Cercetare de Bază (98-04‐49718).
- 8 martie Ziua Zeitei pierderea în greutate frumusețe Tmall Taobao șablon pagină de pornire e-commerce E-commerce PSD
- Șablon de șablon de 12 inci cu dimensiuni mari Descărcați PDF-ul de imprimare PDF
- Keto Top pastile dietetice chinezești Pastile dietetice - Revista Salon
- Cum să slăbești ca acest tip care a slăbit 66 de kg prin post intermitent; făcând 2 schimbări în ale lui
- Pierderea greutății bebelușului De ce contează cel mai mult primul an după naștere; Sarcina Blogului Baby2Body;