Elizabeth Cottrell
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Teresa Tropea
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Laura Ormesher
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Susan Greenwood
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Mark Wareing
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Edward Johnstone
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Jenny Myers
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Colin Sibley
1 Școală de Științe Medicale, Facultatea de Biologie, Medicină și Sănătate, Universitatea din Manchester, Spitalul St Mary, M13 9WL, Marea Britanie,
Abstract
Abrevieri
Introducere
Restricția creșterii fetale (FGR), eșecul unui făt de a-și atinge potențialul de creștere genetică, afectează aproximativ 5% din sarcini (Bamfo și Odibo, 2011) și prezintă riscuri semnificative atât în ceea ce privește supraviețuirea pe termen scurt, cât și descendenții pe termen lung. sănătate. Incidența mortalității este crescută de aproximativ 4 ori în sarcinile cu FGR (Gardosi și colab. 2013), împreună cu rate crescute de mortalitate și morbiditate neonatală (McIntire și colab. 1999). În plus, există riscuri semnificative pe viață asociate cu nașterea mică; acești sugari sunt mai predispuși să dezvolte boli metabolice și tulburări de comportament în viața adultă, comparativ cu sugarii în intervalul normal de greutate la naștere (Barker, 2006). În ciuda acestor riscuri, în prezent nu există tratamente pentru FGR, iar livrarea prematură rămâne singura opțiune. Industria farmaceutică nu a investit în dezvoltarea de tratamente pentru complicațiile sarcinii, cel puțin parțial din cauza riscurilor potențiale de toxicitate fetală (Fisk & Atun, 2008). Ca atare, există o nevoie clară de a identifica abordări terapeutice care pot spori creșterea fetală într-un mod sigur și eficient.
Importanța dietei materne pentru creșterea fetală
Pe lângă deficiențele de micronutrienți, dietele materne bogate în alimente rafinate sau procesate sunt asociate cu rezultate slabe ale sarcinii (Brantsaeter și colab. 2009). Baza mecanicistă a acestor asociații este în prezent slab înțeleasă. Cu toate acestea, modelele animale care utilizează manipulări dietetice materne pentru a induce FGR și alte complicații ale sarcinii, inclusiv grăsimi ridicate - hrănire cu zahăr ridicat (Sferruzzi - Perri și colab. 2013), restricție calorică (Lederman și Rosso, 1980) și deficiențe macro- sau micronutrienți (Cottrell și colab. 2012; Liu și colab. 2013), au contribuit semnificativ la înțelegerea căilor prin care o dietă maternă slabă poate afecta sănătatea maternă, dezvoltarea placentară și creșterea fetală. Dimpotrivă, dietele bogate în legume și fructe (Brantsaeter și colab. 2009) și alimentele probiotice (Brantsaeter și colab. 2011) au fost asociate cu un risc redus de FGR și alte complicații ale sarcinii, care probabil se vor datora cel puțin parțial să furnizeze micronutrienți. dar și potențial prin intermediul altor compuși bioactivi, așa cum este discutat mai detaliat mai jos.
Funcția vasculară uteroplacentară afectată în FGR
Deși mecanismele care stau la baza FGR sunt incomplet înțelese, se demonstrează că sunt implicate în mod constant afectări ale funcției vasculare uteroplacentare și ale fluxului sanguin (Kingdom și colab. 1997; Shibata și colab. 2008; Ghosh și Gudmundsson, 2009). Mai multe linii de dovezi sugerează că aceste deficiențe pot apărea din cauza invaziei reduse a trofoblastelor și a placentării slabe la începutul sarcinii, ceea ce duce la creșterea rezistenței vasculare și la scăderea fluxului sanguin de-a lungul placentei (Chaddha și colab. 2004). Ca urmare, apar leziuni placentare, cauzate de ischemie - reperfuzie și/sau producție crescută de specii reactive de oxigen (ROS), iar capacitatea placentară pentru schimbul de nutrienți și gaze este redusă.
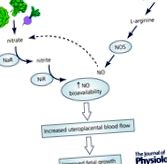
Oxidul nitric (NO) este implicat în mod critic în menținerea unei vasculaturi uteroplacentare cu rezistență scăzută/flux ridicat în sarcinile sănătoase (Poston și colab. 1995; Kublickiene și colab. 1997), iar reducerile biodisponibilității NO au fost asociate cu FGR la om (Casanello & Sobrevia, 2002; Schiessl și colab. 2006; Krause și colab. 2013). În mod endogen, NO este derivat din oxidarea aminoacidului l-arginină de către enzimele oxidului azotic sintază (NOS), dintre care există trei izoforme (neuronale, inductibile și endoteliale; nNOS, iNOS și, respectiv, eNOS). În timpul sarcinii, există o reglare accentuată a producției de NO matern prin ambele nNOS și eNOS în țesuturile vasculare (Xu și colab. 1996). În țesuturile fetoplacentare, NO-ul derivat din eNOS joacă un rol critic pe tot parcursul sarcinii, fiind implicat în implantare, angiogeneza placentară și reglarea tonusului vascular fetoplacental (Krause și colab. 2011). La modelele animale, inhibarea experimentală a sintezei endogene de NO (prin manipulări farmacologice sau genetice) s-a dovedit a duce la reduceri ale fluxului sanguin uteroplacentar și cauzează FGR (Molnar și colab. 1994; Salas și colab. 1995; Kulandavelu și colab. 2006, 2012, 2013). Având în vedere acest rol central al NO în timpul sarcinii, în ultimii 20 de ani s-au depus eforturi semnificative pentru îmbunătățirea producției și/sau semnalizării NO în cercetarea obstetrică.
Abordări pentru a viza calea NO
Oxidul nitric (produs din căile NOS endogene, sau prin reducerea azotatului dietetic) leagă o grupă hem protetică pe sGC pentru a activa enzima, ducând la sinteza celui de-al doilea mesager cGMP. Creșterea cGMP intracelulară duce în cele din urmă la hiperpolarizarea și vasodilatația celulelor musculare netede. Activitatea prin această cale este atenuată prin acțiunile PDE-5, care degradează cGMP. Agenți precum citratul de sildenafil, care inhibă enzima PDE-5, pot spori semnalizarea NO-cGMP prelungind creșterea cGMP intracelulară.
Producție alternativă de NO prin calea nitrat - nitrit - NO
În plus față de producerea de NO prin intermediul enzimelor NOS, așa cum este descris mai sus, există acum o mulțime de dovezi care demonstrează că NO poate fi generat printr-o cale alternativă, independentă de NOS (a se vedea figura abstractă). Anionii nitrați anorganici (NO3 -) și nitriții (NO2 -), derivați fie din oxidarea NO produs endogen, fie din surse alimentare, pot fi reciclate in vivo pentru a genera NO și alți oxizi de azot bioactivi importanți. Importanța acestor anioni a primit o atenție crescândă în ultimii ani, mai ales că studiile de suplimentare cu azotat alimentar au arătat o promisiune semnificativă în medicina cardiovasculară (Lundberg et al. 2008).
Bioactivarea azotatului dietetic (găsită din abundență în legumele cu frunze verzi și sfeclă roșie; Lidder & Webb, 2013) implică în primul rând reducerea acestuia la nitriți, predominant prin intermediul enzimelor bacteriene nitrat reductază din cavitatea bucală. Nitritul intră apoi în circulația sistemică, unde este redus în continuare la NO de nitrit reductaze tisulare. Un număr de enzime care posedă activități de nitrit reductază au fost identificate până în prezent, inclusiv hemoglobina, mioglobina și xantina oxidoreductaza (Lundberg și colab. 2008). Important, reducerea nitriților la NO este îmbunătățită în condiții hipoxice, unde producția de NO din activitatea NOS dependentă de oxigen ar fi limitată. Astfel, această „cale alternativă de NO” poate fi deosebit de importantă în organele bolnave sau deteriorate în care perfuzia este compromisă și oxigenarea țesuturilor redusă.
La adulții care nu sunt gravide, suplimentarea cu azotat alimentar sub formă de suc de sfeclă roșie scade semnificativ tensiunea arterială și îmbunătățește funcția vasculară (Webb și colab. 2008; Kapil și colab. 2010). Efectele benefice ale suplimentării cu nitrați dietetici au fost, de asemenea, arătate în ceea ce privește îmbunătățirea performanței exercițiilor fizice și a fluxului sanguin atât la modelele umane, cât și la cele animale (Ferguson și colab. 2013; Jones, 2014), precum și reducerea leziunilor miocardice cauzate de ischemie acută - leziuni de reperfuzie (Webb și colab. 2004; Salloum și colab. 2015).
O abordare dietetică pentru a viza calea nitrat - nitrit - NO în timpul sarcinii
Având în vedere efectele benefice ale suplimentelor de azot dietetic la omul și animalele care nu sunt însărcinate, am emis ipoteza că această abordare ar putea fi utilizată pentru a crește biodisponibilitatea NO și pentru a îmbunătăți funcția vasculară în sarcinile complicate. Mai mult, este probabil ca o intervenție dietetică, cum ar fi suplimentarea cu suc de sfeclă roșie, să fie mai atrăgătoare pentru femeile însărcinate și să aibă potențial mai puține efecte în afara obiectivelor comparativ cu abordările farmacologice și, prin urmare, poate încuraja conformarea.
Descoperirile noastre preclinice de până acum au arătat că suplimentarea cu azot dietetic matern (folosind suc de sfeclă roșie) crește concentrațiile atât de azotat cât și de azotat matern și fetal și îmbunătățește funcția vasculară a arterei uterine materne ex vivo într-un model de șoarece de FGR asociat cu disfuncție vasculară marcată, mouse (Cottrell et al. 2015). Studiile noastre în desfășurare care utilizează această abordare își propun să înțeleagă modul în care efectele benefice ale suplimentării cu nitrați sunt conferite în acest model și să stabilească mecanismele implicate în bioactivarea nitraților/nitriților în țesuturile uteroplacentare ale animalelor gravide.
Având în vedere dovezile noastre preliminare promițătoare, la modelele animale, că suplimentarea maternă cu nitrați în timpul sarcinii este bine tolerată și asociată cu îmbunătățiri ale funcției vasculare uteroplacentare (așa cum s-a discutat mai sus), am fugit recent dintr-un studiu de fezabilitate care utilizează această abordare dietetică la femeile gravide. Pe baza dovezilor din medicina cardiovasculară, ne adresăm în prezent femeilor cu hipertensiune (care prezintă un risc crescut de a furniza copii cu FGR) să ia parte la un studiu pe termen scurt (1 săptămână) care implică suplimentarea cu azot dietetic sub formă de suc de sfeclă roșie. Acesta este un studiu dublu orb, controlat cu placebo, și își propune să investească efectele acestei intervenții asupra funcției cardiovasculare materne și a rezistenței vasculare uteroplacentare, precum și să stabilească dacă această abordare a suplimentării dietetice este acceptabilă pentru femeile gravide. Acest studiu (ClinicalTrials.gov,> NCT02520687) este în curs de desfășurare și ne așteptăm ca rezultatele să fie raportate în 2017. Dacă este eficientă, această abordare ar putea fi extinsă în studiile viitoare pentru a interveni într-o serie de complicații ale sarcinii asociate cu afectarea funcției vasculare și biodisponibilitate NO limitată, inclusiv FGR și preeclampsie.
Concluzii și provocări viitoare de cercetare
Găsirea tratamentelor eficiente și acceptabile pentru complicațiile sarcinii rămâne o provocare semnificativă în obstetrică. Există un domeniu considerabil pentru dezvoltarea intervențiilor dietetice în timpul sarcinii pentru a reduce riscul și/sau severitatea bolii. Cercetările viitoare în acest domeniu necesită o mai bună înțelegere a mecanismelor prin care componentele dietetice specifice au impact asupra fiziologiei materne și asupra dezvoltării fetoplacentare. Progresul va necesita seturi de date epidemiologice, precum și modele experimentale preclinice, pentru a înțelege biologia care stă la baza studiilor de asociere bazate pe populație și pentru a traduce aceste descoperiri în strategii terapeutice noi.
Informatii suplimentare
Interese concurente
Autorii declară că nu există interese concurente.
Contribuțiile autorului
E.C., T.T., L.O., S.G., M.W., E.J., J.M. și C.S. a contribuit la scrierea manuscrisului. Toți autorii au aprobat versiunea finală a manuscrisului și sunt de acord să răspundă pentru toate aspectele lucrării. Toate persoanele desemnate ca autori se califică pentru autor și sunt listate toate cele care se califică pentru autor.
Finanțarea
Lucrarea preclinică la care se face referire în această revizuire este susținută de un grant de la British Heart Foundation către E.C. (FS/15/31/31418); studiul de fezabilitate clinică este susținut de o subvenție oferită de Tommy’s Maternal and Fetal Health Research Center.
Importanță translațională
Multe complicații ale sarcinii, inclusiv restricția creșterii fetale, sunt asociate cu afectări ale funcției vasculare materne și uteroplacentare. Intervențiile care vizează direcționarea căii oxidului nitric (NO) rămân o zonă cheie de interes în cercetarea obstetrică, deși în prezent nu sunt disponibile terapii pentru tratarea complicațiilor sarcinii. O multitudine de dovezi generate la persoanele care nu sunt însărcinate au identificat importanța căii alternative de NO, prin care azotatul alimentar (derivat din alimente precum legume cu frunze verzi și sfeclă roșie) este transformat în organism în NO și alți oxizi de azot bioactivi, conferind beneficii efecte asupra funcției vasculare. Suplimentarea cu azotat alimentar este o strategie potențială pentru creșterea NO în sarcinile complicate, cu beneficiile suplimentare de a fi ușor și ieftin de administrat și potențial mai atrăgătoare pentru femeile însărcinate în comparație cu abordările farmacologice.
Biografie
Elizabeth Cottrell este un fiziolog al cărui principal interes de cercetare se concentrează pe rolul sănătății materne în timpul sarcinii și pe programarea dezvoltării bolilor adulte. Și-a luat doctoratul de la Universitatea Cambridge, Marea Britanie, în 2009, iar în 2013 s-a mutat la Centrul de Cercetare în Sănătate Maternă și Fetală din Manchester, Marea Britanie, pentru a se alătura unei echipe de cercetare multidisciplinară formată din oameni de știință și oameni de știință clinici, concentrându-se pe găsirea soluțiilor o gamă largă de complicații ale sarcinii. În prezent, este bursier intermediar al British Heart Foundation, cu un interes principal în abordările dietetice pentru a preveni sau trata complicațiile sarcinii.
Note
Această revizuire a fost prezentată la simpozionul „Stresul în timpul sarcinii: consecințe fiziologice asupra dezvoltării intrauterine”, care a avut loc la Fiziologia 2016, Dublin, Irlanda, 29-31 iulie 2016.
Acesta este un articol din Editor's Choice din numărul 1 august 2017.
- Echinacea purpurea dietetică în timpul efectului asupra sarcinii murine asupra hemopoiezei materne și a creșterii fetale
- Compoziția dietetică și adaptările fiziologice la restricția de energie
- Intervenții dietetice pentru adulții cu boli renale cronice - PubMed
- Grăsimile alimentare și carbohidrații sunt asociați independent cu creșterea circulantă asemănătoare insulinei
- Indice glicemic dietetic și glucoză, insulină, factor de creștere asemănător insulinei, creștere asemănătoare insulinei