Scott E. Kanoski
1 Departamentul de Științe Biologice, Universitatea din California de Sud
Zhi Yi Ong
2 Departamentul de Psihologie, Universitatea din Pennsylvania
Samantha M. Fortin
3 Programe postuniversitare în neuroștiințe, Universitatea din Illinois la Chicago
Elizabeth S. Schlessinger
2 Departamentul de Psihologie, Universitatea din Pennsylvania
Harvey J. Grill
2 Departamentul de Psihologie, Universitatea din Pennsylvania
Abstract
Agoniștii receptorilor peptidei-1 (GLP-1R) precum glucagonul și leptina exercită fiecare efecte anorexigenice. În combinație, efectul inhibitor al aportului și efectele de scădere în greutate sunt mai mari decât oricare dintre tratamente, însă mecanismele sunt neclare.
Materiale și metode
Efectele liraglutidei (un analog GLP-1 cu acțiune lungă) și ale co-tratamentului cu leptină, administrat în doze mici sau moderate subcutanat (SC) sau respectiv în al treilea ventricul, asupra aportului cumulativ, modelelor de masă și expresiei hipotalamice a semnalizării intracelulare proteinele [traductorul de semnal fosforilat și activatorul transcripției-3 (pSTAT3) și protein tirozin fosfataza-1B (PTP1B)] au fost examinate la șobolani slabi.
Rezultate
O combinație cu doze mici de liraglutidă (25 μg/kg) și leptină (0,75 μg) a redus aditiv aportul cumulativ de alimente și greutatea corporală, rezultat mediat predominant printr-o reducere semnificativă a frecvenței meselor care nu a fost prezentă cu niciunul dintre medicamente. Numai tratamentul cu liraglutidă a redus dimensiunea meselor; un efect care nu este îmbunătățit prin administrarea concomitentă de leptină. Doze moderate de liraglutidă (75 μg/kg) și leptină (4 μg) examinate separat fiecare frecvență redusă a mesei, aportul cumulativ de alimente și greutatea corporală; numai liraglutida a redus dimensiunea mesei. În combinație, aceste doze nu au îmbunătățit efectele anorexigenice ale tratamentului. Imunoblotul ex vivo a prezentat pSTAT3 crescut în țesutul hipotalamic după co-tratament cu liraglutidă-leptină, un efect mai mare decât tratamentul cu leptină singur. În plus, liraglutida SC a redus expresia PTP1B (un regulator negativ al semnalizării receptorilor de leptină), dezvăluind un mecanism potențial pentru răspunsul pSTAT3 îmbunătățit după administrarea concomitentă de liraglutidă-leptină.
Concluzii
În mod colectiv, aceste rezultate oferă noi mecanisme comportamentale și moleculare care stau la baza reducerii aditive a aportului de alimente și a greutății corporale după tratamentul combinat cu liraglutidă-leptină.
Introducere
Nu sunt cunoscute mecanismele comportamentale prin care leptina și agoniștii GLP-1R se combină pentru a reduce hrănirea. Tratamentul periferic cu exendină-4 în macacii rhesus reduce hrănirea prin suprimarea dimensiunii mesei, fără efect asupra frecvenței mesei (18). La rozătoare, exendina-4 periferică reduce atât mărimea mesei, cât și frecvența mesei (19), în timp ce administrarea de exendină-4 în zona tegmentală ventrală (VTA) (20) sau în hipocampul ventral (21) reduce aportul printr-o reducere specifică a mesei mărimea. În mod similar, tratamentul periferic cu liraglutidă reduce consumul de alimente prin reducerea dimensiunii mesei la mini-porci (8).
La fel ca GLP-1R, activarea LepRbs reduce consumul de alimente, cel puțin parțial, prin reducerea dimensiunii mesei. Tratamentul cronic cu leptină periferică reduce dimensiunea meselor cu impact minim asupra frecvenței meselor (22, 23). În mod similar, șoarecii cu deficiență de leptină (24) și șobolanii cu „eliminare” cronică mediată de LepRb în neuronii NTS (25) consumă mese mai mari, fără a modifica frecvența substanțială a meselor, comparativ cu martorii. Spre deosebire de aceste constatări, administrarea acută de leptină ICV reduce frecvența meselor la șobolani, cu un efect minim asupra dimensiunii mesei (26). Nu se știe dacă efectele anorectice aditive ale administrării concomitente de GLP-1R și LepRb apar prin reducerea dimensiunii mesei, a frecvenței mesei sau a ambelor. Prezentul studiu examinează efectul cumulativ al consumului de alimente, greutatea corporală și efectele modelului de masă ale combinațiilor de doză mică și moderată de liraglutidă periferică (SC) și administrare concomitentă de leptină centrală (a III-a ICV) la șobolani.
Materiale și metode
Subiecte
Șobolani Sprague-Dawley masculi adulți (râul Charles; 325-450g în timpul procedurilor experimentale) adăpostiți individual sub un ciclu de lumină/întuneric invers de 12 ore (luminile aprinse la ora 10.00) timp de cel puțin 2,5 săptămâni înainte de proceduri, au avut acces ad libitum la chow (LabDiet; 5001) și apă, cu excepția cazului în care se menționează. Toate procedurile s-au conformat și au primit aprobarea de la Comitetul instituțional de îngrijire și utilizare a animalelor de la Universitatea din Pennsylvania.
Interventie chirurgicala
Sub ketamină (90 mg/kg), xilazină (2,7 mg/kg) și acepromazină (0,64 mg/kg) anestezie și analgezie (Metacam 2 mg/kg), canule de ghidare (Plastics One; 26-ghage) cimentate la craniu folosind bijutieri șuruburi au fost implantate cu tipul său stereotaxic poziționat la 2,0 mm deasupra celui de-al treilea ventricul la următoarele coordonate: 2,0 mm caudal la bregmă, 7,7 mm ventrale la suprafața craniului, pe linia mediană. Pozițiile anatomice ale locurilor de injectare III ICV au fost evaluate 1 săptămână postoperatorie prin măsurarea efectului glicemic mediat simpato-suprarenal indus de citoglucopenie rezultat din 210μg (2μl) de 5-tio-D-glucoză (29).
Proceduri
Aportul alimentelor, modelele de masă și analizele greutății corporale
Alimentele au fost îndepărtate cu 30 de minute înainte de prima injecție și șobolanii au primit 3 injecții ICV (1μL) de leptină (Programul Național de Hormoni și Peptide) sau vehicul (NaHCO3). Cincisprezece minute mai târziu, fiecare șobolan a primit o injecție SC (1 ml/kg) de liraglutidă (cadou de Novo Nordisk, Bagsvaerd, Danemarca) sau vehicul (soluție salină sterilă), care a avut loc imediat înainte de stingerea luminilor. Studiile farmacologice au utilizat un design în cadrul subiecților, cu tratamente separate de 3-4 zile. Dozele au fost selectate pentru a fi în intervalul scăzut până la moderat pentru reducerea aportului de alimente pe baza curbelor de răspuns la doză pentru liraglutidă periferică (30) și leptină ICV (31). Aportul cumulativ a fost măsurat cu un sistem automat de alimentare (DiaLog Instruments). Șobolanii adăpostiți individual aveau acces la o cupă de alimente pe un circuit de celule de încărcare care comunicau cu o interfață și un computer cu software personalizat (LabVIEW, National Instruments). Greutatea cupei cu alimente a fost măsurată la fiecare 10 secunde, permițând evaluarea parametrilor mesei. O masă a fost definită ca un episod de hrănire în care au fost ingerate cel puțin 0,25 g, cu criteriul de încetare a mesei ca începutul unei pauze de ingestie> 10 minute, după cum sa descris anterior (25, 32). Datele au fost calculate în mod obiectiv folosind o macro personalizată Microsoft Excel.
Analize ex vivo imunoblot pSTAT3 și PTP1B
Pentru analize imunoblot pSTAT3, s-au efectuat tratamente farmacologice (patru grupuri, n = 6-7 per grup), cu aceiași parametri de sincronizare a injecției descriși mai sus, folosind o doză de 6,0 μg de leptină (ICV) și o doză de 50 μg/kg de liraglutidă (SC). În concordanță cu munca noastră anterioară care a combinat abordări comportamentale și ex vivo (32, 33), s-au utilizat doze mai mari pentru analize de semnalizare ex vivo comparativ cu analize comportamentale pentru a optimiza capacitatea de a detecta căile de semnalizare intracelulare activate. 45 de minute după injecțiile SC (1 oră după injecțiile ICV), șobolanii au fost sacrificați prin decapitare. Creierele au fost îndepărtate rapid și hipotalamusul a fost extras și congelat rapid în izopentan și depozitat la -80 ° C. Pentru analizele imunoblotului PTP1B (n = 9 per grup), șobolanii au fost sacrificați 45 de minute după injecții SC.
Țesuturile hipotalamice au fost omogenizate în tampon de test radioimunoprecipitare (RIPA). Lizatele hipotalamice au fost supuse SDS-PAGE și transferate în membranele PVDF pentru analiza imunoblotului, așa cum s-a descris anterior. Imunoreactivitatea a fost vizualizată folosind chemiluminescență îmbunătățită (BioRad; Chemidoc XRS). Anticorpii STAT3 fosforilați și totali (semnalizare celulară; diluție 1: 1000) au fost folosiți pentru a evalua activitatea pSTAT3 normalizată la STAT3 total. Expresia proteinei PTP1B (Santa Cruz; diluție 1: 500) a fost normalizată la controlul încărcării β Actinei. Bloturile au fost cuantificate folosind analiza densitometriei în software (Imagine J; Institutul Național de Sănătate).
Analize statistice și de date
Toate analizele statistice pentru măsurile comportamentale au folosit analize variaționale ale măsurilor repetate (ANOVA; analiză separată efectuată pentru fiecare punct de timp) folosind medicamentul ICV și SC ca factori. Când s-au detectat efecte principale semnificative ale oricărui medicament, s-au folosit teste posthoc Newman-Keuls pentru a compara tratamentele individuale. Analizele imunoblot au fost analizate folosind ANOVA One-Way. Nivelul alfa pentru semnificație a fost de 0,05. Analizele statistice au fost efectuate utilizând software-ul Statsoft (Statistica V10).
Rezultate
Combinație de doză mică: aportul cumulativ de alimente, greutatea corporală delta și tiparele de masă
S-a raportat anterior că efectul aditiv al administrării intraperitoneale de leptină și GLP-1 asupra aportului alimentar și a greutății corporale a fost obținut numai în principal cu combinații de doze mici (12). În concordanță cu această constatare, am constatat că efectele inhibitoare ale aportului și pierderea în greutate a unei doze moderate de tratament combinat cu liraglutidă-leptină (4μg leptină, 75μg/kg liraglutidă) nu au fost mai mari comparativ cu niciunul dintre tratamentele singure. Este posibil ca efectele aportului și ale greutății corporale ale leptinei și liraglutidei la aceste doze să fi atins un efect minim, limitând astfel reducerea suplimentară a aportului alimentar și a greutății corporale. Cu toate acestea, în lucrările noastre anterioare, reducerea consumului de alimente produsă de o doză mare de a IV-a leptină ICV (20 μg) a fost în continuare mărită de a IV-a exendină-4 ICV (15), sugerând că efectele anorectice ale dozelor mari de leptină centrală pot fi crescută în continuare prin activarea GLP-1R atunci când ambele medicamente sunt livrate în creierul posterior. În mod interesant, rezultatele actuale au arătat, de asemenea, că efectul inhibitor al aportului de 4 μg de leptină ICV prin el însuși este mediat de o reducere a frecvenței mesei, fără efect asupra dimensiunii mesei. Aceste date contrastează cu cele care urmează tratamentului cu leptină periferică cronică, care reduce dimensiunea meselor cu impact minim asupra frecvenței meselor (22, 23).
Efectul acut al leptinei asupra parametrilor tiparului de masă după livrarea ICV din creier, după cunoștințele noastre, a fost raportat doar în alte două studii (26, 35). În concordanță cu rezultatele actuale, Zorilla și colegii săi au raportat un efect redus al leptinei ICV asupra dimensiunii mesei, în timp ce efectele de reducere a frecvenței meselor au fost observate cu doze de leptină cuprinse între 1-6,25 μg, dar nu cu 0,3 μg de leptină. Acest studiu a utilizat un interval de întrerupere între pauzele intra-mese și intervalele inter-mese (interval de răspuns; IRI) de 5 minute pentru a defini sfârșitul mesei, în timp ce studiul nostru actual a utilizat un criteriu IRI de 10 minute, ambele fiind larg acceptat în literatura de specialitate bazat pe observații comportamentale extinse și analize de supraviețuire a jurnalelor (26, 36-39). Pe de altă parte, un alt studiu, utilizând IRI de 30 min, a raportat o reducere a dimensiunii meselor fără reducerea frecvenței meselor după leptina ICV. Astfel, constatarea contradictorie a lui Flynn și colab. se poate baza pe utilizarea unui IRI mult mai lung (30-min) comparativ cu studiul nostru (10-min) și studiul realizat de Zorilla și colegii (5-min). Lucrările viitoare sunt necesare pentru a determina dacă, spre deosebire de tratamentul acut, leptina cronică ICV are un efect mai puternic asupra dimensiunii mesei comparativ cu frecvența mesei, așa cum s-a observat anterior după administrarea cronică a leptinei periferice.
SC liraglutidă reduce în mod robust aportul de alimente și greutatea corporală atât la șobolanii obezi slabi, cât și la cei obosiți (DIO) (30, 40-43) și reduce consumul de alimente la mini-porcii obezi prin reducerea dimensiunii mesei. După cum știm, efectul liraglutidei SC asupra modelelor de masă la șobolani nu a fost raportat anterior. Aici, arătăm că o doză moderată de liraglutidă acută SC (75μg/kg) a redus atât frecvența mesei, cât și dimensiunea mesei. În studiile anterioare, efectul activării GLP-1R asupra tiparelor de masă pare a fi dependent de calea și locul de administrare (18-21, 44, 45), cu efecte mai puternice observate în general pentru mărimea mesei comparativ cu reducerea frecvenței mesei. Având în vedere că liraglutida acută reduce consumul de alimente prin activarea GLP-1R atât periferice cât și centrale după administrarea periferică (41, 46), este posibil ca efectele tiparului de masă observate în prezentul studiu să fie mediate de o acțiune la periferie, central, sau amândouă. Este, de asemenea, posibil ca efectele nespecifice (de exemplu, greața) să fi contribuit la efectele tiparului mesei ale liraglutidei (singur și în combinație cu leptina), dat fiind că, în anumite condiții, analogii GLP-1 produc o învățare condiționată pentru evitarea aromelor (30, 47).
Am investigat căile de semnalizare intracelulară implicate în activarea combinată LepRb și GLP-1R în hipotalamus, unde receptorii atât pentru leptină cât și pentru GLP-1 sunt exprimați abundent (48, 49). Efectul inhibitor al aportului semnalizării LepRb este mediat, parțial, prin calea JAK-STAT, unde leptina se leagă de LepRb și are ca rezultat fosforilarea Janus kinazei-2 (pJAK2) și STAT3 (pSTAT3) (50). PSTAT3 este, de asemenea, crescut după activarea citokinelor inflamatorii [de exemplu, receptorii interleukinei (IL) -1, IL-6] și semnalizarea centrală a IL-1 și IL-6 se crede că contribuie la anorexia centrală indusă de GLP-1 (28). Rezultatele noastre au arătat că leptina ICV a crescut semnalizarea hipotalamică pSTAT3 și acest efect a fost amplificat semnificativ cu administrarea concomitentă de liraglutidă SC. Cu toate acestea, nu am observat o creștere a pSTAT3 după administrarea SC liraglutidă singură, un rezultat care diferă de un studiu recent care a raportat o creștere a pSTAT3 hipotalamic după ICV Ex-4 (28). Este posibil ca diferita cale de administrare (SC vs ICV), analogul GLP-1 (liraglutidă vs Ex-4) sau puterea relativă a dozei utilizate să fi contribuit la această diferență.
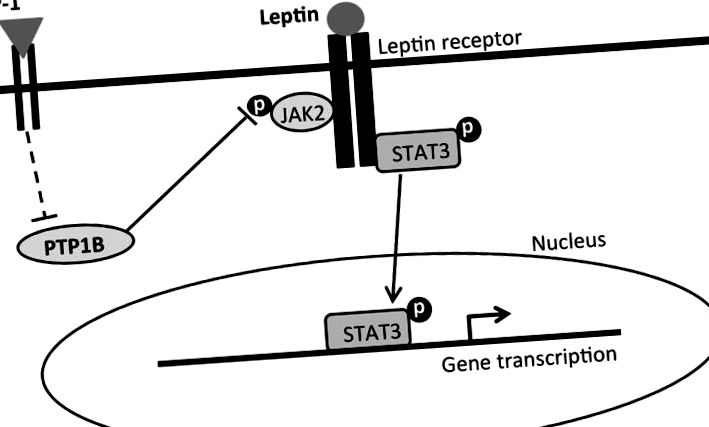
Un rezumat simplificat propus al mecanismelor de semnalizare intracelulară care mediază efectele inhibitoare ale aportului și pierderea în greutate a tratamentului combinat leptină-liraglutidă. Leptina se leagă de forma lungă a receptorului de leptină (LepRb), care activează proteina Janus kinază 2 (JAK2) și are ca rezultat fosforilarea diferitelor reziduuri de tirozină și traductorul de semnal și activatorul transcripției-3 (pSTAT3). pSTAT3 se translocează în nucleu pentru a media transcrierea genelor legate de aportul alimentar și controlul greutății corporale. GLP-1, pe de altă parte, se leagă de receptorul GLP-1 și inhibă PTP1B printr-o cale directă sau indirectă (linii întrerupte). PTP1B defosforilează în mod normal JAK2 și îl dezactivează. Prin urmare, inhibarea PTP1B dezinhibă pJAK2. Dezinhibarea pJAK2 prin activarea GLP-1R, împreună cu activarea semnalizării LepRb, are ca rezultat o creștere combinatorie a pSTAT3, care se propune să medieze efectele îmbunătățite de suprimare a aportului și efectele de pierdere în greutate corporală ale liraglutidei și leptinei.
Rezultatele actuale identifică PTP1B ca un mecanism prin care administrarea concomitentă de liraglutidă și leptină a crescut pSTAT3. De asemenea, recunoaștem posibilitatea altor căi alternative care mediază efectele de inhibare a aportului îmbunătățite și efectele de scădere în greutate ale tratamentului combinat cu liraglutidă-leptină. De exemplu, expresia ARNm a factorului de creștere a fibroblastelor 21 (FGF21), un factor de creștere important pentru reglarea homeostaziei glucozei și lipidelor, crește în ficat după administrarea periferică de liraglutidă (63, 64). FGF21 crește sensibilitatea la leptină la șoarecii DIO (65), iar efectele metabolice ale FGF21 par a fi, parțial, mediate central (66). Prin urmare, este posibil ca creșterile induse de liraglutidă ale FGF21 să contribuie, de asemenea, la semnalizarea hipotalamică LepRb crescută (creșterea pSTAT3) după administrarea acută de liraglutidă-leptină. Alternativ, această creștere combinatorie în pSTAT3 poate fi, de asemenea, mediată de o creștere a expresiei LepRb ca urmare a tratamentului cu liraglutidă. Acest mecanism presupus este totuși mai puțin probabil, având în vedere că tratamentul cu liraglutidă periferică subcronică nu modifică expresia LepRb în ARH de șobolani DIO (59). Cu toate acestea, aceste ipoteze rămân a fi explorate pe larg.
Rezultatele prezentului studiu arată că leptina ICV și liraglutida SC, combinate la doze mai mici, dar nu moderate, au crescut aportul de alimente și efectele de reducere a greutății corporale ale oricărui medicament. Acest efect aditiv de consum alimentar după administrarea combinată s-a bazat pe o reducere semnificativă a frecvenței meselor care nu a fost observată ca răspuns la niciunul dintre tratamentele singure. Împreună cu aceste efecte comportamentale am arătat pentru prima dată că SC liraglutidă a crescut activarea pSTAT3 condusă de leptină în neuronii hipotalamici, efect care se poate baza, parțial, pe reducerea mediată de liraglutidă a expresiei hipotalamice a PTP1B. Sunt necesare studii viitoare pentru a examina dacă aceste aporturi și efectele de reducere a greutății corporale ale tratamentului combinat cu leptină și liraglutidă sunt prezente după alte căi de administrare, administrare cronică pe termen lung și persistă în modelele de rozătoare DIO.
Mulțumiri
Mulțumim următoarelor persoane pentru contribuții notabile: Dr. Kendra Bence, Derek Zimmer, Polly Van den Berg, Jennifer Gilbert, Jeffrey Chen și Amber Alhadeff.
- Efecte secundare Monurol Frecvente, severe, pe termen lung
- Efectele pe termen lung ale aportului crescut de proteine după scăderea în greutate asupra conținutului de lipide intrahepatice și
- Efecte secundare ale ketaminei Frecvente, severe, pe termen lung
- Ligninele și derivatele lor cu efecte benefice asupra sănătății umane
- Efecte secundare ale misoprostolului Frecvente, severe, pe termen lung