David A. Muller
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Alexandra C. I. Depelsenaire
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Ashleigh E. Shannon
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
Daniel Watterson
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
Simon R. Corrie
3 Departamentul de inginerie chimică, Centrul de excelență ARC în știință și tehnologie convergentă BioNano, Universitatea Monash, Clayton, VIC 3800, Australia
Nick S. Owens
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Christiana Agyei-Yeboah
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Stacey T. M. Cheung
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
Jin Zhang
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Germain J. P. Fernando
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Mark A. F. Kendall
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Paul R. Young
1 Centrul australian de cercetare a bolilor infecțioase, Școala de chimie și biștiințe moleculare, Universitatea din Queensland, Brisbane, QLD 4072, Australia
2 Institutul australian pentru bioinginerie și nanotehnologie, Universitatea din Queensland, Brisbane, QLD 4072, Australia; moc.liamg@erianesleped (A.C.I.D.);
Date asociate
Abstract
1. Introducere
De la reapariția virusului dengue (DENV) în anii 1950, a existat o creștere constantă a transmisiei și a bolilor globale în deceniile care au urmat. Gama geografică în creștere a transmisiei dengue a dus la aproximativ jumătate din populația lumii care trăiește în regiuni endemice de dengue, estimându-se anual 390 de milioane de infecții cu dengue [1]. În consecință, virusurile dengue sunt acum privite ca fiind cele mai semnificative dintre toate infecțiile cu arbovirus cauzatoare de boli.
Ceea ce face dengue unic printre flavivirusuri (inclusiv virusul Zika și virusul West Nile) este că există 4 serotipuri (serotipurile 1-4) care sunt strâns legate, dar antigenic distincte. Pacienții infectați cu oricare dintre cele 4 serotipuri DENV pot experimenta un spectru de rezultate clinice, variind de la asimptomatice până la boli febrile ușoare până la febra dengue. După infecția primară, pacienții dezvoltă o imunitate pe tot parcursul vieții față de serotipul original al virusului infectant [2]. Cu toate acestea, la infecția secundară cu un serotip heterolog, într-o proporție de indivizi, inducerea anticorpilor cu reacție încrucișată poate duce la creșterea dependenței de anticorpi (ADE) a infecției și progresia către o boală mai severă și potențial fatală [3].
Având în vedere potențialul de reinfecție cu un serotip al virusului heterotipic care duce la rezultatul îmbunătățit al bolii, un vaccin dengue de succes trebuie să fie tetravalent, provocând anticorpi neutralizanți pentru toate cele patru serotipuri, astfel încât indivizii naivi nu sunt pregătiți pentru boala severă de la prima lor întâlnire cu animale sălbatice. -tip virus [4]. Primul vaccin DENV și până acum autorizat, Dengvaxia (Sanofi Pasteur) [5], este un amestec de patru virusuri himerice, atenuate în viață, bazate pe coloana vertebrală genetică 17D a virusului febrei galbene (YFV), cu YFV prM și E gene înlocuite cu gene structurale echivalente ale fiecăruia dintre cele 4 serotipuri DENV. În timp ce studiile timpurii au fost promițătoare, vaccinul s-a dovedit a avea limitări semnificative, iar OMS recomandă acum utilizarea vaccinului să fie limitată numai la destinatarii care au fost anterior infectați cu DENV [6].
Strategiile alternative sunt urmărite în mod activ. Glicoproteina E de suprafață DENV este un candidat ideal pentru un vaccin subunitar, dat fiind că este ținta principală a unui răspuns de anticorpi neutralizanți [7,8,9]. Cu toate acestea, asigurarea unui răspuns imun puternic rămâne o provocare pentru vaccinurile subunitare recombinante, necesitând o strategie adjuvantă eficientă [10]. Răspunsurile imune pot fi îmbunătățite prin țintirea celulelor care prezintă antigen în piele prin injecție intradermică sau prin utilizarea de patch-uri microarray (MAP), cum ar fi nanopatch-ul.
Nanopatch-ul este un patch microarray de 4 × 4 mm cu densitate ultra-mare (MAP) care conține 21.000 de proiecții/cm 2 de 110 μm în lungime. Vaccinul este acoperit cu uscare pe suprafața acestor proiecții și aplicat pe piele folosind un aplicator cu arc, exact pe straturile epidermice și dermice ale pielii, conținând o densitate mare de celule care prezintă antigen [11]. Ca urmare a acestei abordări vizate, grupul nostru a obținut răspunsuri imune îmbunătățite cu doze fracționate în comparație cu metodele standard de injecție cu ac și seringă, cum ar fi injecția intramusculară și subcutanată. Această îmbunătățire a fost stimulată în continuare prin adăugarea unui adjuvant [12]. Aceste răspunsuri imune îmbunătățite au fost observate în vaccinurile atenuate [13], ADN [14], inactivate [15,16], particule asemănătoare virusului [17], conjugate [18] și vaccinuri cu virion divizat [19,20].
Aici, investigăm utilitatea mai multor căi de imunizare diferite cu nanopatch, și anume injecție intramusculară, subcutanată, intradermică și, de asemenea, livrare intra-cutanată, pentru capacitatea lor de a induce răspunsuri imune de protecție împotriva proteinei E (sE) secretată de dengue.
2. Materiale și metode
2.1. Șoareci
Șoarecii femele SV129 și AG129 (6-8 săptămâni) au fost crescuți în condiții fără patogeni în casa de animale a Institutului Australian pentru Bioinginerie și Nanotehnologie (AIBN). Toate metodele din acest studiu au fost realizate în conformitate cu liniile directoare ale Consiliului Național de Sănătate și Cercetare Medicală și aprobate de comitetul de etică animală al Universității din Queensland (Aprobare AIBN/556/12 15/10/2014).
2.2. Linii telefonice
Celulele Vero au fost menținute în medii Optimem conținând 3% ser fetal de vițel și penicilină/streptomicină (PenStrep).
2.3. DENV1-4 Stocuri virale
Serotipurile DENV au fost propagate în celulele Aedes albopictus C6/36 înainte de titrare în celulele Vero. Pentru a titra virusul pentru testele de neutralizare a reducerii plăcii (PRNT), stocurile virale DENV au fost diluate în serie la 1:10 în mediu optim fără ser și incubate timp de 1 oră la 37 ° C într-o atmosferă conținând 5% CO2. Virusul a fost adăugat la monostratele confluente de celule Vero în plăci cu 96 de godeuri, însămânțate în ziua precedentă la o densitate de 4 × 104 celule per godeu. Virusul a fost lăsat să se absoarbă 1 oră la 37 ° C în 5% CO2. Virusul a fost îndepărtat înainte de adăugarea de 1,5% carboximetilceluloză (CMC) suprapusă cu mediu M199 (Gibco, Grand Island, NY, SUA), suplimentată cu 2% ser fetal bovin inactivat termic (FBS). Plăcile au fost incubate la 37 ° C, 5% CO2 timp de 2 zile. Celulele au fost imunomarcate așa cum este descris în protocolul PRNT.
2.4. Cuantificarea încărcăturii virale a șoarecilor prin testarea plăcii DENV
Nivelurile de virus în circulație liberă au fost determinate prin testarea plăcii virale efectuate în celule Vero în plăci cu 96 de godeuri. Celulele Vero au fost placate la 2 × 105 celule/ml la un volum de 200 μL și au permis să crească până la confluență peste noapte la 37 ° C. Celulele au fost spălate cu soluție salină tamponată cu fosfat (PBS) urmată de mediu fără ser. Probele de plasmă au fost diluate în serie de la 10 -2 la 10-8 într-o placă separată cu 96 de godeuri. După ce mediul fără ser a fost îndepărtat din celule, 50 μL de virus diluat în serie a fost adăugat la celule și incubat la 37 ° C timp de 2 ore. După incubare, mediul a fost îndepărtat și celulele au fost suprapuse cu 200 μL de 1,5% carboximetilceluloză (CMC) în M199 (Invitrogen) cu 2,5% FCS și incubate timp de 4 zile la 37 ° C. După 4 zile, suprapunerea a fost îndepărtată și celulele au fost spălate cu PBS. Celulele au fost apoi fixate cu 200 μL de 80% acetonă răcită cu gheață/20% PBS timp de 20 de minute la -20 ° C. Fixativul a fost îndepărtat și plăcile au fost uscate peste noapte.
Celulele au fost apoi spălate în PBS/0,1% ser albumină bovină (BSA) și blocate timp de 20 de minute pe un agitator la temperatura camerei în același tampon. După blocare, la fiecare godeu s-au adăugat 50 μL dintr-o diluție 1: 200 a unui ser policlonal de iepure 1 (NS1) anti-nestructural diluat în tampon de blocare la fiecare godeu și incubat timp de 1 oră la temperatura camerei. După incubare cu anticorpul primar, celulele fixe au fost spălate de două ori în tampon de blocare timp de 3 minute pe un agitator. Plăcile au fost răsturnate și lovite pentru a îndepărta soluția de spălare între fiecare etapă de spălare. Celulele au fost sondate cu anticorp secundar imunoglobulină G (IgG) anti-iepure (1: 2000) conjugat cu un fluorofor 800. Celulele au fost spălate în soluție salină tamponată cu fosfat 0,05% Tween-20 (PBS-T) de 3 ori și plăcile au fost lăsate să se usuce complet înainte de vizualizare și imagistică pe aparatul Odyssey CLx (Li-Cor Biotechnology, Lincoln, CA, SUA).
2.5. Protocolul PRNT
Protocolul PRNT a fost realizat așa cum a fost descris anterior, cu unele modificări pentru viruși individuali [21]. Celulele Vero au fost însămânțate în plăci cu 96 de godeuri la o densitate de 4 × 104 celule per godeu și incubate peste noapte la 37 ° C în 5% CO2. Serurile de șoareci colectate în timpul studiului au fost inactivate la căldură la 56 ° C timp de 30 de minute. Serurile au fost diluate 1:25 în mediu optim fără ser și diluate în serie la 1: 2 într-o placă cu 96 de godeuri până la un volum final de 60 μL. Se obține un volum egal de stoc de virus DENV diluat până la o concentrație finală
La fiecare godeu s-a adăugat 75 unitate de formare a plăcii (PFU)/godeu pentru a se obține o diluție serică finală de 1:50. Amestecul ser-virus a fost incubat la 37 ° C în 5% CO2 timp de 1 oră înainte de a adăuga 50 uL la celulele Vero confluente. Plăcile au fost incubate timp de 1 oră la 37 ° C în 5% CO2 pentru a permite absorbția virusului. Virusul - inoculul seric a fost eliminat și celulele au fost spălate de două ori în PBS înainte de adăugarea unei suprapuneri de 1,5% CMC cu M199 și 2% FBS. Plăcile au fost incubate la 37 ° C, 5% CO2 timp de 2 zile. Acest proces a fost repetat pentru toate cele patru serotipuri de DENV (DENV1 ET00.243, DENV2 ET00.300, DENV3 ET00.209 și DENV4 ET00.288) în duplicat pentru fiecare probă de ser.
Suprapunerea CMC a fost îndepărtată și celulele au fost fixate în 80% acetonă răcită cu gheață/20% PBS timp de 15 minute la -20 ° C. Plăcile au fost uscate complet înainte de blocare timp de 30 de minute la temperatura camerei în diluant de lapte/soluție de blocare (KPL) diluată în PBS 0,05% Tween 20 (PBS-T). Celulele au fost incubate timp de 1 oră la 37 ° C cu anticorpi monoclonali anti-anvelopă (MAbs) umani, produși așa cum s-a descris anterior [22] și diluați în soluție de blocare KPL/PBS-T. Pentru serotipurile DENV 1, 2 și 3, a fost utilizat MAb 4E11 (1: 1000), în timp ce DENV4 a fost incubat cu MAb 5H2 (1: 500). Celulele au fost spălate de 3 ori în PBS-T și incubate cu anticorp secundar anti-IgG uman (1: 2000) conjugat cu un fluorofor 800. Celulele au fost spălate în PBS-T de 3 ori și plăcile au fost lăsate să se usuce complet înainte de vizualizare și imagistică au fost efectuate pe aparatul Odyssey CLx.
2.6. Fabricare și aplicație nanopatch
Nanopatchurile de siliciu (NP, 4 mm 2, 21.000 proiecții/cm 2 la 110 μm în lungime) au fost fabricate la Melbourne Center for Nanofabrication, așa cum a fost descris anterior de Jenkins și colab. [23]. Vaccinul și adjuvantul au fost formulate cu o soluție de 1% meticeluloză și 1% trehaloză sub un jet de azot, așa cum este descris de Chen și colab. [24]. Morfologia și îndepărtarea stratului de acoperire au fost caracterizate prin microscopie electronică cu scanare (SEM) (Joel Neoscope, Toyko, Japonia), așa cum este descris de Crichton și colab. [11]
2.7. Eficiența livrării vaccinului
Pentru a determina doza administrată de piele prin nanopatch, am efectuat un test de trasare de 14 C, așa cum este descris de Fernando și colab. (2012) [12].
2.8. Studiu de imunizare
Regimul de imunizare s-a bazat pe studii similare efectuate investigând vaccinurile dengue candidate la modelele de șoareci. În sedarea clorhidratului de ketamină (Ceva Animal Health, Glenorie, Australia) și clorhidratului de xilazină (Troy Laboratories, Gendenning, Australia), șoarecii SV129 au fost imunizați cu 1 sau 0,1 μg sE tetravalent (DENV1: 258848, DENV2: PR159, DENV3: CH53489, D: H241 produs din celule S2, donat de către prof. Mathew Cooper, formulare UQ) prin nanopatch sau 1-10 μg sE tetravalent prin injecție intradermică (ID), subcutanată (SC) sau intra musculară (IM), cu sau fără 3 μg de adjuvantul saponinei Quil-A (Brenntag, Essen, Germania). Grupurile de control au primit PBS administrat prin fiecare metodă de injectare investigată, în timp ce grupurile de control cu nanopatch au primit doar excipienți. Nanopatch-urile care conțin doza care trebuie administrată au fost aplicate pe fiecare pinna urechii ventrale folosind un aplicator brevetat la o viteză de 3,1 ms -1 și ținute pe loc timp de 2 minute. Șoarecii au primit trei doze prin nanopatch sau SC, ID sau injectare IM la intervale de 28 de zile, cu probe de sânge recoltate cu o zi înainte de vaccinare și 28 de zile după doza finală.
2.9. Studiul provocării DENV
Șoarecii AG129 au primit 3 doze, la 4 săptămâni distanță, de 1 pg de sE tetravalent administrat prin nanopatch sau injecție ID, așa cum este descris mai sus. Grupurile naive și de control al virusului au primit PBS prin injecție ID, în timp ce grupurile de control cu nanopatch au primit doar excipienți. Toți șoarecii AG129 din grupuri au fost provocați la 14 zile după vaccinarea finală cu 1 × 10 4 PFU sau 1 × 10 5 PFU de virus Dengue 2 adaptat la șoarece D220 (donat de prof. Eva Harris, UC Berkeley School of Public Health), cu excepția celor naivi control, care a rămas neinfectat ca control pentru comportamentul și bunăstarea șoarecilor. După provocare, sângerările din vârful cozii au fost colectate zilnic timp de 10 zile și șoarecii au fost monitorizați de două ori pe zi pentru pierderea în greutate și semne de suferință.
2.10. Test imunosorbent legat de enzimă anti-sE IgG
Proteinele subunitate sE ale fiecăruia dintre cele 4 serotipuri de dengue au fost acoperite individual pe plăci Nunc Maxisorp peste noapte la 4 ° C în 50 μL de tampon carbonat-bicarbonat (pH 9,6) la 100 ng/ml. Plăcile au fost apoi blocate timp de 1 oră la temperatura camerei cu 200 μL 1 x diluant seric de lapte (KPL, Inc., Gaithersburg, MD, SUA) cu zaharoză 1%. Probele diluate în serie în tampon de blocare conținând 0,05% PBS/Tween 20 (50 μL) au fost adăugate la plăcile blocate și incubate timp de 1 oră la 37 ° C și apoi spălate de 6 ori în PBS-T. Peroxidaza de capră anti-șoarece (HRP) (50 μL) diluată la 1: 500 în tampon de blocare cu PBS-T a fost adăugată pe plăci și incubată timp de 1 oră la 37 ° C. După această incubare, plăcile au fost spălate de 6 ori în PBS-T apoi dezvoltate folosind 50 μL de 3,3 ', 5,5'-tetrametilbenzidină (TMB) (sisteme ELISA) timp de 10 minute și protejate de lumină. Reacția a fost oprită prin adăugarea a 50 μL de acid fosforic 1 M și absorbția a fost citită la 450 nm.
2.11. NS1 Cuantificare
Cuantificarea NS1 a fost efectuată așa cum a fost descrisă inițial de Young și colab. [25], cu modificări subliniate de Muller și colab. [26].
2.12. Analize statistice
Toate analizele statistice au fost efectuate folosind GraphPad Prism versiunea 6.0f (San Diego, CA, SUA). Analiza comparativă multiplă a fost efectuată utilizând analiza unică a varianței (ANOVA), cu nivelul alfa stabilit la 0,05 și cu un post-test Tukey.
3. Rezultate
3.1. Acoperire și livrare Nanopatch
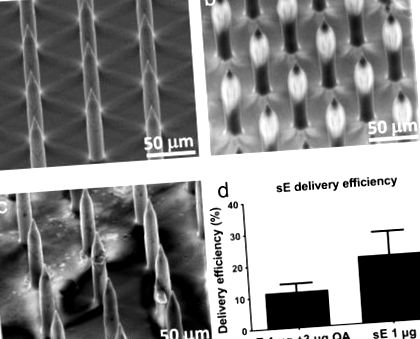
Analiza microscopiei electronice cu scanare (SEM) aA) micronee neacoperite pe suprafața nanopatchului: (b) micro-ace acoperite cu sE; (c) aplicația post-nanopatch, care arată îndepărtarea vaccinului de la vârfurile matricei de microacele. (d) Ca o măsură a eficienței de livrare, un soluție de urmărire de 14 C a fost adăugată la soluția de vaccin pentru a măsura transferul în vrac al învelișului de vaccin nanopatch către ureche. Graficul cu bare reprezintă media a 4–5 eșantioane, cu bare de eroare care indică abaterea standard a mediei. Notă: sE = proteină E secretată.
3.2. Imunizarea sE șoarecilor SV129
Șoarecii imunocompetenți SV129 (linia de șoarece parentală la șoarecii AG129) au fost imunizați de trei ori, la distanță de 21 de zile, cu una din cele două doze de vaccin: fie 1 μg (o doză mixtă de 0,25 μg fiecare serotip), fie 10 μg (2,5 μg din fiecare serotip )) pe imunizare de 0,05 ml, cu și fără Quil-A (3 μg). Dozele de 1 și 10 μg au fost administrate prin injecție intramusculară (IM), intradermică (ID) și subcutanată (SC), cu eliberare nanopatch de doar doza de 1 μg. Diferitele strategii de imunizare au fost comparate pentru inducerea răspunsurilor IgG specifice antigenului (Figura 1 și Figura S1). În general, au fost observate tendințe similare pentru răspunsul imun la toate cele 4 serotipuri DENV (Figura 2 a - d). Vaccinul coformulat pentru a elibera 1 μg sE și 3 μg Quil-A a produs titruri semnificativ mai mari de IgG specific serotipului DENV atunci când a fost administrat prin nanopatch sau injecție ID decât prin aceeași doză administrată prin injecție IM sau SC (Figura S1a - d). Când doza a fost crescută la 10 μg cu 3 μg de Quil-A, șoarecii nu au produs titruri IgG semnificativ mai mari decât doza de 1 μg. Într-adevăr, s-au observat titruri semnificativ mai mici, sugerând posibilitatea unor doze mari de suprimare a răspunsului imun indus de sE.
- Mască coronavirus pentru piele uscată N95 KN95, un aparat de protecție pentru protecția împotriva virusului și sănătatea personală, cumpărați un
- Acid glicolic și alți acizi - Irina Organic Skin Care
- Scrub DIY pentru cafea și miere pentru o piele netedă și strălucitoare
- Produse de îngrijire a pielii fermificatoare Sephora
- Rețetă DIY Detox Body Wrap pentru autoritatea organică a pielii de vară radiantă