Kourosh Kalantar-Zadeh
† Școala de inginerie chimică, Universitatea din New South Wales, Kensington, New South Wales 2052, Australia
Stephanie A. Ward
‡ Departamentul de Medicină Geriatrică, Spitalul Price of Wales, Randwick, New South Wales 2031, Australia
§ Center for Healthy Brain Aging, University of New South Wales, Kensington, New South Wales 2052, Australia
Kamyar Kalantar-Zadeh
∥ Harold Simmons Center for Kidney Disease Research and Epidemiology, Division of Nephrology and Hypertension, University of California Irvine Medical Center, 101 The City Drive, City Tower, Suite 400, Orange, California 92868, Statele Unite
⊥ Secția de Nefrologie, Centrul medical pentru probleme veterane Tibor Rubin, 5901 E Seventh Street, Long Beach, California 90822, Statele Unite
Emad M. El-Omar
# Microbiome Research Centre, St George and Sutherland Clinical School, University of New South Wales, Sydney, New South Wales 2052, Australia
Abstract
Impactul modelelor dietetice și a microbiomului comensal asupra susceptibilității și severității infecției cu virusul coronavirus 2 (SARS-CoV-2) a sindromului respirator acut sever a fost ignorat până în prezent. În această perspectivă, prezentăm o justificare pentru o nevoie urgentă de a investiga acest posibil impact și opțiunile terapeutice pentru COVID-19 pe baza modificărilor dietetice și microbiomului. Este evidențiat rolul atenuant al nanotehnologiei în raport cu impactul virusului SARS-CoV-2.
Sindromul respirator acut sever coronavirus 2 (SARS-CoV-2) este un coronavirus nou care cauzează boala coronavirusului 2019 (COVID-19). De la prima sa detectare în decembrie 2019, a afectat milioane de oameni din întreaga lume, având o rată a mortalității mult mai mare decât orice gripă obișnuită. Deși există o nevoie urgentă de tratament eficient bazat pe antivirale și vaccinuri, este imperativ să se exploreze orice alte strategii de intervenție eficiente care pot reduce ratele de mortalitate și morbiditate ale acestei boli.
Poate fi posibil să căutați în intestin o soluție sau o atenuare a infecției cu SARS-CoV-2. Ecosistemul microbiotei intestinale și comensale poate regla și regla prin invadarea virușilor, facilitând fie efecte stimulatoare, fie supresive. 1 Prin urmare, este plauzibil să se ia în considerare dacă intestinul și interacțiunea SARS-CoV-2 pot juca roluri semnificative în intensitatea infecției și în rezultatele sale clinice.
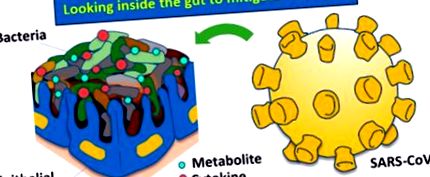
Integritatea microbiomului intestinal (genomii colectivi ai diverselor microbiote care locuiesc în tractul gastrointestinal al oamenilor) ar putea fi deranjată de SARS-CoV-2, provocând disbioză intestinală în gazdă (Figura Figura 1), ca și în cazul altor infecțioase. boli. Există semne care pot conecta funcționalitatea intestinului și răspunsurile microbiomului la SARS-CoV-2. De exemplu, perioada de incubație pentru SARS-CoV-2 este de obicei de 5-6 zile, în timp ce perioada medie de incubație pentru gripă este de 2 zile, 2 și diareea poate fi o caracteristică prezentă la pacienții cu SARS-CoV-2. 3 Noi cercetări arată că SARS-CoV-2 poate fi răspândit prin transmisie fecală - orală. 4 Cea mai mare mortalitate și morbiditate prin SARS-CoV-2 este la vârstnici și la cei cu probleme de sănătate care sunt asociate cu inflamația și alte tulburări, cum ar fi diabetul. 5 Interesant este faptul că aceste cohorte tind să aibă microbiomi intestinali mai puțin diferiți. 6
Homeostaza versus posibile mecanisme de disbioză prin infecția cu virusul SAR-CoV-2.
Legăturile dintre microbiomul intestinal și declinul sănătății legate de vârstă au fost prezentate în mod constant. 7 Îmbătrânirea este asociată cu schimbări semnificative în diversitatea microbiomului și stări pro-inflamatorii. Microbiomul în vârstă arată, în general, o mutare de la Firmicutes, care domină la adulții mai tineri, spre genuri precum Alistipes și Parabacteroides. 8 O variabilitate interindividuală puternică a fost caracterizată la microbiomul intestinal în vârstă, cu fluctuații cu Faecalibacterium și Ruminococcus, precum și anumite clustere de Clostridium, în special IV și XIVa. Acestea pot explica, în parte, diferitele efecte ale infecțiilor virale la persoanele în vârstă.
Există, de asemenea, tendințe specifice în schimbările microbiomului care sunt observate la pacienții astmatici și diabetici. Interesant este faptul că astmul bronșic pare să fie subreprezentat printre comorbidități la pacienții cu afecțiuni critice infectați cu SARS-CoV-2. 9 În astmul sever, controlul astmului și neutrofilia sputei sunt asociate cu Proteobacteria phylum relevante pentru agenții patogeni precum Escherichia, Salmonella, Vibrio și Helicobacter. 10 În plus, în boala obstructivă cronică a căilor respiratorii, filul Bacteroidetes (de exemplu, Prevotella) este scăzut. 10 În schimb, numărul Prevotellaceae producătoare de H2 (de exemplu, Prevotella) a fost foarte îmbogățit la persoanele obeze predispuse la diabetul de tip II. 11 În plus, sa demonstrat că o abundență de Bifidobacterii (care pot produce butirat) la pacienții cu diabet zaharat de tip II îmbunătățesc toleranța la glucoză. 12 În legătură cu această problemă, ar trebui acordată atenție rapoartelor interesante, dar limitate, referitoare la abundența Prevotella în seturile de date secvențiale ale pacienților cu COVID-19. 13−15
Un pas esențial pentru înțelegerea efectului intestinului asupra SARS-CoV-2 este identificarea principalelor specii de microbiomi intestinali care interacționează cu acest virus. În acest sens, posibilitatea ca SARS-CoV-2 să poată interacționa cu una sau mai multe dintre cele 1500 de specii de microbiote din intestin face ca problema să fie complicată. Ca atare, fără studii umane, este imposibil să se facă referire la vreo specie specifică care influențează patogeneza SARS-CoV-2. Cu toate acestea, este posibil să se ia în considerare ipoteza interacțiunii intestinale a SARS-CoV-2 pe baza dovezilor anterioare. Multe căi directe sau indirecte de microbiomi ar putea contribui la interacțiunile SARS-CoV-2-intestinale. Având în vedere inflamația pulmonară observată la pacienții cu SARS-CoV-2 în a doua săptămână de infecție, pot fi luate în considerare ambele căi directe sau indirecte. Suprimarea directă sau promovarea infecției virale de către microbiom poate avea loc prin diferite mecanisme, cum ar fi recombinarea genetică, modificarea stabilității virionului, determinarea proliferării celulelor, simularea atașamentului la celulele permisive și contribuirea la suprimarea replicării virale; promovarea infecției virale poate apărea prin inducerea răspunsurilor imune locale imunoregulatoare și perturbatoare ale sistemelor. 1
Deși rapoartele privind promovarea bacteriilor virale directe și indirecte pentru virusurile gripale sunt rare, exemple de suprimare observată sunt multiple. Speciile Lactobacillus, ca urmare a fermentației carbohidraților, pot produce acid lactic, iar modificările de pH care rezultă din acestea inactivează diferiți viruși. 1 Integritatea celulelor epiteliale din intestin este importantă, deoarece acestea produc compuși antivirali care sunt ostili virușilor. Funcționalitatea celulelor epiteliale colonice se bazează în mare parte pe prezența luminală a butiratului ca sursă de energie, iar principalele bacterii producătoare de butirat din intestin aparțin filului Firmicutes.
Până în prezent, nu a fost raportat niciun studiu care să identifice speciile de microbiote care interacționează cu SARS-CoV-2. Luând în considerare discuția prezentată, strategiile nutriționale și dietetice îndreptate spre restabilirea binecunoscutului microbiotă benefică, care poate suprima infecția virală la vârstnici și la cei cu probleme de sănătate care stau la baza acestora, poate fi o strategie eficientă pentru a atenua efectele nocive ale acestui virus.
Important, Prevotella a fost văzută din abundență în probele clinice ale pacienților infectați cu SARS-CoV-2, 11-13, iar interpretarea rolului său este provocatoare și neclară. Încă nu se știe dacă Prevoltella devine abundentă ca o consecință a modulației virale sau, dimpotrivă, modulează SARS-CoV-2. Nu este clar dacă această abundență de Prevotella se datorează unor modele dietetice de lungă durată sau provine din modularea microbiomului după invazia virusului. În funcție de prezența Prevotella ar trebui amplificată sau suprimată, ar putea fi aleasă acțiunea terapeutică adecvată. Studiile anterioare sugerează că dietele bogate în grăsimi cresc abundența Prevotella, în timp ce dietele pe bază de plante și alimentele fermentate au ca rezultat opusul. 18
Viziunea pentru viitoarele abordări de cercetare
Asocierile dintre efectele dietetice și microbiomice și susceptibilitatea la infecție și severitatea bolii ar trebui să fie investigate cu diferite metodologii. Strategia generală ar trebui să implice studii internaționale de mari dimensiuni, cu putere adecvată, care recrutează pacienți cu COVID-19 și controale pentru a colecta date clinice, evaluări dietetice detaliate, genetică gazdă, fenotipare imună și markeri multi-site multiomici ai microbiomilor. Abordarea internațională ar permite includerea populațiilor din diferite regiuni cu medii diferite, diferite tipare dietetice și expuneri la mediu. Această abordare cuprinzătoare și colaborativă este esențială pentru dezlegarea factorilor determinanți ai rezultatelor clinice ale acestei infecții și pentru proiectarea măsurilor terapeutice și preventive. Efectele moderatoare ale alimentelor bogate în fibre (în special alegerea tipului de alimente bogate în fibre), proaspăt fermentate și ale diverselor alimente ar trebui, de asemenea, examinate ca măsuri preventive și atenuante.
Acțiuni permise de nanotehnologie
Note
Autorii nu declară niciun interes financiar concurent.
- Suplimentarea dietei, probiotice și nutraceutice în infecția cu SARS-CoV-2 O analiză a scopului;
- Dieta de post ar putea să vă facă mai susceptibil la infecție
- Efectele unei diete nordice sănătoase asupra concentrației plasmatice de 25-hidroxivitamină D la subiecții cu
- Pastile de dieta subțire Cheetah Efecte secundare 2020 Dr Oz 14 zile Produse speciale K pentru slăbire rapidă pentru
- Frontierele Dieta fenilcetonuriei promovează schimbări în populațiile Firmicutes celulare și infecții