Fredrik Bäckhed
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Korea Advanced Institute of Science and Technology, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Hao Ding
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică, și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Institutul avansat de știință și tehnologie din Coreea, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Ting Wang
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Korea Advanced Institute of Science and Technology, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Laura V. Hooper
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Korea Advanced Institute of Science and Technology, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Gou Young Koh
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Institutul avansat de știință și tehnologie din Coreea, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Andras Nagy
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Institutul avansat de știință și tehnologie din Coreea, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Clay F. Semenkovich
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Institutul avansat de știință și tehnologie din Coreea, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Jeffrey I. Gordon
* Centrul de Științe ale Genomului și Departamentele de † Biologie Moleculară și Farmacologie, ∥ Genetică și §§ Medicină, Biologie celulară și Fiziologie, Washington University School of Medicine, St. Louis, MO 63110; § Institutul de cercetare Samuel Luenfeld, Spitalul Mount Sinai, Toronto, ON, Canada M5G 1X5; †† Centrul biomedical, Departamentul de Științe Biologice, Institutul avansat de știință și tehnologie din Coreea, Daejeon, 305-701, Republica Coreea; și ‡ ‡ Departamentul de Genetică Medicală și Microbiologie, Universitatea din Toronto, Toronto, ON, Canada M5S 1A8
Disponibil gratuit online prin opțiunea de acces deschis PNAS.
Date asociate
Abstract
Acum există> 500 de milioane de oameni adulți în lume care sunt supraponderali [indicele de masă corporală (IMC) de 25,0-29,9 kg/m 2] și 250 de milioane care sunt obezi (IMC ≥ 30 kg/m 2) (1). Această epidemie în creștere amenință atât țările industrializate, cât și țările în curs de dezvoltare și a fost însoțită de creșteri la nivel mondial ale tulburărilor legate de obezitate, inclusiv diabet de tip II, hipertensiune arterială, patologie cardiovasculară și boli hepatice nealcoolice. În Statele Unite, 64% dintre adulți sunt supraponderali sau obezi (2), determinându-l pe chirurgul general să desemneze această afecțiune drept cea mai importantă provocare de sănătate publică a timpului nostru (3). Majoritatea oamenilor nu sunt în măsură să facă modificări alimentare intenționate, pe tot parcursul vieții, necesare pentru controlul greutății (4). Prin urmare, dezvoltarea alimentelor sau identificarea de noi ținte terapeutice care produc reduceri necognitive ale aportului total de energie, absorbție sau stocare are o importanță considerabilă pentru sănătatea publică.
Intestinul uman conține un număr imens de microorganisme, cunoscute colectiv sub numele de microbiota. Această comunitate este formată din cel puțin 10 13 cetățeni, este dominată de bacterii anaerobe și include aproximativ 500-1000 de specii ale căror genomi colectivi sunt conținuți de 100 de ori mai multe gene decât propriul nostru genom uman (5, 6). Microbiota poate fi privită ca un „organ” metabolic acordat în mod deosebit fiziologiei noastre, care îndeplinește funcții pe care nu a trebuit să le dezvoltăm singure. Aceste funcții includ capacitatea de a procesa componente altfel nedigerabile ale dietei noastre, cum ar fi polizaharidele plantelor. Definirea căilor de semnalizare a gazdei reglementate de microbiotă oferă o oportunitate de a identifica noi ținte terapeutice pentru promovarea sănătății. În studiul actual, folosim șoareci gnotobiotici normali și genetici pentru a aborda ipoteza că microbiota acționează printr-o cale integrată de semnalizare a gazdei pentru a regla stocarea energiei în gazdă.
Materiale și metode
Șoarecii WT și knockout crescuți în mod convențional (CONV-R) au fost rederiviți fără germeni (GF) așa cum este descris (8). Animalele GF au fost menținute în izolatoare gnotobiotice (8), în cadrul unui ciclu de lumină strict de 12 ore (luminile aprinse la ora 0600) și au fost hrănite ad libitum cu o dietă chow autoclavată (B&K Universal, East Yorkshire, UK). Toate manipulările șoarecilor au fost efectuate utilizând protocoale aprobate de Comitetul pentru Studii pe Animale de la Washington University.
Colonizarea șoarecilor GF. Conținutul de cecal al fiecărui șoarece CONV-R în vârstă de 8 săptămâni a fost resuspendat în 10 ml de PBS steril și alicote de 2 ml au fost împrăștiate pe blana primitorilor de GF în vârstă de 7 până la 10 săptămâni. Șoarecii convenționați (CONV-D) rezultați au fost adăpostiți în izolatori gnotobiotici timp de 10-28 zile în aceleași condiții și au fost hrăniți cu aceeași dietă ca și omologii lor GF.
Animalele CONV-R au fost menținute în cuști de microizolatoare într-o stare specifică fără patogeni într-o instalație de barieră din dieta B&K autoclavată. Au fost transferați la izolatori gnotobiotici cu 2 săptămâni înainte de a fi uciși la vârsta de 8-10 săptămâni pentru a imita condițiile de adăpostire a șoarecilor GF și CONV-D.
Șoarecii GF în vârstă de opt până la 10 săptămâni au fost gavați oral cu 10 9 tulpina Betaoides thetaiotaomicron VPI-5482. Densitatea colonizării în intestinul distal, cec și colon a variat de la 10 8 până la 10 11 unități formatoare de colonii/ml conținut luminal, așa cum este definit prin cultivarea probelor de conținut luminal pe agar de sânge BHI timp de 2-3 d la 37 ° C sub anaerob condiții.
Măsurarea conținutului total de grăsime corporală și a ratei metabolice (consum de oxigen). Conținutul total de grăsime corporală a fost determinat la 5 minute după ce șoarecii au fost anesteziați cu un i.p. injectarea de ketamină (10 mg/kg greutate corporală) și xilazină (10 mg/kg). A fost descris protocolul folosit pentru absorptiometria cu raze X cu energie duală (Lunar PIXImus Mouse, GE Medical Systems, Waukesha, WI) (9).
Consumul de oxigen a fost determinat la șoareci conștienți, cușcați individual, în stare alimentată, utilizând calorimetrie indirectă în circuit deschis (sistem Oxymax cu o singură cameră cu animale mici, Columbus Instruments, Columbus, OH). Animalelor li s-a permis să se adapteze la camera metabolică timp de 20 de minute înainte ca VO2 să fie măsurat la fiecare 30 s timp de 1 oră.
Testele lipoproteinelor lipazice (LPL). Activitatea LPL în tampoanele de grăsime epididimale a fost determinată în conformitate cu ref. 11. Pentru detalii, consultați Materiale și metode de sprijin.
Statistici. Diferențe semnificative statistic au fost determinate prin utilizarea testelor t ale Studentului. Comparațiile între mai mult de două grupuri de șoareci au fost făcute de un ANOVA unidirecțional, urmat de testul de comparație multiplu post-hoc al lui Tukey.
Rezultate si discutii
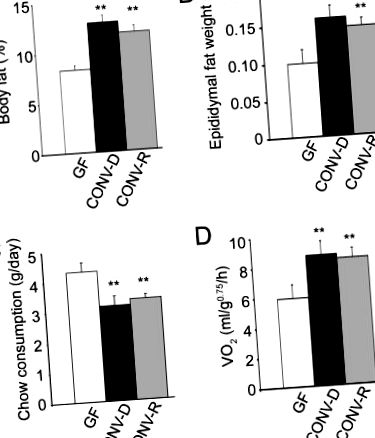
Introducerea unei microbiote intestinale în șoarecii adulți GF produce o creștere rapidă a conținutului de grăsime corporală în ciuda consumului redus de Chow. Comparațiile șoarecilor masculi B6 de 8 până la 10 săptămâni crescuți în absența oricărui microorganism (GF) cu șoareci care adăposteau o microbiotă începând de la naștere (CONV-R) au relevat că animalele CONV-R conțin 42% mai multă grăsime corporală, așa cum este definit de absorptiometria cu raze X cu energie duală (Fig. 1A). Greutățile tamponului de grăsime epididimale au fost, de asemenea, semnificativ mai mari (47%; Fig. 1B). Nivelurile mai ridicate de grăsime corporală observate la animalele CONV-R sunt interesante, dat fiind că consumul zilnic al unei diete standard de rozătoare (57% carbohidrați, 5% grăsime) a fost cu 29% mai mic decât omologii lor GF (Fig. 1C).
O creștere similară a conținutului total de grăsime corporală a fost observată după o convenționalizare mai scurtă, de 10 zile (66%; P> 0,05 comparativ cu 14 zile). O convenționalizare mai prelungită (28 de zile) nu a produs creșteri suplimentare ale conținutului total de grăsime corporală sau al greutății epididimale a grăsimii (datele nu sunt prezentate). Stocarea crescută a grăsimilor produsă printr-o convenționalizare de 14 zile s-a produs și în fața consumului scăzut de chow (cu 27% mai mic decât GF; Fig. 1C).
Leptina este un hormon derivat din adipocite a cărui expresie se corelează cu conținutul de lipide adipocitare (14). Mai mult, se știe că leptina reduce consumul de alimente și crește consumul de energie la șoareci (15). Nivelurile de leptină cresc după colonizare (Fig. 2A). Creșterea este proporțională cu creșterea grăsimii corporale (r 2 = 0,977).
Microbiota îi indică pe gazdă să crească producția hepatică de trigliceride. Glucoza și insulina sunt cunoscute pentru a induce expresia enzimelor lipogene în ficat (16). O convenționalizare de 14 zile a șoarecilor GF a produs o creștere de 2,3 ori a conținutului de trigliceride hepatice (Fig. 3 A și B), dar nu au existat modificări apreciabile în totalul acizilor grași liberi din ficat sau colesterol (P> 0,05; datele nu sunt prezentate). Testele qRT-PCR au confirmat că convenționalizarea a fost însoțită de creșteri semnificative statistic ale mARN-urilor hepatice care codifică două enzime cheie în calea biosintetică a acidului gras de novo, acetil-CoA carboxilaza (Acc1) și acidul gras sintetaza (Fas) (Fig. 3C).
Testele qRT-PCR au dezvăluit că convenționalizarea șoarecilor adulți GF a suprimat expresia Fiaf în intestinul lor subțire (ileon), dar nu și în ficat sau grăsime albă (Fig. 4D). Studiile ulterioare qRT-PCR privind captarea cu laser a criptei intestinale microdisecate și a epiteliului villus și a mezenchimului villus, au stabilit că supresia microbiană a Fiaf are loc în celulele epiteliale ale vilozității diferențiate (datele nu sunt prezentate).
Împreună, aceste descoperiri sugerează că microbiota acționează pentru a stimula producția de trigliceride hepatice prin efecte mediate de factori de transcripție, cum ar fi ChREBP și pentru a promova încorporarea direcționată de LPL a acestor trigliceride în adipocite prin suprimarea transcripțională a unei gene epiteliale intestinale care codifică un inhibitor LPL circulant. Am testat această ipoteză generând șoareci cu o alelă Fiaf nulă (Fig. 4E) și redirecționându-i ca GF.
Șoarecii masculi GF Fiaf -/- în vârstă de opt săptămâni au o activitate LPL cu un conținut de grăsimi epididimale cu 67% mai mare decât colegii de așternut GF care conțin alela WT Fiaf (P 0,05; n = 10 animale).
GF Fiaf -/- animalele au aceeași cantitate de grăsime corporală totală ca și colegii de așternut WT CONV-D (suprimate de Fiaf) WT (12,8 ± 1,1% din greutatea corporală comparativ cu vârsta și sexul) (14,2 ± 1,9, P> 0,05). Mai mult decât atât, o convenționalizare de 14 zile a animalelor cu deficiență de GF deja deficiente în Fiaf a produs doar creșteri minore ale grăsimii corporale totale (creștere de 10 ± 8% față de 55 ± 16% creștere a colegilor WT; Fig. 4F) Fiaf +/- heterozigoții au avut o creștere intermediară (33 ± 12%). Aceste rezultate stabilesc importanța Fiaf ca un mediator proeminent al reglării microbiene a depozitării periferice a grăsimilor.
Vedere schematică a modului în care microbiota intestinală afectează depozitarea grăsimii. Microbiota acționează prin Fiaf pentru a coordona creșterea lipogenezei hepatice cu o activitate LPL crescută în adipocite, promovând astfel stocarea în grăsimi a caloriilor recoltate din dietă. Consultați textul pentru detalii suplimentare.
Material suplimentar
Mulțumiri
Mulțumim lui David O'Donnell, Maria Karlsson, Jill Manchester, Sabrina Wagoner, Trey Coleman și Xiaoli Wu pentru asistență tehnică și lui John Rawls, Peter Kang, Peter Crawford și Justin Sonnenburg pentru sfaturi utile. Această lucrare a fost susținută parțial de Institutele Naționale de Granturi în Sănătate DK30292, DK56341 și HL58427 și de Institutul Canadian de Cercetare în Sănătate. F.B. este beneficiarul unei burse postdoctorale de la Fundația Wenner-Gren.
Note
Contribuțiile autorului: F.B., C.F.S. și J.I.G. cercetare proiectată; F.B., H.D. și L.V.H. cercetări efectuate; F.B., H.D., G.Y.K. și A.N. a contribuit cu noi reactivi/instrumente analitice; F.B., T.W., A.N., C.F.S. și J.I.G. date analizate; F.B. și J.I.G. a scris ziarul.
Abrevieri: GF, fără germeni; Fiaf, factor adipocitar indus de post; B6, C57BL/6J; PPAR, receptor al proliferator-activator al peroxizomului; CONV-R, ridicat în mod convențional; CONV-D, convenționalizat; qRT-PCR, RT-PCR cantitativ; LPL, lipoproteină lipazică; Acc1, acetil-CoA carboxilaza; Fas, acizi grași sintaza; SREBP-1, proteina 1 care leagă elementul de răspuns la steroli; ChREBP, proteina de legare a elementului de răspuns la carbohidrați.
Depunerea datelor: Secvențele raportate în această lucrare au fost depuse în baza de date GenBank (numere de acces AY667702-AY668946).
- Succesul pierderii în greutate este determinat de două specii de microbiote intestinale
- Funcțiile și valorile zonelor umede Departamentul de protecție a apelor de suprafață și subterane
- Reducerea greutății ambalajelor va reduce impactul asupra mediului - companie
- Subalimentarea și antibioticele modifică microbiota intestinală și afectează absorbția nutrienților
- Lista actualizată a revistelor de medicină nutrițională High Journal Impact Factor