Thomas S. Griffith
1 Departamentele de Urologie și Medicină și Patologie de Laborator, Universitatea din Minnesota, Minneapolis, MN 55455
Thomas A. Ferguson
2 Departamentul de Oftalmologie și Științe Vizuale, Washington University School of Medicine, St. Louis, MO 63110
rezumat
Sistemul imunitar al mamiferelor se confruntă continuu cu moartea sub forma propriilor sale celule moarte și pe moarte care apar în timpul schimbării normale a țesuturilor, infecții, leziuni celulare și cancer. Atunci trebuie luate decizii complexe care să permită un răspuns protector la agenții patogeni, distrugând în același timp tumorile, dar fără a ataca sistemele vitale ale gazdei care ar putea duce la autoimunitate. Folosind o tehnică de investigație denumită „5W” (cine, ce, când, unde și de ce) vom examina modul în care sistemul imunitar răspunde la antigenii generați prin moartea celulară. Această analiză ne va oferi o mai bună înțelegere a diferențelor moleculare fundamentale pentru moartea celulelor tolerogene sau imunogene, a celulelor care simt și reacționează la celulele moarte și a consecințelor acestor elemente fundamentale asupra menținerii sau abrogării toleranței.
Introducere
„Cine moare”: Caracteristicile celulei pe moarte
„Ce eliberează”: factori tolerogeni și imunogeni produși de celulele pe moarte
S-au propus mai multe mecanisme pentru a explica potențialul tolerogen și imunogen intrinsec al celulelor moarte, inclusiv elaborarea de citokine, DAMP și alte proteine celulare. Limfocitele apoptotice produc citokinele imunosupresoare IL-10 (Gao și colab., 1998) și TGF-β (Chen și colab., 2001) pe măsură ce mor. În schimb, DAMP, cum ar fi HMGB1 (Kazama și colab., 2008; Scaffidi și colab., 2002), proteine de șoc termic (de exemplu, HSP70) (Millar și colab., 2003), acid uric (Shi și colab., 2003), ADN-ul mamiferelor, ARN-ul, IFN-α, (Matzinger, 2002) și CD154 (Gurung și colab., 2009), eliberate de celulele moarte sunt imunogene. Recunoașterea DAMP-urilor (de exemplu, HMGB1) de către receptorii de recunoaștere a modelelor (PRR), cum ar fi receptorul pentru produsele finale de glicație avansată (RAGE) sau receptorii de tip toll (TLR), se crede că maturizează DC-urile și stimulează imunitatea (Bianchi, 2007). În plus, celulele necrotice pot activa inflamația (imunitatea), după cum se arată prin scindarea caspazei 1 și eliberarea IL-1β și IL-18 mature (Lamkanfi și Dixit, 2010; Li și colab., 2009). Astfel, diferitele mecanisme ale morții, împreună cu producerea și/sau eliberarea diferitelor molecule pro și antiinflamatorii, ca urmare a procesului de moarte, contribuie la decizia dacă toleranța imunologică sau imunitatea este inițiată împotriva antigenilor asociați cu morții. celule.
„Când moare”: Influența momentului morții celulare asupra toleranței și imunității
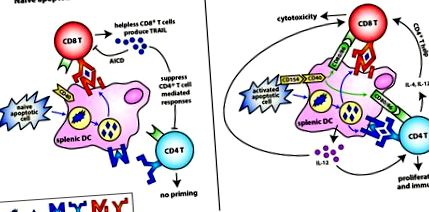
După cum sa menționat mai devreme, starea de activare a celulei atunci când aceasta moare (în special celulele T) poate influența dramatic imunogenitatea sau tolerogenitatea acesteia. Celulele T activate anti-CD3 exprimă CD154, care poate schimba o celulă T apoptotică naivă tolerogenă normală într-un stimulator imunitar puternic (Gurung și colab., 2009). În aceste studii, expresia CD154 a indus producția DC de IL-12 și a dus la imunitate. Această observație contrastează cu natura tolerogenă a celulelor T care suferă AICD (Gurung și colab., 2010; Herndon și colab., 2005). Poate devreme în timpul activării imune, echilibrul dintre CD154 + și celulele CD154 - T dictează soarta răspunsului. De exemplu, în timpul unei infecții acute, numărul mare de celule T care exprimă CD154 poate ajuta la menținerea unui prag ridicat de inflamație și a răspunsurilor imune necesare pentru eliminarea agentului patogen. Cu toate acestea, în timpul AICD, care apare spre încheierea unui răspuns imun, celulele T nu mai pot exprima CD154 și rezultă toleranță. Acest lucru permite îndepărtarea celulelor reactive și suprimarea potențialelor răspunsuri imune anti-auto. Figura 1 este o reprezentare a efectelor diferențiale ale naivului vs. celulele T apoptotice activate asupra răspunsului imun. Trebuie remarcat faptul că această toleranță este relativ scurtă (
60 d) și sistemul poate răspunde apoi provocării viitoare a antigenului (Gurung și colab., 2010). Rămâne de stabilit dacă memoria imunologică apare în această situație.
Stânga: Inducerea toleranței de către celulele T apoptotice naive. Celulele T apoptotice naive sunt preluate de DC, care rămân într-o stare imatură. Antigenele derivate din aceste celule T apoptotice sunt prezentate încrucișat pe MHC clasa I la celule T CD8 + în absența moleculelor costimulatoare și a celulelor T CD4 +. Aceste celule T „neputincioase” CD8 + reglează în sus expresia TRAIL și apoi trec la suprimarea răspunsurilor imune ulterioare mediate de celulele T CD4 +. Dreapta: Inducerea imunității de către celulele T apoptotice activate. Celulele T apoptotice activate care exprimă CD154 activează DC-urile pentru reglarea în sus a moleculelor costimulatoare (CD80, CD86) și produc citokine proinflamatorii precum IL-12. Antigenele derivate din celulele T apoptotice activate sunt prezentate încrucișat pe MHC clasa I și direct prezentate pe MHC clasa II pe DC maturate, rezultând amorsarea atât a celulelor T CD8 +, cât și a CD4 +. În consecință, citokinele proinflamatorii și celulele CD4 + T permit celulelor T CD8 + să se diferențieze complet în CTL efector în loc de celule Treg CD8 + „neputincioase”, care exprimă TRAIL.
O altă considerație este stadiul morții celulare „Când” cadavrele întâlnesc sistemul imunitar. Îndepărtarea rapidă a celulelor apoptotice timpurii previne stimularea imunitară și eșecul eliminării celulelor moarte poate duce la autoimunitate (Asano și colab., 2004; Hanayama și colab., 2004; Ip și Lau, 2004). Celulele apoptotice trebuie recunoscute și eliminate imediat pentru a evita scurgerile potențiale ale conținutului citoplasmatic inflamator. Când celulele moarte întâmpină DC foarte devreme în procesul de moarte celulară (12 ore; de asemenea necroză secundară), deoarece pot scurge HMGB1 (Scaffidi și colab., 2002). Pentru o tolerogenitate optimă, DC-urile trebuie să întâlnească cadavre apoptotice la aproximativ 4-8 ore după inducerea morții, probabil acest lucru se datorează necesității activării caspazei, expresiei semnalelor „Găsește-mă și mănâncă” și modificării DAMP prin ROS.
„Unde moare”: Influența localizării anatomice a morții asupra imunității și toleranței
În timp ce multe studii care investighează absorbția celulelor apoptotice și influența lor asupra funcției imune s-au concentrat asupra Mϕ (Miyake și colab., 2007), DC-urile pot fagocita celulele apoptotice (Albert și colab., 2001), iar celulele apoptotice cu siguranță pot suprima producția de DC a citokine proinflamatorii precum IL-12 (Kim și colab., 2004). De aceea, este esențial să se ia în considerare regiunea corpului „Unde” celulele moarte sunt înghițite, deoarece Mϕ și DC sunt concentrate preferențial în diferite locații anatomice. De exemplu, absența zonei marginale splenice Mϕ întârzie eliminarea celulelor apoptotice și promovează imunitatea prin prezentarea antigenului DC (Miyake și colab., 2007), poate prin copleșirea DC imunostimulatoare cu resturi celulare. De asemenea, este bine stabilit că celulele cuplate cu antigen injectate intravenos induc o stare de toleranță imună (Battisto și colab., 1980; Conlon și colab., 1980) printr-un proces care implică apoptoza celulelor injectate (Ferguson și colab., 2002 ).). Cu toate acestea, injectarea subcutanată a acelorași celule induce imunitate (Greene și Benacerraf, 1980), iar majoritatea studiilor de apoptoză imunogenă implică injectarea pe această cale. Injecția subcutanată a celulelor duce la înghițirea lor de DC derivate din piele care în cele din urmă traficează către LN pentru a induce un răspuns imun. Acest lucru poate imita efectul tumorilor care sunt implantate în locurile subcutanate și care suferă apoptoză după chimioterapie (Apetoh și colab., 2007; Chaput și colab., 2007).
În timp ce jucătorul principal pentru toleranță sau imunitate este DC, nu există studii (din câte știm) care să descrie modul în care semnalele „găsește-mă și mă mănâncă” promovează absorbția DC a celulelor moarte și apoi participă la inducerea toleranței sau imunității. De fapt, în timp ce fagocitoza celulelor moarte de către DC a fost studiată, cerința pentru fagocitoza DC prin intermediul unuia dintre receptorii PS cunoscuți pentru toleranță este, de asemenea, în mare parte neexplorată. Ștergerea receptorului MFG-E8 la șoareci are ca rezultat producerea de autoanticorpi, dar conduce, de asemenea, la ameliorarea încrucișată CD8 + CTL (adică, imunitate) (Peng și Elkon, 2011). Această observație nedumeritoare, precum și rolul semnalelor „găsește-mă și mă mănâncă” pentru toleranță sau imunitate mediată prin DC necesită investigații suplimentare.
De asemenea, este de remarcat faptul că pare să existe o diferență în prelucrarea antigenului intrinsecă la subseturile DC care este asociată cu expresia crescută a proteinelor implicate în procesarea MHC (Dudziak și colab., 2007). CD8α + DC-urile tind să proceseze antigene pentru prezentare prin intermediul moleculelor MHC clasa I, în timp ce CD8α-DC-urile prezintă preferențial antigene prin MHC clasa II. Aceasta sugerează că pentru toleranță imunitatea celulelor T CD4 + poate fi diminuată în timp ce imunitatea celulelor CD8 + T este promovată, rezultând inducția CTL „neajutorată” (vezi mai jos). Într-un studiu, CD8α + DC au preferat fagocitat celulele apoptotice, sugerând din nou un rol tolerogen pentru această subpopulație DC (Iyoda și colab., 2002). Cu toate acestea, există alte date care arată că CD8α DC nu sunt mai bune în fagocitarea celulelor apoptotice decât CD8α - DC (Schnorrer și colab., 2006), sugerând că fagocitoza nu poate fi singurul criteriu pentru toleranță sau imunitate.
Există, de asemenea, o serie de alte consecințe pentru DC după o întâlnire cu celule apoptotice care pot avea implicații pentru tipul de răspuns imun indus. Se acceptă în general că maturarea DC prin interacțiunea cu PAMPS sau DAMP, măsurată prin creșterea MHC clasa II și expresia co-stimulatoare (de exemplu CD80, CD86), este critică pentru inducerea imunității. Mai multe rapoarte au documentat că celulele apoptotice pot preveni maturarea DC menținându-le imature și într-o stare de inducere a toleranței (Albert și colab., 2001; Sauter și colab., 2000). Aceasta este o idee convingătoare, dar trebuie remarcat faptul că acest lucru nu este întotdeauna cazul, deoarece DC-urile mature pot induce, de asemenea, toleranță în urma înghițirii celulelor apoptotice (Ferguson și colab., 2002; Kazama și colab., 2008). Astfel, maturarea simplă nu poate fi factorul determinant și acest lucru poate fi legat de alți factori discutați aici, cum ar fi localizarea DC („Unde”) și proprietățile celulelor apoptotice („Ce”).
„De ce moare”: Influența infecției și deteriorarea țesuturilor
De ce celulele pot avea o influență puternică asupra răspunsului imunitar ulterior, mai ales dacă celulele mor în urma unei infecții. Fagocitoza celulelor apoptotice în prezența liganzilor TLR (PAMP) derivați de la agenți infecțioși poate converti semnalele tolerogene din celulele apoptotice în cele imunogene prin creșterea stării de activare a celulelor fagocitare și modificarea citokinelor inflamatorii pe care le elaborează. De exemplu, celulele apoptotice infectate sunt o componentă critică a semnalelor imune înnăscute care instruiesc diferențierea celulelor Th17 (Torchinsky și colab., 2009), sugerând că agenții patogeni deosebit de adecți la declanșarea apoptozei ar putea induce preferențial imunitatea mediată de celulele T. În mod similar, veziculele apoptotice de la Mϕ infectate cu micobacterii stimulează imunitatea in vivo a celulelor T CD8 +. În acest sistem, veziculele apoptotice au prezentat o activitate adjuvantă puternică prin stimularea protecției împotriva infecției cu M. tuberculosis prin TLR (Winau și colab., 2006). În mod similar, imunitatea celulelor T CD8 + histoplasmatică specifică ar putea fi, de asemenea, indusă de DC-urile care prezintă antigene exogene ale Histoplasmei, fie prin ingestia directă a celulelor de drojdie, fie prin absorbția de antigene fungice apoptotice asociate cu M Lin (Lin și colab., 2005).
„Cum este reglementată imunitatea”: o sinteză a „5W-urilor”
Aceste informații pot fi exploatate în scop terapeutic?
De asemenea, poate fi de dorit să se utilizeze celule apoptotice pentru a stabili în mod deliberat toleranța. Transplantul de organe a apreciat multă vreme potențialul tolerogen puternic al celulelor apoptotice (Kleinclauss și colab., 2003; Kleinclauss și colab., 2006; Li și colab., 2006; Morelli și Larregina, 2010) și este clar că modificările APC funcția și generarea de celule reglatoare are loc la pacienții cărora li se administrează o perfuzie administrată terapeutic de o perfuzie de celule apoptotice. De asemenea, a fost raportată utilizarea celulelor apoptotice pentru a preveni autoimunitatea. Mai exact, injecția intravenoasă de glicoproteină oligodendroglială de mielină (MOG) care exprimă celule apoptotice a redus răspunsurile celulelor T specifice MOG și a împiedicat dezvoltarea encefalomielitei autoimune experimentale (EAE) (Miyake și colab., 2007). Rezultate similare s-au găsit într-un alt model de boală indusă experimental (Smith și Miller, 2006). Utilizarea terapeutică a celulelor apoptotice în acest mod este foarte interesantă, dar este important să ne amintim că celulele apoptotice au fost administrate profilactic (înainte de inducerea EAE) și rămâne de văzut dacă același beneficiu terapeutic ar fi văzut în setări în care autoimunitatea a fost deja stabilită.
Fotofereza extracorporală a fost utilizată clinic de aproape 20 de ani ca terapie aprobată pentru tratamentul limfomului cu celule T cutanate (Dupont și Craciun, 2009). Pentru acest tratament, sângele periferic este tratat ex vivo cu un compus foto-activabil (8metoxipsoralen) și lumină UVA și imediat returnat pacientului. O strategie similară este testată pentru tratamentul grefei vs. boala gazdei (Hannani și colab., 2010). Deși mecanismele nu sunt complet clare, toleranța este considerată a fi rezultatul apoptozei în leucocitele tratate, urmată de absorbția de fagocitele pacientului, ducând la modularea răspunsului imun și la scăderea severității bolii.
Un alt domeniu de potențială intervenție terapeutică este legat de descoperirile recente cu HMGB1 în care starea redox a proteinei determină imunogenitatea acesteia. Când HMGB1 este eliberat din celulele apoptotice, acesta este oxidat și se dezvoltă toleranță la antigenul asociat cu celulele apoptotice. În schimb, atunci când HMGB1 a fost redus prin tratamentul celulelor apoptotice cu anti-oxidanți sau a fost utilizată o formă de HMGB1 care nu a putut fi oxidată (schimbarea HMGB1 cys106 în ser) a promovat imunitatea la același antigen [a se vedea discuția de mai sus și ( Kazama și colab., 2008)]. Deoarece HMGB1 este considerat a media inflamația într-o serie de procese patogene, inclusiv șocul septic (Bianchi, 2007), probabil că acest lucru este legat de starea sa redox. Condițiile oxidative generate în timpul sepsisului (Roth și colab., 2004) pot oxida HMGB1 astfel încât, în prezența celulelor apoptotice, să existe toleranță. Astfel, tratamentul persoanelor imunosupresate cu o formă neoxidabilă de HMGB1 ar putea fi o metodă pentru a depăși imunosupresia indusă de celulele apoptotice care promovează răspunsuri imune adaptive benefice.
Gânduri de încheiere
Fiecare petală reprezintă unul dintre „5W” și conține câțiva dintre factorii luați în considerare în această recenzie. Este important de reținut că orice element dintr-o anumită petală poate fi legat de orice element din celelalte petale, rezultând un număr foarte mare de permutații potențiale. De exemplu, un limfocit (Când) în repaus (Cine) indus să moară în timpul sepsisului (De ce) eliberează IL-10 (ce) și este apoi înghițit de un CD8α + DC splenic (unde) va induce toleranță imună printr-un CD8 + T neajutorat celula care face TRAIL (Cum). Luați în considerare, de asemenea, un alt exemplu: o celulă tisulară normală apoptotică (Când) (Cine) infectată cu un virus (De ce) eliberează HMGB1 (Ce) redus pe măsură ce moare. Celula apoptotică infectată este apoi înghițită de un CD8α + DC în piele (unde), ducând la amorsare încrucișată și activarea imunității mediate CTL specifice virusului (Cum).
Mulțumiri
Această lucrare a fost susținută de National Institutes of Health Grants AI077565 (TSG),> CA109446 (TSG), EY06765 (TAF),> EY015570 (TAF) și EY02687 (Dept. of Oftalmologie și Visual Science Core Grant). Un sprijin suplimentar a fost obținut de la un grant din cadrul Universității din Iowa Carver College of Medicine Research Initiative Grant (TSG), un grant al Departamentului de Oftalmologie și Științe Vizuale de la Research to Prevent Blindness, New York, NY, (TAF) și Macular Vision Research Foundation, West Conshohocken, PA (TAF). Autorii doresc să-și exprime sincere mulțumiri lui Jayoung Choi și Prajwal Gurung pentru proiectarea figurilor.
Note de subsol
Declinarea responsabilității editorului: Acesta este un fișier PDF al unui manuscris neditat care a fost acceptat spre publicare. Ca serviciu pentru clienții noștri, oferim această versiune timpurie a manuscrisului. Manuscrisul va fi supus copierii, compunerii și revizuirii dovezilor rezultate înainte de a fi publicat în forma sa finală citabilă. Vă rugăm să rețineți că, în timpul procesului de producție, pot fi descoperite erori care ar putea afecta conținutul și că toate responsabilitățile legale care se aplică jurnalului se referă.
- Anemie Simptome Semne ale numărului scăzut de celule roșii din sânge
- Studiul celulelor cancerului de sân aruncă o nouă lumină asupra homeopatiei - asistență medicală primară holistică
- Frânarea pentru întreținerea greutății Puteți opri suficient de repede Refuzul de a recâștiga
- Efect antitumoral al rășinii de gumă Ferula assa foetida oleo împotriva cancerului de sân indus de celulele 4T1
- 10 lucruri de făcut după o moarte Everplans