Eugene A. Rogozhin
1 Institutul de Chimie Bioorganică Shemyakin și Ovchinnikov, RAS, ul. Miklukho-Maklaya, 16/10, Moscova 117997, Rusia; ude.hcetsyhp@aphsul (V.A.L.); [email protected] (K.S.M.)
2 Gause Institute of New Antibiotics, ul. Bolshaya Pirogovskaya, 11, Moscova 119021, Rusia; ur.liam@90_avokydas (V.S.S.); ur.tsil@awonarabajna (A.A.B.); ur.xednay@aniram-i (M.L.G.)
Vera S. Sadykova
2 Gause Institute of New Antibiotics, ul. Bolshaya Pirogovskaya, 11, Moscova 119021, Rusia; ur.liam@90_avokydas (V.S.S.); ur.tsil@awonarabajna (A.A.B.); ur.xednay@aniram-i (M.L.G.)
Anna A. Baranova
2 Gause Institute of New Antibiotics, ul. Bolshaya Pirogovskaya, 11, Moscova 119021, Rusia; ur.liam@90_avokydas (V.S.S.); ur.tsil@awonarabajna (A.A.B.); ur.xednay@aniram-i (M.L.G.)
Alexey S. Vasilchenko
3 Universitatea de Stat din Tiumen, str. Volodarskogo nr. 6, Tiumen 625003, Rusia; moc.liamg@oknehclisava (A.S.V.); [email protected] (A.V.V.)
Vladislav A. Lushpa
1 Institutul de Chimie Bioorganică Shemyakin și Ovchinnikov, RAS, ul. Miklukho-Maklaya, 16/10, Moscova 117997, Rusia; ude.hcetsyhp@aphsul (V.A.L.); [email protected] (K.S.M.)
4 Institutul de Fizică și Tehnologie din Moscova, Institutskiy per., 9, Dolgoprudnyi 141701, Rusia
Konstantin S. Mineev
1 Institutul de Chimie Bioorganică Shemyakin și Ovchinnikov, RAS, ul. Miklukho-Maklaya, 16/10, Moscova 117997, Rusia; ude.hcetsyhp@aphsul (V.A.L.); [email protected] (K.S.M.)
4 Institutul de Fizică și Tehnologie din Moscova, Institutskiy per., 9, Dolgoprudnyi 141701, Rusia
Marina L. Georgieva
2 Gause Institute of New Antibiotics, ul. Bolshaya Pirogovskaya, 11, Moscova 119021, Rusia; ur.liam@90_avokydas (V.S.S.); ur.tsil@awonarabajna (A.A.B.); ur.xednay@aniram-i (M.L.G.)
5 Universitatea de Stat Lomonosov din Moscova, 1-12 Leninskie Gory, Moscova 119991, Rusia
Alexander B. Kul’ko
6 Departamentul de sănătate al guvernului Moscovei Centrul științific și clinic antituberculoză, ul. Stromynka, 10, Moscova 107014, Rusia; ur.xednay@ignuf-okluk
Mihail E. Krasheninnikov
7 Institutul de Medicină Moleculară, Departamentul Tehnologii Celulare Avansate, Institutul de Medicină Regenerativă, Sechenov Prima Universitate de Stat din Moscova, Str. Trubetskaya 8, Bl. 2, Moscova 119991, Rusia; ur.relbmar@nehsark (M.E.K.); moc.liamg@pudnuyl (A.V.L.)
Alexey V. Lyundup
7 Institutul de Medicină Moleculară, Departamentul Tehnologii Celulare Avansate, Institutul de Medicină Regenerativă, Sechenov Prima Universitate de Stat din Moscova, Str. Trubetskaya 8, Bl. 2, Moscova 119991, Rusia; ur.relbmar@nehsark (M.E.K.); moc.liamg@pudnuyl (A.V.L.)
Anastasia V. Vasilchenko
3 Universitatea de Stat din Tiumen, str. Volodarskogo nr. 6, Tiumen 625003, Rusia; moc.liamg@oknehclisava (A.S.V.); [email protected] (A.V.V.)
Yaroslav A. Andreev
1 Institutul de Chimie Bioorganică Shemyakin și Ovchinnikov, RAS, ul. Miklukho-Maklaya, 16/10, Moscova 117997, Rusia; ude.hcetsyhp@aphsul (V.A.L.); [email protected] (K.S.M.)
7 Institutul de Medicină Moleculară, Departamentul Tehnologii Celulare Avansate, Institutul de Medicină Regenerativă, Sechenov Prima Universitate de Stat din Moscova, Str. Trubetskaya 8, Bl. 2, Moscova 119991, Rusia; ur.relbmar@nehsark (M.E.K.); moc.liamg@pudnuyl (A.V.L.)
Date asociate
Abstract
1. Introducere
2. Rezultate și discuții
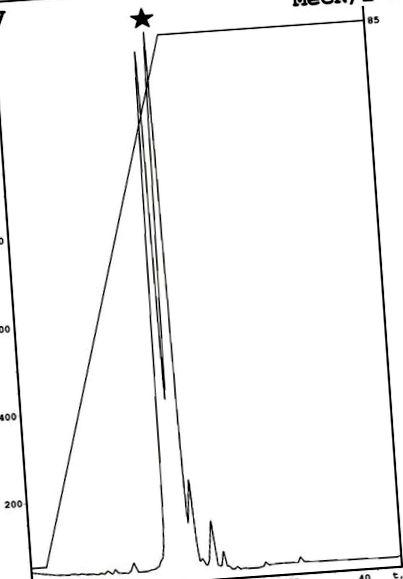
Emericelipsina A a fost izolată din lichidul de cultură fungică așa cum s-a descris anterior cu modificare [7]. Schema include o combinație de extracție cu acetat de etil urmată de evaporare, dizolvare în etanol și HPLC analitică în fază inversă pe o fază C18 [7]. O etapă suplimentară de purificare, bazată pe fenil analitic RP-HPLC, a fost utilizată pentru a obține componenta individuală. Ca rezultat, s-au găsit două componente diferite în fracția activă descrisă anterior (Figura 1). O analiză antimicrobiană a acestor compuși a relevat activitate pentru al doilea vârf, care este denumit emericelipsină A. Spectrometria de masă a făcut posibilă identificarea unei mase moleculare monoizotopice de 1049,76 Da. Structura acestei peptide a fost determinată utilizând spectroscopia RMN.
Purificarea emericelipsinei A prin HPLC cu fază inversă modificată cu fenil. Vârful țintei a fost marcat de o stea neagră. Descrieri specifice: MeCN - acetonitril; 2-β - izopropanol.
Structura emericelipsinei A determinată prin spectroscopie RMN. Numerotarea reziduurilor de amino și acizi grași este prezentată corespunzător Tabelului S1.
tabelul 1
Activitatea antibacteriană a emericelipsinei A împotriva bacteriilor.
| Gram negativ | Escherichia coli MG1655 | 25 | > 300 | > 200 | 0,08 |
| Salmonella enterica ATCC 14028 | 100 | > 300 | > 200 | 1,25 | |
| Pseudomonas aeruginosa ATCC 27853 | 100 | > 300 | > 200 | 2.5 | |
| Gram-pozitiv | Bacillus cereus ATCC 14893 | 12.5 | 16 | 12.5 | > 28 |
| Staphylococcus aureus FDA 209 P | 12.5 | 4 | 3.1 | 0,31 | |
| Listeria monocytogenes EGDe | 3.25 | 32,5 | 0,38 | 1,75 |
masa 2
Absorbția 1-N-fenilnaftilamină (NPN) a Escherichia coli MG 1655 indusă de permeabilizatori.
| Escherichia coli MG1655 | 1,5 ± 0,05 |
| Escherichia coli MG1655 tratată cu EDTA 0,5 M | 1,83 ± 0,1 |
| Escherichia coli MG1655 tratată cu 7 pg/mL de emericelipsină A | 2,0 ± 0,1 |
| Escherichia coli MG1655 tratată cu 15 pg/mL de emericelipsină A | 2,3 ± 0,2 |
| Escherichia coli MG1655 tratată cu 30 pg/mL de emericelipsină A | 4,7 ± 0,2 |
Este interesant faptul că aceeași dependență în activitatea antimicrobiană a fost demonstrată de controlul pozitiv de referință, vancomicina, care aparține grupului de antibiotice glicopeptidice [14] și este diferită din punct de vedere structural de emericelipsina A. Același efect a fost demonstrat și pentru peptaibol emerimicina IV, care a fost izolat din Emericellopsis minima și prezintă activitate bactericidă către S. aureus rezistent la meticilină și Enterococcus faecalis rezistent la vancomicină (specie Gram pozitivă); E. coli gram-negativ a fost rezistent [15]. În general, mecanismul principal al acțiunii peptaibolului este asociat cu întreruperea membranelor celulare [1,16].
Peptaibolii mai mari cu mai mult de 15 aminoacizi pot forma structuri elicoidale stabile în membrană [17]. Aceste spirale se pot asocia în oligomeri și pot forma canale ionice în membrană. Peptaibolii mai scurți sunt mai puțin activi prin membrană și, prin urmare, modul de acțiune al acestora este mai complex. Acțiunea lor poate fi o combinație de activitate care perturbă membrana și un efect asupra diferitelor ținte moleculare [9,18]. Cu toate acestea, peptaibolii scurți ar putea afecta membrana printr-o varietate de mecanisme: ar putea forma pachete de la capăt la capăt în cadrul stratului, dublându-și astfel lungimea în mod perpendicular pe bistratul, sau ar putea forma agregate asociate membranei sau ar putea acționa printr-un detergent. -com mecanism. Prin urmare, proprietățile peptaibolilor le permit să prezinte activități diferențiale atunci când vizează diferite tipuri de lipide de membrană. În consecință, acestea afectează organisme cu caracteristici de membrană diferite de ale lor [19,20].
Am evaluat capacitatea emericelipsinei A de a perturba structurile barierei bacteriene. Folosind pete de legare ADN SYTO9 și iodură de propidiu (PI), am investigat dinamica acumulării lor intracelulare în timp real. Acest amestec colorat este utilizat în mod activ pentru investigarea modului de acțiune al AMP. Adesea, această abordare permite obținerea de informații unice despre particularitățile acțiunii peptidelor, care nu sunt disponibile pentru alte metode, de exemplu, bacteriologice [21,22]. SYTO 9 fluorescent verde este o moleculă relativ mică (
400 Da) care este capabil să influențeze membranele bacteriene nedeteriorate, în timp ce PI este o moleculă mare (668 Da) care pătrunde doar în structurile de barieră celulară deteriorate [23]. Proprietățile de emisie ale amestecului de pete legate de ADN se modifică datorită deplasării unei pete de cealaltă și stingerii prin transfer de energie prin rezonanță de fluorescență [24].
Anterior, am realizat cu succes această abordare pentru investigarea modului de acțiune al diferitelor peptide antimicrobiene [25]. Am arătat că acest efect se produce cu adevărat atunci când PI a reușit să se infiltreze în celule printr-o barieră dezordonată după deplasarea SYTO9 din ADN [26].
Adăugarea peptaibolului la celulele S. aureus a dus la stingerea imediată a fluorescenței SYTO9 (Figura 3).
Dinamica permeabilității SYTO 9 în S. aureus 209 P (A) și E. coli MG 1655 (b) celule tratate cu emericelipsină A. Denumiri: 1—75 μg/mL; 2—32,3 μg/mL; 3-16 μg/ml; 4 - control negativ; 5 - control pozitiv. Dacă membranele bacteriene sunt permeabilizate, PI pătrunde în celulă. Ceea ce urmează este că SYTO 9 este deplasat de ADN, ceea ce duce la o scădere a intensității luminiscenței într-o regiune verde a spectrului. Apa pură și 20% alcool au servit drept martori negativi și, respectiv, pozitivi. Săgețile arată timpul substanței de testat.
Acest eveniment sugerează întreruperea membranei citoplasmatice S. aureus sub tratament. La rândul său, amestecarea emericelipsinei A cu celulele E. coli nu a schimbat cinetica fluorescenței SYTO9, sugerând că numai compușii cu greutate moleculară mică sunt capabili să se transfere în celulă. Cu toate acestea, emericelipsina A poate afecta pereții celulari ai bacteriilor Gram-negative. O breșă a membranei exterioare a bacteriilor Gram-negative a fost detectată folosind o sondă fluorescentă hidrofobă. 1-N-fenilnaftilamină (NPN) este o substanță hidrofobă, încărcată neutru, în mod normal impermeabilă în membrana exterioară, dar dacă moleculele de NPN se internalizează în medii fosfolipide, fluorescența sa crește puternic [27,28].
Adăugarea diferitelor concentrații de emericelipsină A la E. coli MG 1655 a dus la o creștere a intensității fluorescente a NPN într-o manieră dependentă de doză (Tabelul 2). Răspunsul maxim a fost observat la o concentrație de 30 μg/ml.
Prin urmare, modul de acțiune al emericelipsinei A este asociat cu întreruperea membranei citoplasmatice bacteriene, care a avut loc în câteva minute și a dus la moartea bacteriilor Gram-pozitive. În același timp, membrana exterioară a bacteriilor gram-negative are, de asemenea, o lovitură prin protejarea membranei citoplasmatice de moleculele de peptaibol. Peptida studiată asigură supraviețuirea E. coli, dar le poate afecta virulența în, de exemplu, formarea biofilmului.
Emericelipsina A a prezentat activitate antifungică cu spectru larg în testul de difuzie agar; a inhibat creșterea tuturor speciilor de Candida și a ciupercilor filamentoase A. niger ATCC 16404 și A. fumigatus KBP F24 la o concentrație de 40 μg/per disc. S-au demonstrat diferite niveluri de susceptibilitate pentru izolatele clinice multi-rezistente de Aspergillus care indicau sensibilitate specifică tulpinei la peptaibol. Mai precis, peptaibolul a fost eficient împotriva lui A. niger 219, A. fumigatus 163, A. flavus 905 și a fost ușor eficient împotriva lui A. tereus 1133. Așa cum se arată în Tabelul 3, un efect moderat de inhibare a peptaibolului a fost observat împotriva tuturor izolatelor din genul Aspergillus (valori MIC de 4 μM) și s-a observat o activitate antifungică puternică împotriva izolatelor rezistente la medicamente de C. tropicales 1402 și C. albicans 1582 cu aceeași valoare MIC de 2 μM. Este de remarcat faptul că izolatele clinice de drojdie au fost mai susceptibile la peptaibol decât izolatele de Aspergillus. Această constatare este în acord cu datele existente privind spectrul de activitate al peptaibolilor fungici [29,30,31]. Este de remarcat faptul că izolatele clinice de drojdie au fost mai susceptibile la peptaibol decât izolatele de Aspergillus.
Tabelul 3
Concentrații inhibitoare minime (MIC) ale emericelipsinei A împotriva ciupercilor, μg/mL.
- ABH Miratorg; s Activitatea Operațională pentru 2011 The Pig Site
- O revizuire a activității antioxidante a țelinei (Apium graveolens L)
- Asocierea pierderii în greutate cu îmbunătățirea activității bolii la pacienții cu poliartrită reumatoidă A
- Alphabet face vremea în primul trimestru după romanul coronavirus, dar cel mai rău este încă să vină - The
- Activarea proprietăților antitumorale la macrofagele alveolare de la șobolani subnutriți proteine-calorii