Abstract
Obezitatea crește în prevalență în Statele Unite, peste 65% dintre adulți fiind considerați supraponderali și 16% dintre copiii cu IMC> 95 percentilă. Heritabilitatea obezității este estimată între 40 și 70%, dar genetica obezității pentru majoritatea indivizilor este complexă și implică interacțiunea mai multor gene și mediu. Există totuși mai multe forme sindromice și nesindromice de obezitate care sunt monogene și oligogene, care oferă o perspectivă asupra controlului molecular subiacent al consumului de alimente și a rețelelor neuronale care controlează comportamentul digestiv și sațietatea pentru a regla greutatea corporală și care pot interacționa cu expunerile la tratament la produc sau exacerbează obezitatea la supraviețuitorii cancerului din copilărie.
Introducere
Obezitatea sau adipozitatea crescută este în primul rând rezultatul unui dezechilibru net al aportului caloric peste cheltuielile de energie în timp. Chiar și diferențele mici care duc la un echilibru energetic pozitiv - atunci când sunt integrate pe perioade lungi de timp - pot produce adipozitate crescută. În unele cazuri, împărțirea preferențială a excesului de calorii față de grăsime poate exacerba procesul. Odată cu disponibilitatea crescândă de alimente extrem de gustabile, dense din punct de vedere caloric, precum și mecanizarea crescută și un stil de viață din ce în ce mai sedentar, echilibrul energetic net pozitiv la mulți indivizi a dus la creșteri alarmante ale obezității la nivel mondial. În Statele Unite, 65% dintre adulți sunt considerați supraponderali (IMC 25,0-29,9) și mai mult de 30% din populația adultă este acum considerată obeză (IMC> 30) [1]. Problema afectează, de asemenea, copiii la care procentul cu IMC> 95 percentilă între 6-19 ani este acum de 16% [2].
Elemente moleculare în controlul greutății corporale
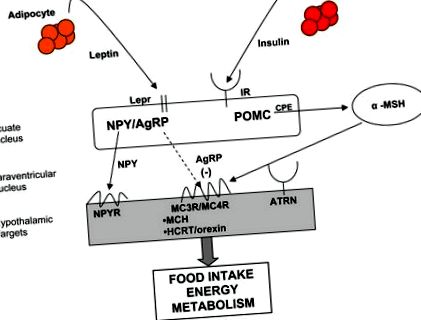
Controlul molecular al homeostaziei energetice. Semnalele periferice, inclusiv leptina și insulina, pentru a se lega de receptorii de pe corpurile celulare din nucleul arcuat al hipotalamusului. neuropeptidul Y (NPY)/proteina asociată cu agouti (AgRP) și pro-opiomelanocortina (POMC)/neuronii transcriptului reglementat de cocaină și amfetamină (CART) din nucleul arcuit se proiectează asupra corpurilor celulare din alți nuclei hipotalamici pentru a afecta echilibrul energetic prin aportul de alimente cheltuielile de energie și împărțirea nutrienților. Calea melanocortinei este o parte integrantă a controlului homeostaziei energetice. α-MSH (alfa melanotropină) este derivat din procesarea proteolitică a POMC și este un agonist (săgeată solidă) pentru receptorul melancortinei 3 (MC3R)/(receptorul melanocortinei 4 (MC4R) producând central efecte catabolice asupra homeostaziei energetice. AgRP este un agonist invers (săgeată punctată) la MC3R/MC4R, producând efecte anabolice asupra echilibrului energetic. (BBB: barieră hematoencefalică; LEPR: receptor de leptină; IR: receptor de insulină; CPE: carboxipeptidază E; ATRN: atrină; MCH: hormon concentrat melanină; HCRT: hipocretină/orexină)
Adipozitatea umană rezolvă interacțiunile complexe dintre influențele genetice, de dezvoltare, comportamentale și de mediu. Dovezile pentru contribuțiile genetice puternice la obezitatea umană sunt furnizate de gruparea familială a adipozității crescute, incluzând un risc relativ crescut de 3-7 ori (λs) în rândul fraților [4], precum și estimări ale eredității (fracția varianței fenotipice totale a unui trăsătură cantitativă cauzată de gene într-un mediu specificat) pentru masa de grăsime cuprinsă între 40 și 70% în studii gemene [5,6]. În mod clar, schimbările genetice nu pot explica tendințele recente către creșterea adipozității. Pe măsură ce mediul devine mai mult sau mai puțin favorabil dezvoltării obezității (ușurința accesului la alimente, necesitatea efortului fizic pentru a o obține, influențe intrauterine și perinatale putative), adipozitatea mediană a populației se schimbă în consecință. Diferențele fenotipice dintre indivizii la aceste extreme de adipozitate reflectă probabil variația alelică la gene care afectează aportul de energie, cheltuielile și forma chimică în care sunt stocate excesul de calorii (partiționare).
În prezent, se estimează că factorii genetici reprezintă 40-70% din varianța adipozității umane [4]. La majoritatea indivizilor, baza genetică a obezității este complexă și probabil implică interacțiunea mai multor gene, precum și interacțiuni genă-mediu. Ca și în cazul altor fenotipuri complexe, există exemple rare de cauze mono/oligogene pentru obezitate care servesc drept modele pentru înțelegerea rețelelor complexe hormonale și neuronale care reglează adipozitatea și oferă o perspectivă asupra căilor care pot explica cauzele mai frecvente ale obezității, precum și furnizați ținte pentru intervenția terapeutică. În acest capitol vom analiza importanțele perspective genetice și fiziologice oferite de studiul acestor forme relativ rare de obezitate.
Obezitate monogenică nesindromică
Înțelegerea reglării greutății corporale la oameni a fost extrem de ajutată de studiul modelelor monogene de rozătoare ale obezității. Pentru majoritatea genelor care cauzează obezitate la modelele murine, omologii umani au fost identificați cu fiziologie în general similară.
Deficitul de leptină
Deficiența receptorului de leptină
La scurt timp după identificarea Lep, s-a descoperit receptorul leptinei (Lepr) și s-au identificat mutații ale funcției în seria alelică a șoarecilor diabetici [12-14], precum și a șobolanului gras [15,16]. Leprul este un membru al familiei receptorilor de citokine și mediază semnalizarea leptinei prin fosfatidilinozitol 3-kinază și traductor de semnal și activator al transcripției-3 (STAT3), predominant în neuronii hipotalamici [17]. Semnalizarea STAT3 este crucială pentru reglarea consumului de alimente, dar nu este critică pentru reglarea reproducerii și creșterii. Prin screening-ul subiecților umani obezi pentru concentrații crescute de leptină serică, a fost identificată o familie consanguină în care trei membri au prezentat obezitate extremă cu debut precoce asociată cu întârzierea staturală a creșterii cauzată de secreția afectată a hormonului de creștere [18]. Toți cei trei subiecți au fost homozigoți pentru o mutație a situsului de îmbinare în exonul 16 care trunchiază receptorul înainte de domeniul transmembranar, făcând toate celulele incapabile să transmită un semnal intracelular. Deficitul de receptor uman de leptină produce obezitate extremă într-un mod autosomal recesiv. Subiecții cu deficit de receptor de leptină umană au temperatură bazală normală, rate metabolice de repaus, pubertate spontană, dar întârziată și concentrații normale de cortizol plasmatic [18].
Deficitul de pro-opiomelancocortină
Deficitul de POMC autosomal recesiv se datorează heterozigozității compuse sau homozigozității pentru mutațiile pierderii funcției la un număr mic de subiecți umani produce obezitate severă, cu debut precoce asociată cu hiperfagia [23-25] din cauza lipsei de αMSH care acționează central la MC3R și MC4R. Din cauza lipsei acțiunii periferice a MSH, copiii au demonstrat, de asemenea, culoarea palidă a pielii și părul roșu din cauza lipsei de agonism periferic la MC1R. Cei cinci copii au prezentat inițial niveluri nedetectabile de cortizol și ACTH la începutul copilăriei, în concordanță cu absența ligandului ACTH pentru corticala suprarenală MC2R. S-a constatat că indivizii heterozigoți au creșteri intermediare ale greutății corporale, sugerând un efect de dozare a genei pentru POMC [26].
Deficiență de Prohormone convertase 1
La fel ca șoarecele knockout Pomc, șoarecele gras este un exemplu de obezitate autozomală recesivă cu debut ulterior și severitate redusă față de șoarecii obezi și diabetici. Observarea nivelurilor crescute de proinsulină circulantă la acești șoareci a condus la identificarea mutației Ser202Pro în gena candidă pozițională carboxipeptidază E (Cpe) care este responsabilă pentru scindarea prohormonică a reziduurilor de bază C-terminale din prohormoni și proneuropeptide precum proinsulina, proneuropeptida Y, progonadotropină și POMC [27]. Dându-și seama că procesarea aberantă a prohormonilor ar putea produce obezitate, Jackson și colab. au identificat doi subiecți cu mutații heterozigoice compuse în prohormona convertază 1 (PC1), o enzimă care scindează prohormonii de aminoacizi dibazici în etapa imediat anterioară procesării CPE [28]. Ambii subiecți au fost descriși ca având obezitate la debutul copilariei, proinsulină crescută, hipocortizolemie cu POMC crescută, hipoglicemie reactivă și hipogonadism hipogonadotrop [28,29]. Fenotipul obezității subiecților se datorează probabil procesării aberante a POMC și a altor prohormoni, iar fenotipul subiecților umani recapitulează pe cel al șoarecelui gras.
- Anxietatea contribuie independent la inflamația crescută la om cu obezitate - Pierce - 2017
- Poate epidemia de obezitate la om se poate datora mai mult utilizării condimentelor decât nutrienților MedCrave
- Adaptarea la o dietă bogată în grăsimi accelerează golirea grăsimilor, dar nu și a meselor testate cu carbohidrați la oameni
- Biguanides - o prezentare generală Subiecte ScienceDirect
- Derivat Biguanide - o prezentare generală Subiecte ScienceDirect