Soare Beicheng
1 Centrul de transplant hepatic al primului spital afiliat și centru de cancer, Universitatea de Medicină Nanjing, Nanjing, provincia Jiangsu, PR China
Michael Karin
2 Laborator de reglare genică și transducție a semnalului, Departamentul de farmacologie și patologie, Cancer Center, UCSD School of Medicine, La Jolla, California 92093-0723, SUA
Abstract
Obezitatea a devenit o problemă majoră de sănătate publică universală, cu o prevalență crescândă atât la adulți, cât și la copii în secolul 21, chiar și în țările în curs de dezvoltare. Studii epidemiologice extinse relevă o legătură puternică între obezitate și dezvoltarea și progresia diferitelor tipuri de cancer. Legătura dintre obezitate și cancerul hepatic este deosebit de puternică, iar obezitatea duce adesea la boli hepatice, cum ar fi boala hepatică grasă nealcoolică (NAFLD) și steatohepatita non-alcoolică mai severă (NASH). NASH se caracterizează prin inflamație hepatică grasă și se crede că provoacă fibroză și ciroză. Acesta din urmă este un factor de risc cunoscut al cancerului hepatic. De fapt, datorită prevalenței sale mult mai mari, obezitatea poate contribui mult mai mult la sarcina generală a carcinomului hepatocelular decât infecția cu virusurile hepatitei. Aici analizăm și discutăm progresele recente în elucidarea modificărilor celulare și moleculare și a căilor de semnalizare asociate cu obezitatea și inflamația ficatului și contribuția lor la hepatocarcinogeneză.
Introducere
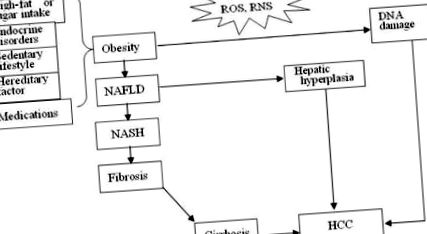
Trei mecanisme presupuse pentru hepatocarcinogeneza indusă de obezitate și promovată de obezitate. ROS, specii reactive de oxigen; RNS, specii reactive de azot
Obezitate și carcinom hepatocelular
Creșterea constantă a IMC a devenit o pandemie la nivel mondial și în prezent se estimează că va provoca peste 90.000 de decese legate de cancer pe an doar în SUA [6]. Incidența obezității atât la adulți, cât și la copii în ultimele trei decenii a crescut drastic, de asemenea, în alte părți ale lumii, inclusiv în țări în curs de dezvoltare precum China și India [11-14]. Obezitatea s-a dovedit a fi un factor de risc independent pentru unele afecțiuni maligne, inclusiv cancer de sân, cancer endometrial, cancer de colon, carcinom cu celule renale, adenocarcinom esofagian, adenocarcinom ductal pancreatic și HCC [3, 15-19]. Mai mult, obezitatea este asociată cu un prognostic slab al cancerului de sân și al cancerului de colon [19, 20].
HCC este forma dominantă a carcinomului hepatic primar (PLC), ocupând locul șase în ceea ce privește incidența și al treilea în ceea ce privește mortalitatea dintre toate tipurile de cancer. HCC reprezintă 85% până la 90% din PLC la nivel mondial și constituie 70% până la 75% din cazurile de PLC din SUA [21-23]. Deși infecțiile cu VHB și VHC sunt considerate ca factori de risc majori ai HCC la nivel mondial, cel puțin în SUA, obezitatea este probabil principalul factor de risc alături de alți factori non-virali, precum diabetul zaharat de tip 2, alcoolul, tutunul și contraceptivele orale. [23, 24]. Obezitatea reprezintă, de asemenea, un factor de risc independent HCC la pacienții cu ciroză alcoolică și ciroză criptogenă [3]. Un studiu de urmărire din Taiwan a implicat efecte sinergice între tulburările metabolice (obezitate și diabet) și hepatita virală, riscul de HCC crescând de peste 100 de ori în purtătorii de VHB sau VHC cu obezitate și diabet [25].
Citokine și adipokine în inflamația hepatică indusă de obezitate
Adipokine, citokine și hepatocarcinogeneză. Acizii grași liberi excesivi (FFA) pot activa diverse celule imune și pot provoca moartea celulelor hepatocitelor. Mai mult, resturile celulare, citokinele pro-inflamatorii și adipokinele pot spori în continuare secreția de TNF și IL-6 din celulele Kupffer, ducând la activarea moleculelor de semnalizare din aval, cum ar fi STAT3 în hepatocite care contribuie la hepatocarcinogeneză.
Mai multe citokine au o influență puternică asupra reglării rezistenței la insulină în contextul inflamației hepatice. TNF este produs în principal de macrofage, dar și de țesutul adipos al șoarecilor obezi și al bărbaților [57]. Mai mult, s-a demonstrat că TNF joacă un rol semnificativ în rezistența la insulină cel puțin la șoareci [58]. Expresia crescută a ARNm și proteine TNF a fost detectată la rozătoarele obeze și la oameni. Pierderea TNF sau a receptorilor săi (TNFR1 și TNFR2) îmbunătățește sensibilitatea la insulină la șoarecii obezi [59]. Cu toate acestea, neutralizarea TNF sa dovedit a fi ineficientă în restabilirea sensibilității la insulină la pacienții diabetici [60, 61]. Sensibilitatea la insulină la șoarecii ob/ob cu deficit de leptină este îmbunătățită prin epuizarea IL-6 folosind un anticorp neutralizant [62], în plus, un studiu recent a arătat că IL-6 poate inhiba semnalizarea insulinei în hepatocite [63]. Cu toate acestea, până în prezent nu au fost raportate studii clinice privind capacitatea medicamentelor anti-IL-6 de a îmbunătăți sensibilitatea la insulină și metabolismul hepatic. Mai mult, sa constatat că administrarea unui inhibitor de anticorp anti-receptor IL-6 provoacă o creștere tranzitorie a lipoproteinelor serice [64].
Leptina, ale cărei efecte au fost descoperite în anii 1950 [65], dar nu au fost identificate până în 1994 [66], este produsul genei obeze (ob) și este produsă în principal de adipocite ale țesutului adipos alb (WAT) și măsură mai mică de țesuturile adipoase maronii, placentă, ovare, mușchi scheletic, stomac, măduvă osoasă și ficat [67-70]. Leptina poate regla aportul și cheltuielile de energie prin legarea la receptorii exprimați de neuronii SNC [71, 72]. Semnalizarea Leptinei previne creșterea în greutate în condiții fiziologice, iar concentrația serică și cantitățile de ARNm de leptină sunt asociate pozitiv cu cantitatea de energie stocată în țesutul adipos și cu masa totală a țesutului adipos, atât la oameni, cât și la șoareci [73-75]. Astfel, producția de leptină este un mecanism cheie de feedback negativ în reglarea IMC. Expresia leptinei este stimulată de mulți factori de fază acută, cum ar fi TNF, IL-1 și IL-6, și în timpul infecției bacteriene sau provocarea lipopolizaharidelor (LPS) [76]. Șoarecii cu deficiență de leptină (ob/ob) sau deficienți în receptorii de leptină (db/db) dezvoltă spontan obezitate chiar și pe chow normal [77-79].
Alte citokine și adipokine
Căile de semnalizare a citokinelor asociate cu inflamația indusă de obezitate
Deși s-a demonstrat că multe citokine modulează și mediază inflamația indusă de obezitate și progresia NAFLD, mecanismul central care mediază efectele acestor citokine asupra tulburărilor metabolice induse de obezitate asociate cu steatohepatita cronică precum rezistența la insulină, NAFLD și NASH nu sunt complet clar. Cu toate acestea, mai multe căi specifice de semnalizare intracelulară, inclusiv factorul nuclear (NF) -κB, JNK, proteina activatoare-1 (AP-1) și STAT3 au apărut ca potențiale ținte pentru multe dintre aceste citokine și chemokine. O altă cale importantă de semnalizare - calea AMPK-TORC1 va fi discutată separat mai jos.
Deși mai multe căi au fost implicate în inflamația metabolică, căile de semnalizare IKK și JNK în adipocite, macrofage și hepatocite au apărut ca mediatori pivot ai inflamației induse de obezitate și chiar a tulburărilor metabolice sistemice [8, 42, 97, 101, 111, 112 ]. După cum sa discutat mai jos, aceste căi sunt, de asemenea, implicate în tumorigeneză hepatică.
Semnalizare TORC1, autofagie și hepatosteatoză
O modalitate de a reactiva autofagia în ficatul hepatosteatotic este prin utilizarea metforminei antidiabetice. Se știe că metformina provoacă activarea AMPK printr-un mecanism slab definit și, prin urmare, conduce la inhibarea TORC1 și stimularea autofagiei [127, 128]. O altă modalitate de a inhiba TORC1 și de a stimula autofagia este prin utilizarea rapamicinei și a altor inhibitori TORC1 [129]. Interesant este că s-a constatat că utilizarea metforminei este asociată cu un risc redus de cancer [130]. În special, sa constatat că tratamentul cu metformină este asociat cu o reducere puternică și semnificativă statistic a riscului de HCC la diabetici și pare, de asemenea, să încetinească dezvoltarea HCC [131, 132]. Astfel, utilizarea metforminei de către diabetul de tip 2 poate inversa creșterea riscului de HCC asociat cu rezistența la insulină și obezitate. Utilizarea rapamicinei poate reduce, de asemenea, riscul de HCC și recent au fost efectuate studii clinice care utilizează rapamicină și alți inhibitori TORC1 în tratamentul HCC [133, 134].
Instabilitate genetică asociată cu obezitatea
Modele murine pentru cancerul hepatic promovat de obezitate
O altă proteină de semnalizare a cărei activitate este crescută atât în țesuturile hepatice non-tumorale, cât și în HCC-urile șoarecilor alimentați cu HFD este STAT3 [8]. Activarea STAT3 în hepatocite este esențială pentru dezvoltarea HCC indusă de DEN [144] și pentru creșterea tumorii stimulată de obezitate [8]. Principala cauză a activării STAT3 este producția crescută a citokinelor pro-inflamatorii IL-6, ceea ce duce la activarea STAT3 directă și TNF care stimulează expresia IL-6 [8]. Ablația IL-6 sau TNFR1 a blocat hepatocarcinogeneza promovată de obezitate. S-a stabilit că mecanismul responsabil de acest efect protector este hepatosteatoza și steatohepatita reduse [8]. După cum sa văzut cu ablația NEMO, deficiențele IL-6 sau TNFR1 au avut un efect redus, dacă există, asupra acumulării de grăsime în depozitele periferice, subliniind ideea că IMC crescut nu este direct responsabil de hepatocarcinogeneza promovată de obezitate. Cu alte cuvinte, acumularea de grăsime în hepatocite care poate duce la inflamația ficatului gras este mult mai importantă decât acumularea de grăsime subcutanată [145].
Concluzii
tabelul 1
Modele murine asociate cu obezitatea și HCC
- Obesity and Breast Cancer (2016) Coaliția Wisconsin Breast Cancer
- Silibinina scade diferențial fenotipul agresiv al cancerului într-un model in vitro de obezitate
- Not Your Ordinary Water - Institutul American pentru Cercetarea Cancerului
- PLOS ONE Tendințe seculare în prevalența supraponderalității și a obezității la școlarii sicilieni în vârstă
- Echivalent metabolic (MET) la supraponderalitate și obezitate