Departamentul de fiziologie veterinară și biochimie, Universitatea Justus-Liebig-Giessen, Giessen, Germania; și
Departamentul de fiziologie veterinară și biochimie, Universitatea Justus-Liebig-Giessen, Giessen, Germania; și
Departamentul de fiziologie veterinară și biochimie, Universitatea Justus-Liebig-Giessen, Giessen, Germania; și
Departamentul de fiziologie veterinară și biochimie, Universitatea Justus-Liebig-Giessen, Giessen, Germania; și
Departamentul de fiziologie veterinară și biochimie, Universitatea Justus-Liebig-Giessen, Giessen, Germania; și
Grupul de Cercetare a Funcției Creierului, Școala de Fiziologie, Facultatea de Științe ale Sănătății, Universitatea din Witwatersrand, Johannesburg, Africa de Sud
Abstract
Obezitatea atinge proporții dramatice la om și este asociată cu un risc mai mare de boli cardiovasculare, diabet și modificări cognitive și o mortalitate mai mare în timpul infecției și inflamației. Focusul prezentei revizuiri se pune pe influența obezității asupra prezentării febrei, comportamentului de boală și a răspunsurilor inflamatorii în timpul inflamației sistemice acute.
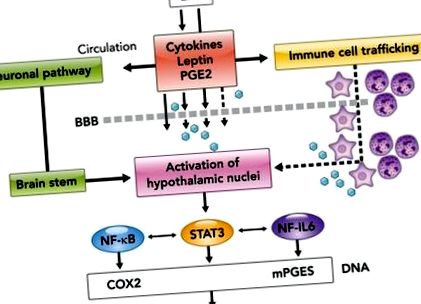
FIGURA 1.Semnalizarea imun-creier în timpul inflamației sistemice acute
Citokinele antiinflamatorii [de exemplu, antagonistul receptorilor IL-1 (IL-1ra) și IL-10] și glucocorticoizii, printre alți mediatori, au fost raportate că sunt implicate în reglarea recuperării febrei dependente de PGE2 și a comportamentelor de boală (133) . În plus, un transportor PGE2 (PGT) a fost propus să joace un rol în încetarea febrei prin eliminarea PGE2 din creier (63). Într-adevăr, expresia transportorului PGE2 (PGT) (35) s-a dovedit a fi indusă, după administrarea sistemică de LPS, de-a lungul celulelor endoteliale și a căptușelilor creierului predispuse la eliminarea PGE2 din țesutul cerebral. Mai mult, s-a demonstrat că expresia PGT atinge vârf atunci când nivelurile de PGE2 din lichidul cefalorahidian încep să scadă dramatic (63).
Deși febra este un răspuns comun la infecții și inflamații, în cazurile severe de sepsis și șoc septic, poate apărea hipotermie, o stare sau răspuns caracterizat printr-o temperatură corporală mai mică decât cea normală (8, 23). S-a propus ca trecerea de la febră la hipotermie care se observă în timpul formelor severe de infecție ar putea fi un răspuns termoreglator regulat provocat de modificări ale activității termoefectorului, adică inhibarea termogenezei și nu doar eșecul termoreglator datorat șocului. asociat cu infecție severă (5, 6, 131). Mediatorii și modulatorii propuși să fie implicați în modificările derivate din creier ale activității termoeffectorului necesare pentru a induce hipotermia includ endocanaboizi și mediatori inflamatori derivati din lipide, cum ar fi factorul de activare a trombocitelor, prostaglandinele, acizii epoxieicosatrienoici și leucotrienele (Ref. 158; pentru revizuire), vezi Ref. 129). În plus față de mediatorii inflamatori derivați de lipide enumerați mai sus, s-a sugerat, de asemenea, că factorul de necroză tumorală citokinică proinflamatorie (TNF) -α joacă un rol în hipotermia indusă de infecție (78, 85, 165); cu toate acestea, mecanismul exact prin care TNF mediază hipotermia rămâne un domeniu de dezbatere.
Un corp din ce în ce mai mare de lucrări a documentat impactul multor factori legați de stilul de viață, cum ar fi obezitatea, dieta, îmbătrânirea, exercițiile fizice și stresul, asupra proceselor inflamatorii inițiate în timpul infecției acute și cronice și al inflamației (2, 26, 53, 90, 98, 105, 127, 174). Concentrarea prezentei revizuiri este asupra influenței obezității asupra prezentării febrei, comportamentelor de boală și a răspunsurilor inflamatorii observate în timpul inflamației sistemice acute, așa cum este descris mai sus.
Starea fiziologică a supranutriției (obezității) este complexă și implică o creștere a depozitării lipidelor în țesutul adipos alb (WAT). Amploarea creșterii și distribuția WAT sunt influențate de vârstă. În funcție de funcția sa, WAT poate fi clasificat în WAT depozitat, WAT structural și WAT fibros (147), iar aportul de sânge și funcția metabolică a WAT sunt parțial neregulate cu îmbătrânirea (36). Pe lângă faptul că WAT își exercită funcția fiziologică de stocare a energiei sau protecție structurală, de exemplu în rinichi, este, de asemenea, bine recunoscut ca un important organ endocrin care secretă o varietate de așa-numitele adipokine, cum ar fi leptina sau adiponectina, și citokinele, inclusiv IL-1β, IL-6, TNF-α și IL-1ra, care sunt denumite adipocitokine atunci când sunt derivate din WAT (84, 166). FIGURA 2 arată că în timpul obezității există o trecere la o stare proinflamatorie de nivel scăzut datorită creșterii mediatorilor proinflamatori și a reglării antiinflamatorii modificate.
FIGURA 2.Modificări fiziopatologice care contribuie la starea pro-inflamatorie în timpul obezității, în funcție de gradul de adipozitate corporală și starea de sănătate (2, 4, 169)
• apelină, care reduce febra indusă de LPS atunci când este injectată intracerebroventriculară (icv) (61)
• Proteina 13 legată de C1q/TNF, care reduce aportul de alimente și masa corporală atunci când se injectează icv (17)
• visfatină, care induce febră, anorexie și letargie atunci când este injectat icv (110).
Obezitatea a fost asociată cu o intrare crescută a celulelor imune din periferie în creier (3, 16, 153). Într-adevăr, în anumite condiții, monocitele periferice ar putea invada creierul și deveni microglie (97). Un mecanism care stă la baza recrutării celulelor imune în creier în timpul obezității ar putea aparține chimiokinei fractalkine (CX3CL1) care pare să fie exprimată în obezitatea indusă de dietă (DIO) și în modelele HFD de obezitate. S-a demonstrat că injectarea in vivo a ARN-urilor mici care interferează cu CX3CL1 în nucleul arcuat hipotalamic reduce recrutarea monocitelor și obezitatea la șoareci de tip sălbatic HFD transplantați cu măduvă osoasă cu proteină fluorescentă verde (100). În plus, șoarecii cu deficit de receptor CX3CR1 arată recrutarea redusă a celulelor mieloide în WAT (119). Mai mult, am arătat că leptina poate acționa asupra punctelor de intrare cunoscute ale celulelor imune în creier, și anume în jurul ventriculelor, de-a lungul meningelor și vaselor de sânge ale creierului (139), pentru a recruta granulocite de neutrofile în creier (138). În studiile ulterioare, modificările comportamentale induse de LPS prelungite observate la șoarecii obezi au fost legate de recrutarea crescută a creptinelor dependente de leptină a granulocitelor neutrofile (3).
Un rol potențial pentru microbiomul intestinal în inducerea inflamației hipotalamice este, de asemenea, în curs de dezvoltare (145), deoarece transferul microbiomului la rozătoare fără germeni s-a dovedit a conduce la dezvoltarea fenotipului obez (37, 126). Pe lângă aportul unui HFD, permeabilitatea crescută a intestinului și eliberarea ulterioară de endotoxine din microbii intestinali în circulație ar putea explica parțial și prezența inflamației hipotalamice și creșterea endotoxemiei observate la oamenii și animalele obeze (11, 25). Oamenii și animalele obeze nu numai că ar putea fi expuse riscului de endotoxemie crescută, ci și de defecte ale termogenezei. Observația că administrarea centrală cu doze mici de TNF-α duce la o reducere a activității BAT indică faptul că unele defecte ale termogenezei observate cu obezitatea ar putea fi, de asemenea, legate de inflamația hipotalamică de grad scăzut care apare cu obezitatea (9). Contribuția BAT la termoreglare este, totuși, foarte dependentă de specii și vârstă și, astfel, deși rămâne o țintă promițătoare pentru tratarea obezității, relevanța sa trebuie să fie elucidată în continuare (177).
Tabelul 1 Rezumatul modelelor genetice utilizate pentru a investiga influența obezității asupra febrei și comportamentului de boală
ip, intraperitoneal; iv, intravenos; sc, subcutanat; Șobolani zahăr (fa/fa); Șobolani cu deficit de receptor de leptină (șobolani Koletsky); Șobolani Otsuka Long-Evans Tokushima Fatty (OLETF); Șoareci cu deficit de receptor de leptină (db/db); Șoareci cu deficit de leptină (ob/ob). Liniuțele indică valori care nu au fost măsurate sau furnizate.
Șobolanii Koletsky cu o mutație fără sens a receptorului leptinei (162) și șobolanilor OLETF, cărora le lipsește receptorul colecistochinin-A, nu au prezentat diferențe semnificative în răspunsurile febrile la LPS în timpul experimentelor efectuate într-un mediu termoneutral (temperatura ambiantă de 28 ° C sau 29 ° C) (67, 155). Cu toate acestea, rezultatele studiului efectuat folosind șobolani OLETF tind să sugereze că răspunsul febril ar putea fi îmbunătățit la șobolanii OLETF obezi, deoarece comparația statistică a valorilor obținute pentru indicele de febră de 6 ore a dat o P valoarea de 0,07. După administrarea unei doze mari de LPS (100 μg/kg) la șobolani Koletsky la o temperatură ambiantă subtermoneutrală (adică 22 ° C), șobolanii au prezentat hipotermie prelungită însoțită de 1) o creștere contondentă a corticosteronului, potențial legată de deficitul de leptină (155) și 2) niveluri crescute de TNF-α circulante, ceva observat frecvent în timpul inflamației severe de tip septic și legat de hipotermia indusă de infecție (78, 85, 165).
Tabelul 2 Rezumatul studiilor care investighează influența obezității induse de dietă asupra febrei, comportamentului de boală și inflamației induse de administrarea LPS
DIO, obezitate indusă de dietă; ∗, simptomele de boală ale letargiei, ptozei, piloerecției, posturii corporale plate și secrețiilor nazale au fost evaluate utilizând o scară în cinci puncte adaptată de la un model de șoarece; IDO, indolamină-2,3-dioxigenază. Liniuțele indică valori care nu au fost măsurate sau furnizate.
Observația că neutralizarea acțiunii IL-6 eliberate periferic și a leptinei atenuează ultima parte a fazei febrile la șobolani DIO pare să implice leptina și IL-6 în modularea febrei prelungite observate cu administrarea LPS la animalele obeze (118). Atât leptina, cât și IL-6 semnalizează prin calea JAK-STAT3, iar noi, și alții, am arătat că, în timpul inflamației induse de LPS, leptina și IL-6 contribuie la activarea STAT3 spatiotemporală a 1) celulele din structurile creierului implicate în dezvoltarea febrei și anorexiei și 2) celule endoteliale și gliale în întregul creier (48, 57, 58, 102, 134, 137, 139, 141, 142).
Spre deosebire de studiile care arată răspunsuri sporite la comportamentul bolii cu inflamație hipotalamică crescută la șobolani/șoareci DIO după administrarea LPS, există unele studii care au raportat răspunsuri atenuate la comportamentul bolii. Șoarecii HFD au prezentat un comportament depresiv atenuat, după cum a fost evaluat prin testul de suspensie a cozii (TST) și anorexia la o zi după administrarea LPS, dar a îmbunătățit inflamația în hipocampus și hipotalamus (7). În mod interesant, Pini și colegii săi au demonstrat, de asemenea, o pierdere de masă corporală atenuată la șoarecii DIO ziua 1 după administrarea LPS (112). Cu toate acestea, în același studiu, anorexia a fost prelungită și îmbunătățită semnificativ la șobolanii DIO comparativ cu șobolanii slabi de pe ziua 7. Astfel, după cum recunosc și André et al. (7), momentul măsurătorilor comportamentului bolii trebuie monitorizat îndeaproape, deoarece răspunsurile exagerate ale bolii, o consecință a răspunsului inflamator sporit în periferie și creier, pot fi observate numai în momentele ulterioare.
După cum sa menționat mai devreme, există sisteme de contracarare (axa HPA) implicate în reducerea febrei (133) și a răspunsurilor la comportamentul bolii (72). Diferențele dintre și între modelele de obezitate, de exemplu, genetică sau DIO/HFD, pot duce la diferite procese acute sau cronice care sunt însoțite de propriile efecte distincte asupra axei HPA, care la rândul lor pot influența modul în care animalele obeze genetice sau DIO/HFD răspunde la un stimul inflamator precum LPS. Studiile discutate mai sus au constatat că activitatea axei HPA este 1) îmbunătățită cu stres rece și la momentul inițial la șobolanii Zucker (176) și 2) îmbunătățită de HFD sau DIO (151, 163). În special, un studiu recent a arătat că activarea microglială și inflamația în creier (hipocampus) a db/db șoarecii au fost dependenți de glucocorticoizi; glucocorticoizii par să scadă pragul pentru eliberarea de citokine pro-inflamatorii în db/db șoareci (34).
Deși contribuția respectivă a masei corporale în sine sau a dietei în influențarea febrei și a răspunsurilor la comportamentul bolii în timpul inflamației acute rămâne controversată, s-a sugerat că nivelul de adipozitate poate juca un rol (92). Mai mult, s-a identificat, de asemenea, că răspunsul inflamator poate varia între structurile creierului și poate fi într-adevăr mai pronunțat în regiunile creierului care mediază răspunsurile la boală, cum ar fi hipotalamusul și hipocampul, comparativ cu alte regiuni ale creierului. Dacă nivelul de adipozitate joacă într-adevăr un rol în determinarea răspunsurilor la febră și comportament de boală în timpul inflamației acute, unele dintre diferențele observate în constatările obținute în mai multe studii utilizând DIO pot fi legate de compoziția dietei furnizate (92).
Deși imaginea fiziopatologică completă rămâne de elucidat, în general așa cum se arată în FIGURA 3, literatura actuală susține presupunerea că obezitatea în sine îmbunătățește inflamația în creier (citokine crescute și activare microgliană) și în periferie (niveluri crescute circulante de citokine; de exemplu, IL-6 și adipokine, de exemplu, leptină). Când obezitatea este cuplată cu o provocare suplimentară a sistemului imunitar înnăscut, cum ar fi LPS de exemplu, se pare că răspunsurile inflamatorii ulterioare (IL-6, TNF, IL-1β) și răspunsurile la boală (febră și comportament de boală) devin mai accentuate. Răspunsurile inflamatorii și de boală îmbunătățite sunt potențial legate de o stare de așa-numită „amorsare” (7, 112, 117), similară cu ceea ce s-a propus să aibă loc în timpul procesului de îmbătrânire (104). La om, câteva studii confirmă de fapt relevanța clinică a observațiilor făcute în studiile efectuate la animale obeze. De exemplu, obezitatea este asociată cu febră prelungită în timpul infecțiilor tractului urinar (175), iar un indice de masă corporală> 34 este legat de morbiditatea febrilă postpartum la mamele adolescente (52).
FIGURA 3.Obezitatea afectează capacitatea de reacție la infecții sistemice și inflamații
Starea proinflamatoare de grad scăzut observată în timpul obezității poate fi, de asemenea, unul dintre factorii cauzali ai unui risc crescut de a dezvolta boli cardiovasculare, diabet zaharat (64) și chiar posibil boli psihiatrice asociate cu obezitatea (2). Mai mult, unele studii au sugerat un risc mai mare pentru dezvoltarea infecției la indivizii obezi și o rată mai mare a mortalității la indivizii obezi în timpul infecției (42, 81, 138, 154, 161). Legătura potențială dintre obezitate și mortalitate mai mare nu este totuși una simplă și pare să fie dependentă de boala/infecția specială, de forma fizică cardiometabolică, de vârstă, sex, genetică și de bolile preexistente ale individului (46, 109). Mai mult, obezitatea ar putea avea chiar și un anumit potențial protector, de exemplu, în timpul sepsisului, s-a observat că prezența leptinei, o adipokină cheie crescută în timpul obezității, stabilizează temperatura corpului, îmbunătățește răspunsurile imune celulare și reduce răspunsurile pro-inflamatorii la citokine (152). ). Astfel, obezitatea poate fi, în unele cazuri, mai mult un modulator decât un potențator al răspunsurilor la boală și activarea imunitară în timpul infecției.
NOTĂ DE PICIOASĂ
Această lucrare a fost susținută de un program de legare a grupului fundației Alexander von Humboldt (L.M.H., C.R.) și C.R. a fost susținut de Programul Emmy Noether al Fundației Germane de Cercetare (proiectul DFG RU 1397/2-1).
Niciun conflict de interese, financiar sau de altă natură, nu este declarat de autor (i).
- Obezitate și comportament sedentar Care este puiul, care este oul South Florida Sun Sentinel - South
- Obezitate și respirație sănătoasă
- Noi indicii despre motivul pentru care alimentația deficitară din uter duce la obezitate mai târziu în viață - ScienceDaily
- Obezitatea și sănătatea creierului Excesul de greutate poate accelera îmbătrânirea creierului; Sfaturi pentru a preveni obezitatea
- Obezitate și hipomagnezemie - PubMed