Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institutul Național al Căutării Agronomice, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Franța
Adresa pentru cereri de reimprimare și alte corespondențe: S. Skiba-Cassy, UMR 1067 Nutrition, Aquaculture & Génomique, Institutul Național al Cercetării Agronomice, Pôle d'hydrobiologie, 64310 Saint-Pée-sur-Nivelle, Franța (e-mail: [e-mail protejat]).
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institutul Național al Căutării Agronomice, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Franța
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institutul Național al Căutării Agronomice, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Franța
Unité Mixte de Recherches 1067 Nutrition Aquaculture and Génomique, Institutul Național al Căutării Agronomice, Pôle d'hydrobiologie, 64310 Saint Pée-sur-Nivelle, Franța
Abstract
gestionarea depunerii de grăsime este o provocare semnificativă atât pentru sănătatea umană, cât și pentru creșterea animalelor de fermă. La om, obezitatea exprimată ca supraexpansiune a țesutului adipos este adesea asociată cu dezvoltarea tulburărilor metabolice, care devine din ce în ce mai răspândită la nivel mondial și se preconizează că va crește semnificativ în următorii 10 ani (50). Gestionarea depunerii de grăsime la animalele de fermă, inclusiv peștii, a devenit, de asemenea, extrem de semnificativă, mai ales în ceea ce privește calitatea cărnii, deoarece depozitarea lipidelor în mușchiul scheletic afectează valoarea nutrițională și proprietățile senzoriale ale cărnii (49).
Selecția genetică a fost frecvent utilizată la animalele de fermă pentru a gestiona conținutul de grăsime corporală (7a, 24), dar a fost rareori folosită în acvacultură. Două linii experimentale de păstrăv curcubeu au fost recent dezvoltate prin selecție divergentă pentru un conținut scăzut sau ridicat de grăsime musculară cu utilizarea unei metode nedistructive de măsurare pe pești vii (36). Selecția genetică pentru un conținut ridicat de grăsime musculară nu afectează aportul de hrană și au fost înregistrate conținuturi similare de grăsime din corpul întreg în două linii de pești de 80 g hrăniți cu aceeași dietă (20). Caracterizarea metabolică a liniilor i-a determinat pe autori să sugereze că liniile prezintă diferențe în utilizarea surselor de energie, cu o reducere a oxidării acizilor grași hepatici și o utilizare îmbunătățită a glucozei atât în ficat, cât și în mușchiul peștilor din linia musculară grasă (FL) comparativ cu linia musculară slabă (LL) (20, 21). Deoarece insulina controlează metabolismul glucozei și lipidelor, am emis ipoteza că căile insulinei ar fi putut fi afectate de selecția genetică pentru conținutul de grăsime musculară.
Procedura experimentală și de eșantionare.
Tabelul 1. Formula și compoziția analitică a dietei
Nivelurile metabolitului plasmatic.
Nivelurile de glucoză plasmatică, triacilglicerol (TG) și acid gras gratuit (FFA) au fost măsurate cu glucoză RTU (BioMerieux, Marcy l'Etoile, Franța), PAP 150 (Biomérieux, Marcy-l'étoile, Franța) și kituri NEFA C (Wako Chemicals, Neuss, Germania), respectiv, conform recomandărilor fiecărui producător.
Extracția proteinelor și Western blot.
Analiza expresiei genelor: RT-PCR în timp real.
Eșantioanele totale de ARN au fost extrase din ficatul înghețat de -80 ° C al peștilor la post și peștele refinat la 8 și 24 de ore folosind reactiv Trizol (Invitrogen, Carlsbad, CA) conform recomandărilor producătorului. O microgramă din ARN-ul total rezultat a fost transcris invers în ADNc folosind kitul SuperScript III RNaseH- revers transcriptază (Invitrogen) și primeri aleatori (Promega, Charbonnières, Franța) conform instrucțiunilor fiecărui producător. Nivelurile de exprimare a genei țintă au fost determinate prin RT-PCR cantitativă în timp real folosind primerii specifici PCR în timp real (Tabelul 2). Pentru a evita amplificarea ADN-ului genomic, perechile de primer au inclus o oligonucleotidă care se întinde pe intron atunci când este posibil. Diferitele produse PCR au fost verificate inițial prin secvențiere pentru a confirma natura ampliconului.
Tabelul 2. Exemple de secvențe
F, exemplu înainte; R, grund invers; nt, nucleotide. Nr. De acces GenBank nr. sau aderarea Sigenae nr. este după cum urmează: factor de alungire-1α (EF1α), AF498320; glucocinază (GK), AF135403; piruvat kinază (PC), AF246146; fosfoenolpiruvat carboxicinază (PEPCK), AF246149; glucoză 6-fosfatază 1 (G6Pase1), tcay0019b.d.18_3.1.s.om.8.1-1693; G6Pase2, AF120150; serina dehidratază (SD), tcay0007b.b.13_3.1.s.om.8; acizi grași sintaza (FAS), tcab0001c.e.06_5.1.s.om.8; ATP-citrat liasă (ACLY), CA349411.1; glucoză-6-fosfat dehidrogenază (G6PDH), CA351434; carnitina palmitoiltransferază 1a (CPT1a), AF 327058; CPT1b, AF606076.
Eficiența PCR (E) a fost măsurată ca panta unei curbe standard utilizând diluarea în serie a ADNc și toate valorile au fost peste 1,9.
analize statistice.
Tabelul 3. Principalele caracteristici ale păstrăvului curcubeu din FL și LL
Valorile sunt mijloace ± SE (n = 3). FL și LL, linii musculare grase și slabe ale peștilor; WW, greutate umedă.
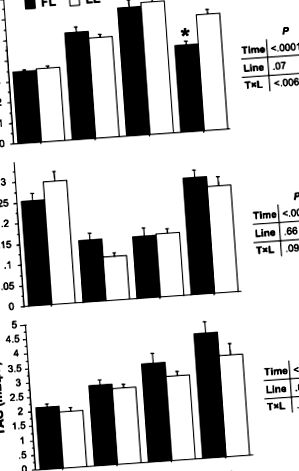
FIG. 1.Nivelurile plasmatice de glucoză, acizi grași liberi (FFA) și triacilglicerol (TAG) la peștii din grăsime (FL) și liniile slabe (LL) 3, 8 și 24 de ore după realimentare (0 corespunde peștilor de post). Datele sunt mijloace ± SE de 9 probe. P valorile pentru timp, linie și efecte de interacțiune sunt indicate la dreapta. *P
Calea de semnalizare Act/TOR.
FIG. 2.Analiza Western blot a Akt, țintă a rapamicinei (TOR), proteine kinazei S6 ribozomale p70 1 (S6K1) și fosforilării proteinei S6 în ficatul păstrăvului curcubeu postit și 3h de la FL și LL. P-Akt, P-TOR, P-S6K1 și P-S6, forme fosforilate ale Akt, TOR, S6K1 și, respectiv, S6. Douăzeci de micrograme de proteine totale pe bandă au fost încărcate pe gel. Este prezentată o pete reprezentativă. Western blot au fost efectuate pe 6 probe individuale care au oferit rezultate similare.
FIG. 3.Analiza Western blot a fosforilării proteinelor Akt, TOR, S6K1 și S6 în ficatul păstrăvului curcubeu refinat de 3 h din FL și LL. Douăzeci de micrograme de proteine totale pe bandă au fost încărcate pe gel. Este prezentată o pete reprezentativă. Western blot au fost efectuate pe 6 probe individuale care au oferit rezultate similare. Graficele reprezintă raportul dintre proteina fosforilată și cantitatea totală de proteină vizată. Datele privind fosforilarea proteinelor sunt mijloace ± SE (n = 6) și au fost analizate folosind teste nonparametrice Mann-Whitney. *P
Nivelurile de ARN Messenger ale genelor țintă.
FIG. 4.Expresia genică a enzimelor selectate în ficatul păstrăvului curcubeu postat (bare deschise) și 24 de ore (bare umplute) din FL și LL. Glucokinază (GK), piruvat kinază (PK), izoforme 1 și 2 glucoză-6-fosfatază (G6Pase1 și G6Pază2), fosfoenolpiruvat carboxicinază (PEPCK), serină dehidratază (SD), ATP-citrat lizază (ACLse), acid gras ), glucoză-6-fosfat dehidrogenază (G6PDH), carnitină palmitoiltransferază 1 (CPT1a și CPT1b) și nivelurile de mARN ale proteinei de legare a elementului sterol (SREBP1) au fost evaluate folosind RT-PCR în timp real. Valorile expresiei sunt normalizate cu transcrieri exprimate cu factor de alungire-1α (EF1α). Rezultatele sunt mijloace + SE (n = 6) și au fost analizate folosind ANOVA bidirecțională urmată de testul Student-Newman-Keuls pentru comparație multiplă. *P
Scopul prezentului studiu de a realiza o mai bună înțelegere a mecanismelor moleculare care duc la acumularea de grăsime musculară prin compararea liniilor de pește selectate pentru un conținut scăzut și ridicat de grăsime musculară. Studiul nostru s-a concentrat pe căile de semnalizare insulină/nutrienți ca un regulator major al metabolismului și a examinat expresia mai multor gene țintă legate de metabolism.
Liniile emise din a treia generație de selecție au prezentat conținut similar de grăsime corporală, dar conținut diferit de grăsime musculară (20). Continuarea procedurii de selecție (a patra generație de selecție) a crescut divergența nivelurilor de grăsime musculară, ceea ce a condus la un conținut sporit de grăsime corporală. Absența diferenței în țesutul adipos abdominal, care este locul predominant de depozitare a grăsimii în salmonide, distinge acest model de alte modele de animale de fermă obținute prin selecție genetică, care au dus, în general, la creșterea globală a grăsimii corporale peste diferitele compartimente ale corpului (3, 38). În studiul de față, creșterea adipozității musculare la peștii FF nu s-a datorat ratei de creștere mai mari sau eficienței mai bune a hranei. În plus, selecția genetică a crescut creșterea grăsimii fără o scădere concomitentă a creșterii azotului.
Peștii carnivori, cum ar fi păstrăvul curcubeu, se caracterizează printr-o capacitate limitată de a utiliza carbohidrații dietetici în mod eficient (48) și sunt astfel considerați a fi „intoleranți la glucoză” (10a, 24a). Administrarea orală sau intravenoasă de glucoză și o dietă bogată în carbohidrați au ca rezultat hiperglicemie persistentă la diferite specii de pești, inclusiv păstrăvul curcubeu (5, 7, 22a, 26a, 31). Comparația nivelurilor de glucoză plasmatică a celor două linii a arătat că peștii din FL păreau să aibă o capacitate mai bună de a gestiona nivelurile de glucoză plasmatică postprandiale decât peștii LL. Glicemia a rămas semnificativ crescută la peștii LL la 24 de ore după realimentare, în timp ce a scăzut la peștii FL pentru a atinge niveluri similare cu cele măsurate la peștii cu post de 48 de ore. Acest rezultat întărește ipoteza că selecția divergentă pentru conținutul de grăsime musculară la păstrăv a modificat mecanismele de utilizare a combustibilului, în special capacitatea peștilor de a utiliza glucoza.
Homeostazia glucozei rezultă dintr-un echilibru între utilizarea glucozei prin glicoliză și producția de glucoză prin gluconeogeneză și glicogenoliză. Investigația expresiei genelor GK și PK a sugerat că calea glicolitică nu a fost reglementată diferențial între linii. Acest lucru ar trebui confirmat prin analiza întregului flux glicolitic atât la nivel molecular, cât și celular. Inhibarea postprandială afectată a producției hepatice endogene de glucoză este o caracteristică metabolică a păstrăvului curcubeu (27-29, 46). Acest studiu a confirmat din nou că gluconeogeneza este doar ușor afectată de realimentarea la păstrăvul curcubeu, deoarece din cele trei gene gluconeogene examinate (cele 2 izoforme ale G6Pase și PEPCK), doar prima izoformă a G6Pase a fost reglată în jos la 24 de ore după realimentare. Analiza celor două izoforme ale G6Pase a confirmat că, la pești, copii diferite ale unei gene rezultate în urma evenimentului de duplicare a genomului ar fi putut evolua separat și să fi dobândit diferite modele de expresie, așa cum sa raportat anterior pentru pro-opiomelanocortină (22). În ceea ce privește aceste enzime, peștii FL și LL au răspuns în mod similar la realimentare, sugerând că producția endogenă de glucoză nu a fost responsabilă de persistența creșterii glucozei plasmatice peste 24 de ore după realimentare la peștii LL.
În cele din urmă, am demonstrat, de asemenea, că mARN-ul CPT1b a fost mai puțin reprezentat în ficatul FL decât peștele LL. Cu toate acestea, din moment ce izoforma a fost exprimată în mod similar în ambele linii și activitatea CPT1 nu a fost măsurată în prezentul studiu, nu putem concluziona în mod clar că peștii LL au o capacitate sporită de a utiliza acizii grași ca sursă de energie, deși constatările noastre confirmă parțial cele obținute. din pești originari din generația anterioară de selecție (20).
Perspectivă și semnificație
MULȚUMIRI
Mulțumim lui MJ Borthaire, E. Plagnes-Juan, C. Vachot și FA Poujade pentru asistență tehnică, precum și personalului tehnic de la Institutul Național de Cercetări Agronomice (INRA) instalațiile experimentale Pisciculture Expérimentale INRA des Monts d'Arrée (Drennec, Sizun, Franța).
- Activare musculară și recrutare musculară Terapia Delos
- Prezentare generală Obiective nutriționale - MUSCUL KAGED
- PRIME PubMed Influența atelei Esmarch asupra masticării și a activității mușchilor limbii în timpul somnului
- Recenzii NutraVesta ProVen - Ce trebuie să știți înainte de a-l cumpăra - CONȚINUT SPONSORIZAT Invitat
- Conținutul lui Shukranlillah - Pagina 64