Nicolae V. DiPatrizio
1 Divizia de Științe Biomedice, Universitatea din California, Riverside, Școala de Medicină, Riverside, California;
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Miki Igarashi
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Vidya Narayanaswami
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Conor Murray
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Joseph Gancayco
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Amy Russell
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Kwang-Mook Jung
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
Daniele Piomelli
2 Departamentul de Anatomie și Neurobiologie, Universitatea din California, Irvine, Școala de Medicină, Irvine, California;
3 Departamentul de farmacologie, Universitatea din California, Irvine, Facultatea de Medicină, Irvine, California;
4 Departamentul de chimie biologică, Universitatea din California, Irvine, Facultatea de Medicină, Irvine, California; și
5 Descoperirea și dezvoltarea drogurilor, Institutul italian de tehnologie, Genova, Italia
Abstract
diviziunile parasimpatice și simpatice ale sistemului nervos autonom contribuie în moduri importante la reglarea echilibrului energetic (5). Studiile efectuate la șoareci au arătat că activarea receptorilor melanocortinei-4 centrale, care reduc alimentarea și sunt critice pentru menținerea metabolismului energetic (53), inhibă neuronii colangergici parasimpatici preganglionici din nucleul motor dorsal al vagului (DMV) și activează preganglionicul simpatic neuroni din măduva spinării (44). Dovezile sugerează că semnalele colinergice din nervul vag eferent controlează mecanismele de semnalizare periferice intestin-creier care reglează hrănirea. De exemplu, administrarea antagonistului atropinei de azot metilic al receptorului muscarinic al acetilcolinei restricționat periferic (mAchR) inhibă hrănirea după un post rapid (33), precum și aportul fals al unei diete lichide la șobolani (25). O posibilă interpretare a acestor rezultate este că mAchR-urile periferice participă la controlul consumului de alimente, dar mecanismele prin care s-ar putea produce o astfel de reglare rămân necunoscute.
MATERIALE ȘI METODE
Animale
Șobolani Sprague-Dawley masculi adulți (250-300 g) au fost achiziționați de la Charles River (Wilmington, MA) și adăpostiți la temperatura camerei (22 ° C) în cuști suspendate cu fund de sârmă pentru a preveni coprofagia în timpul experimentelor de privare a alimentelor. Animalele au fost întreținute într-un ciclu de lumină-întuneric de 12: 12 ore (luminile aprinse la 0630 și oprite la 1830) și au avut acces gratuit la apă și la peletele standard de rozătoare (Harlan Teklad 2020, America de Nord), cu excepția cazului în care s-a observat în timpul lipsei de hrană experimente (toate au acces gratuit la apă). Toate experimentele au început la ora 0900. Toate procedurile au respectat orientările Institutului Național de Sănătate pentru îngrijirea și utilizarea animalelor de laborator și au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor de la Universitatea din California, Irvine.
Programul chimic și administrativ
Efectele hrănitoare ale inhibării mAchR m3 intestinale și CB1R
Toate animalele (n = 10) au primit tratamente vehicul (de exemplu, soluție salină intraduodenală la 1 ml și DMSO intraperitoneal la 0,5 ml/kg cu 20 de minute înainte de realimentare după un post de 24 de ore) în prima zi de testare și în ultima zi de testare . Valorile medii pentru aporturile de realimentare de 1 oră după fiecare tratament al vehiculului, care nu au diferit statistic (25,1 ± 1,6 și 22,3 ± 1,9 g/kg corp greutate; Testul t al studentului, cu două cozi P = 0,28), au fost mediate pentru comparație statistică vs. tratamente medicamentoase. Animalele au fost apoi împărțite în două subgrupuri (n = 5/grup): subgrupul A a primit DAU5884 (100 nmol id) și AM6545 (10 mg/kg ip), iar subgrupul B a primit DAU5884 (100 nmol id) și vehiculul DMSO intraperitoneal. În următoarea zi de testare, subgrupul A a primit DAU5884 (300 nmol id) și vehiculul intraperitoneal DMSO, iar subgrupul B a primit DAU5884 (300 nmol id) și AM6545 (10 mg/kg ip). În ultima zi a tratamentelor medicamentoase, toate animalele au primit vehicul salin intraduodenal și AM6545 intraperitoneal (10 mg/kg ip).
Infuzie intraduodenală de macronutrienți
Șobolanii au fost lipsiți de alimente timp de 24 de ore și apoi au fost perfuzați cu o rată de 0,5 ml/min timp de 10 min în duoden cu vehicule (soluție salină sterilă) sau concentrații echicalorice (10 kcal total) de Intralipid, zaharoză sau Peptonă . Țesuturile au fost recoltate (vezi Prelucrarea țesuturilor) la 30 de minute după începerea perfuziilor.
Chirurgii
Catetere intraduodenale.
Vagotomie subdiafragmatică.
Toți șobolanii au fost pregătiți pentru operație, așa cum s-a subliniat mai sus (vezi cateterul intraduodenal). Stomacul și splina au fost retractate ușor, iar diviziunile dorsale și ventrale ale nervului vag de sub diafragmă au fost izolate cu forceps fin și decojite din esofag. Două suturi au fost plasate la 1,5 cm distanță pe fiecare diviziune a vagului (patru ochiuri în total) și tot țesutul neuronal dintre fiecare set de ochiuri a fost izolat și îndepărtat cu foarfece fine. Animalele care au fost supuse chirurgiei simulate de control au fost supuse acelorași proceduri descrise mai sus, cu excepția faptului că nervul vag nu a fost manipulat și a fost lăsat intact. Peretele muscular abdominal a fost închis ca mai sus (vezi cateter intraduodenal). Testarea a început după 7-10 zile de recuperare după operație.
Prelucrarea țesuturilor
Extracții lipidice.
Toate animalele au fost anesteziate cu izofluran în momentul recoltării țesuturilor și apoi jejunul sau alte organe au fost îndepărtate rapid și clătite cu PBS și congelate rapid în N2 lichid. Înainte de înghețarea rapidă, mucoasa jejunală a fost separată de seroasă prin răzuire cu o lamă de sticlă. Toate țesuturile au fost ulterior depozitate la -80 ° C până la momentul procesării. Țesuturile congelate au fost cântărite și omogenizate în 1,0 ml de metanol conținând următoarele standarde interne: [2 H8] -2-AG (Cayman Chemical, Ann Arbor, MI) și dinonadecadienoin (Nu-Chek Prep, Elysian, MN). Lipidele au fost extrase cu cloroform (2 vol) și spălate cu apă (1 vol). Fazele organice au fost colectate și fracționate prin cromatografie pe coloană cu silicagel în pat deschis, așa cum s-a descris anterior (3). Fracțiile eluate au fost uscate sub N2 și reconstituite în 0,1 ml cloroform: metanol (1: 3) pentru analize de cromatografie lichidă/spectrometrie de masă (LC/MS).
Măsurarea 2-AG.
Măsurarea 1-stearoilului, 2-arahidonoil-sn-glicerinei.
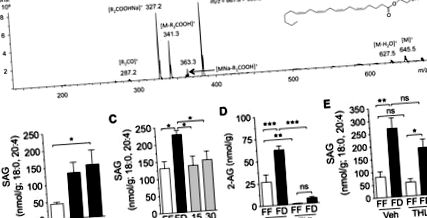
Am folosit un sistem Agilent 1100-LC cuplat la un detector MS Ion-Trap XCT interfațat cu ESI (Agilent Technologies). Specii de diacilglicerol (DAG) au fost separate folosind o coloană Poroshell C18 (75 × 2,1 mm ID, 5 μm), eluată printr-un gradient de metanol (0,5% acid acetic, 5 nM acetat de amoniu) în apă (0,5% acid acetic, 5 nM acetat de amoniu) (de la 60 la 100% metanol în 6 min, 100% în 6-8 min, 100-60% în 8-9 min și 60% în 9-10 min) la un debit de 1,0 ml/min. Temperatura coloanei a fost menținută la 30 ° C. Tensiunea capilară a fost setată la 3,5 kV, iar tensiunea skimmer a fost stabilită la 40 V. N2 a fost utilizat ca gaz de uscare la un debit de 10 l/min, la o temperatură de 350 ° C și la o presiune de nebulizator de 60 psi. Heliul a fost folosit ca gaz de coliziune, iar amplitudinea fragmentării a fost stabilită la 1,3 V. Speciile DAG au fost identificate în modul de ionizare pozitivă, pe baza timpilor de retenție și a proprietăților MS 2, folosind standarde autentice (Nu-Chek Prep) ca referințe. Monitorizarea reacțiilor multiple a fost utilizată pentru a achiziționa spectre MS în tandem cu scanare completă a ionilor selectați 1-stearoil, 2-arahidonoil-sn-glicerol (SAG). Cromatogramele ionice extrase au fost utilizate pentru a cuantifica 1-stearoil, 2-arahidonoil-sn-glicerol (m/z = 667,8> 383,2) și dinonadecadienoină (m/z = 667,8> 373,5), care a fost utilizat ca standard intern.
RT-PCR
Analize statistice
Rezultatele sunt exprimate ca mijloace ± SE. Semnificația diferențelor dintre grupuri a fost evaluată prin testul t Student și ANOVA unidirecțional, urmată de Newman-Keuls sau evaluarea post hoc a lui Dunnett sau o ANOVA bidirecțională urmată de o evaluare post hoc Newman-Keuls sau Sidak, atunci când este cazul., pentru compararea mediilor atunci când diferențe semnificative au fost găsite de ANOVA. Diferențele au fost considerate semnificative dacă P Fig. 1A; P Fig. 1B; P Fig. 1C; P Fig. 1D). Pentru a identifica macronutrienții individuali care ar putea fi responsabili pentru controlul nivelurilor jejunale de 2-AG, am implantat catetere la șobolani și am infuzat în duoden macronutrienți separați (ecicaloric, 10 kcal) după 24 de ore de lipsă de alimente. Toți macronutrienții au redus în mod egal nivelurile de 2-AG în 30 de minute de perfuzie, comparativ cu perfuzia vehiculului (Fig. 1E): grăsime (Intralipid, P Fig. 2A). Așa cum s-a văzut cu 2-AG (Fig. 1B), nivelurile de SAG jejunale au crescut după lipsa de alimente, atingând semnificație statistică după 24 de ore, comparativ cu animalele cu hrană liberă (Fig. 2B; P Fig. 2C; P Fig. 2C; P Fig. . .D2; P Fig. 2D; nu semnificativ). Spre deosebire de efectele sale asupra 2-AG (Fig. 2D), THL nu a afectat semnificativ nivelul SAG (Fig. 2E, nu semnificativ), ceea ce este în concordanță cu inhibarea activității DGL. Rezultatele sugerează că calea DGL este critică în formarea 2-AG în mucoasa jejunului.
Calea diacilglicerol lipazei-alfa (DGL) reglează 2-AG în timpul postului și al alimentării. A: identificarea 1, stearoil, 2-arahidonoil-sn-glicerol (SAG) în mucoasa jejunului șobolanilor prin cromatografie lichidă/spectrometrie de masă tandem (LC/MS/MS). Fragmentul [MNa-R1COOH] + abundent (m/z = 383,2) a fost selectat pentru cuantificarea nivelurilor de SAG în mucoasa jejunului. B: curs de timp al lipsei de hrană la niveluri de SAG în mucoasa jejunului. FF este notat prin bare deschise; FD este notat prin bare închise. * P Fig. 3A; P Fig. 3A; nu semnificativ). Șobolanii vagotomizați lipsiți de alimente au prezentat, de asemenea, niveluri reduse de 2-AG în jejun, comparativ cu controalele lipsite de alimente acționate în mod fals (Fig. 3A; P Fig. 3B; P Fig. 3B; nesemnificativ; n = 4-6) . Mai mult, șobolanii lipsiți de alimente tratați cu atropină au prezentat niveluri semnificativ mai mici de 2-AG în jejun, în comparație cu șobolanii tratați cu vehicul lipsiți de alimente (Fig. 3B; P Fig. 3C, cerebelul a fost utilizat ca un control pozitiv). Administrarea intraduodenală a unei doze mici (300 nmol) a antagonistului selectiv m3, DAU 5884, a scăzut nivelurile jejunale de 2-AG la șobolani lipsiți de hrană de 24 de ore (Fig. 3E; P Fig. 3E; n = 5). Colectiv, constatările sugerează că lipsa alimentelor declanșează producția de 2-AG în intestinul superior prin stimularea activării colinergice a receptorilor m3.
Receptorii M3 mediază semnalizarea Orexigenică 2-AG în intestin
Controlul colinergic al semnalizării endocannabinoide în intestin. Se crede că nervul vag eferent eliberează acetilcolină pe receptorii m3 muscarinici de acetilcolină din jejunul de șobolan. La rândul său, în timpul unui post, activarea receptorilor muscarinici de acetilcolină m3 duce la creșteri ale producției de 2-AG prin calea diacilglicerol lipazei. 2-AG activează receptorii CB1 canabinoizi locali și conduce alimentarea și, prin urmare, se sugerează că este un semnal periferic de foame. SI, intestin subțire.
Semnalizarea endocannabinoidă în intestinul subțire superior promovează aportul de alimente (12). Am raportat anterior că degustarea grăsimilor dietetice, dar nu a proteinelor sau carbohidraților, inițiază producția de endocannabinoizi, 2-AG și anandamidă, în jejunul șobolanilor care hrănesc fals (10). Expunerea orală la acizi grași liberi mononesaturați sau diunsaturați (de exemplu, acid oleic și respectiv acid linoleic) crește nivelurile endocannabinoide jejunale, care, la rândul lor, activează CB1R-urile locale și determină un aport suplimentar de grăsime (10, 11). Într-adevăr, administrarea intraduodenală a antagonistului CB1R rimonabant sau administrarea intraperitoneală a antagoniștilor CB1R restricționați periferic URB447 (26) și AM6545 (7) au inhibat hrănirea falsă a grăsimilor (10, 11). Foarte important, întreruperea chirurgicală a nervului vag a împiedicat creșterea nivelului endocannabinoid în timpul hrănirii simulate a grăsimilor, sugerând astfel că neurotransmisia colinergică controlează producția de endocannabinoizi în jejun, care, la rândul său, generează feedback pozitiv creierului pentru a conduce la aportul masă grasă.
Căile moleculare și neuronale specifice prin care CB1R-urile jejunale semnalează creierului pentru a conduce hrănirea rămân de determinat. Dovezile sugerează că endocannabinoizii ar putea să nu interacționeze direct cu CB1Rs pe vagul aferent, deoarece șoarecii nuli pentru CB1Rs selectiv pe fibrele vagale nu au prezentat modificări ale greutății corporale (51). Cu toate acestea, 2-AG ar putea interacționa indirect cu nervul vag printr-un mesager intermediar, cum ar fi CCK. Este plauzibil ca endocannabinoizii să inhibe eliberarea CCK din intestin, ceea ce ar întârzia funcțional încetarea mesei. Într-adevăr, celulele enteroendocrine I - care produc și secretă CCK - exprimă mARN pentru CB1Rs (48), iar inhibarea mAchRs cu atropină îmbunătățește eliberarea CCK ca răspuns la hrănirea la șobolani (29). Mai mult, similar cu 2-AG în intestin, nivelurile circulante de grelină cresc proporțional cu timpul de la ultima masă la oameni și la rozătoare (2, 23). Important, celulele gastrice care produc și secretă grelină conțin CB1R, iar inhibarea CB1R cu rimonabant reduce eliberarea de grelină la șobolani, dar numai după lipsa de hrană (41).
Rapoartele diferă cu privire la eficacitatea vagotomiei singure pentru reducerea greutății la rozătoare și la oameni (19, 30, 42, 52). În consecință, studii suplimentare sunt critice pentru a determina rolurile pentru ramuri specifice ale vagului în controlul greutății corporale și diferențele potențiale dintre rozătoare și oameni în acest răspuns. Cu toate acestea, oamenii care au suferit o bandă gastrică laproscopică în combinație cu vagotomia truncală au raportat absența unor sentimente subiective de foame, în ciuda modificărilor în creșterea în greutate corporală în comparație cu subiecții cu banda gastrică singură (27). Acest rezultat sugerează că vagotomia poate reduce activitatea căilor care promovează foamea la om printr-un mecanism care include scăderea semnalizării endocannabinoide în intestin; cu toate acestea, rămâne de testat această ipoteză. Mai mult, trebuie menționate eventualele avertismente în interpretarea rezultatelor experimentelor de vagotomie din acest articol, având în vedere perturbările cunoscute în golirea gastrică, aportul de alimente și greutatea corporală care apar în urma vagotomiei subdiafragmatice complete la rozătoare.
Perspective și semnificație
Rezultatele prezentate aici dezvăluie că, similar cu degustarea grăsimilor dietetice (10, 11), postul stimulează producția de 2-AG în mucoasa jejunului și conduce la hrănire. Acest lucru sugerează că semnalizarea endocannabinoidă mediată de 2-AG în intestin poate fi un semnal general al foamei care este inițiat în mai multe condiții comportamentale și metabolice. Important, descoperirile noastre implică, de asemenea, că neurotransmisia colinergică - posibil controlată de nervul vag eferent - participă la controlul hrănirii printr-un mecanism care necesită activarea m3 mAchRs în intestin, mobilizare locală 2-AG și activare dependentă de 2-AG a CB1R-urilor. Astfel, semnalizarea endocannabinoidă în intestin poate să fi fost selectată de evoluție datorită proprietăților sale de prosurvență în timpul foametei, care, la rândul lor, pot favoriza supraalimentarea și obezitatea în timpurile moderne de abundență (13). Ca atare, prezenta investigație avansează înțelegerea noastră asupra semnalizării endocannabinoide intestin-creier și sugerează potențiale noi căi farmacologice pentru controlul apetitului.
SUBVENȚII
Autorii recunosc cu recunoștință sprijinul din partea S.U.A. Institutul Național pentru Abuzul de Droguri Grant K99/R00 DA-034009 către N. V. DiPatrizio și din S.U.A. Institutul Național al Diabetului și al Tulburărilor Digestive și Renale acordă DK-073955 lui D. Piomelli.
DIVULGĂRI
Autorii raportează următoarele conflicte de interese. D. Piomelli este cofondator al Thesan Pharmaceuticals, o companie biofarmaceutică dedicată dezvoltării de terapii inovatoare pentru bolile de piele. D. Piomelli deține capitaluri proprii în companie și laboratorul său a primit sprijin de cercetare care nu are legătură cu lucrările prezentate aici.
- Ghid de post Nativity Fast 2019; Biserica Ortodoxă Toți Sfinții
- Post în 24 de ore de lumina soarelui Ramadan în cercul polar polar Mvslim
- Postul în Ramadan nu este asociat cu deteriorarea bolii renale cronice A prospective
- Postul este unul dintre cei cinci stâlpi ai Islamului
- Călătorii de post și auto-masaj limfatic - Academia Pământului