Rishi Rikhi
o clinică Cleveland, Departamentul de Medicină Internă, 9500 Euclid Avenue, Cleveland, OH, 44195, SUA
Tavankit Singh
b Cleveland Clinic, Departamentul de Gastroenterologie, Hepatologie și Nutriție, 9500 Euclid Avenue, Cleveland, OH, 44195, SUA
Jamak Modaresi Esfeh
b Cleveland Clinic, Departamentul de Gastroenterologie, Hepatologie și Nutriție, 9500 Euclid Avenue, Cleveland, OH, 44195, SUA
Abstract
Boala hepatică grasă nealcoolică (NAFLD) este un termen general care se referă la depunerea anormală a lipidelor în ficat și este utilizat pentru a descrie spectrul bolilor variind de la steatoza hepatică până la steatohepatita nealcoolică la ciroză. NAFLD este cea mai frecventă cauză a bolilor hepatice cronice și a doua cauză cea mai frecventă a cirozei. Deși fiziopatologia nu este pe deplin înțeleasă, există o legătură puternică între NAFLD și sindromul metabolic. Această revizuire se concentrează pe evoluția NAFLD în cadrul asistenței medicale primare, de la diagnosticarea diferențială la evaluarea fibrozei prin intermediul modelelor predictive care utilizează valori de laborator utilizate în mod obișnuit, biomarkeri și imagistică. Scopul acestui articol de revizuire este de a oferi un set de instrumente de screening și diagnostic pentru toți medicii de îngrijire primară, pentru a gestiona mai bine pacienții cu NAFLD.
Abrevieri
1. Introducere
Boala hepatică cronică (CLD) este a 12-a cauză principală de deces în Statele Unite (SUA) [1]. Cea mai frecventă cauză a CLD nu este doar în SUA, ci la nivel mondial este boala hepatică grasă nealcoolică (NAFLD) [2], [3], [4]]. NAFLD este în prezent a doua cea mai frecventă etiologie a cirozei la pacienții supuși transplantului hepatic [5] și se preconizează că va deveni principala cauză a transplantului hepatic până în 2020 [6,7]. Creșterea prevalenței NAFLD, examinată de sondajele naționale de examinare a sănătății și nutriției din 1988 până în 2008, ilustrând faptul că NAFLD ca cauză a CLD a crescut de la 46,8% în 1988 la 75,1% în 2008 este paralelă cu creșterea prevalenței obezității, diabetului zaharat și hipertensiune în aceeași perioadă de timp [4]. Pe lângă hipertensiune, diabet și obezitate; hipertrigliceridemia și nivelurile scăzute ale colesterolului lipoproteic cu densitate mare (HDL) s-au dovedit a fi, de asemenea, factori de risc pentru dezvoltarea NAFLD [8].
Mai mulți dintre factorii de risc de mai sus pentru NAFLD sunt afecțiuni cronice gestionate de furnizorii de asistență medicală primară (PCP) [9]. Astfel, PCP sunt de obicei cei care au posibilitatea de a diagnostica pacienții cu NAFLD și de a-l gestiona inițial [9]. Cu toate acestea, sondajele au constatat că 33% dintre PCP au subestimat prevalența NAFLD [9], 69% nu au identificat NAFLD ca o afecțiune importantă din punct de vedere clinic și 53% nu s-au simțit inconfortabil cu gestionarea NAFLD [9]. Prin urmare, există o nevoie urgentă de a educa PCP-urile cu privire la epidemiologie și de a rezolva această boală foarte frecventă pentru a oferi îngrijiri mai eficiente pacienților cu NAFLD. Acest articol de revizuire oferă o prezentare generală a NAFLD și a activității recomandate în cadrul asistenței medicale primare.
2. Ce este boala hepatică grasă nealcoolică?
tabelul 1
Stadiile NASH ale fibrozei.
| F 0 | Fără fibroză |
| F 1 | Fibroza perisinusoidală sau periportală |
| F 2 | Fibroza perisinusoidală și portală/periportală |
| F 3 | Fibroza de punte |
| F 4 | Ciroză |
3. Cum se dezvoltă NAFLD?
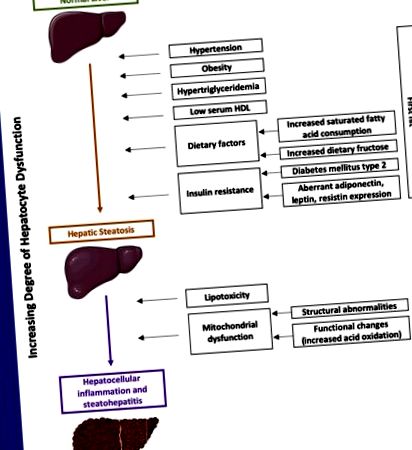
Fiziopatologia NAFLD este complexă și nu este pe deplin înțeleasă. Una dintre teoriile principale este ipoteza „cu două lovituri” (Fig. 1). Aici, prima lovitură duce la steatoză hepatică, iar a doua lovitură duce la steatohepatită și leziuni hepatocelulare. Ficatul permite homeostazia lipidelor și acest echilibru poate fi compensat la obezitate sau la persoanele cu un aport alimentar bogat în acizi grași saturați și fructoză, ducând la o depunere crescută de acizi grași în ficat, rezultând steatoză hepatică. Studiile au arătat că obezitatea abdominală (măsurată prin circumferința taliei) este mai puternic asociată cu NAFLD, deoarece grăsimea viscerală are rate mai ridicate de lipoliză, ducând la o creștere a livrării acizilor grași în ficat [19]. Un alt factor care duce la absorbția crescută a acizilor grași liberi și a trigliceridelor din ficat este rezistența la insulină [13]. Insulina suprimă în mod normal producția hepatică de lipoproteine cu densitate foarte mică (VLDL), care este bogată în trigliceride; astfel, rezistența la insulină duce la hipertrigliceridemie [19]. În plus, cantitatea mai mare de VLDL în fluxul sanguin duce la scăderea HDL [19]. Hormonii, cum ar fi adiponectina, leptina și rezistina reglează activitatea insulinei și expresia aberantă a acestor hormoni conduce în continuare la dezvoltarea NAFLD [20,21].
Patogenia NAFLD folosind ipoteza 2 hit.
Se crede că inflamația hepatică apare din lipotoxicitate și disfuncție mitocondrială [22]. Disfuncția mitocondrială include modificări structurale și funcționale, care afectează homeostazia grăsimilor ducând la creșterea inflamației și a metaboliților toxici derivați de lipide [22]. Lipotoxicitatea apare din acizii grași saturați care activează calea Jun N-kinază terminală (JNK), rezultând moartea hepatocitelor [22]. Excesul de acizi grași din lipoliză duce la creșterea oxidării acizilor, rezultând disfuncții mitocondriale [22]. Inflamația rezultată duce la activarea celulelor Kupffer, care eliberează citokine care afectează în continuare hepatocitele [22]. Procesul inflamator transformă celulele stelate hepatice în miofibroblaste, rezultând fibroză hepatică [22].
4. Factori de risc pentru NAFLD
Există o asociere puternică între NAFLD și sindromul metabolic [19,23]. Acest sindrom este definit ca având trei dintre următoarele afecțiuni: diabet zaharat, HDL scăzut, hipertrigliceridemie, hipertensiune și circumferința abdominală crescută [19]. Definițiile exacte pentru fiecare dintre aceste condiții variază în funcție de organizație sau societate [24]. Orientările Federației Internaționale a Diabetului din 2005 sunt utilizate în mod obișnuit în practică (Tabelul 2) [24].
masa 2
Liniile directoare ale federației internaționale pentru diabet în 2005.
Pacienții cu circumferință crescută a taliei, glucoză în post, tensiune arterială și trigliceride prezintă un risc mai mare de NAFLD de 4,9, 2,1, 1,8 și respectiv 1,6 ori [19]. Prevalența NAFLD variază de la 45% la 75% la diabetici și peste 50% la pacienții cu hipertensiune arterială [23]. Prevalența NAFLD la pacienții obezi este de 80-90% și aproximativ 90% la pacienții cu hiperlipidemie [25].
În timp ce majoritatea pacienților cu NAFLD au sindrom metabolic, cercetarea seminală sa concentrat asupra unei populații de pacienți care nu sunt obezi, dar au NAFLD [26]. Adesea, aceste cazuri, denumite în mod obișnuit „NAFLD slab” sunt trecute cu vederea deoarece nu se potrivesc prezentării tipice NAFLD [26]. Lean NAFLD ilustrează complexitatea fiziopatologiei NAFLD și subliniază interacțiunea dintre genetică și sindromul metabolic în dezvoltarea NAFLD [26]. Deși există informații limitate cu privire la motivele pentru care pacienții cu greutăți corporale normale dezvoltă NAFLD, cercetările au arătat că NAFLD slab este mai răspândit în rândul populației asiatice [26]. În plus, pacienții cu NAFLD slabă au în continuare cantități mai mari de țesut gras abdominal, deși greutatea corporală totală este normală [26].
Există, de asemenea, o componentă genetică puternică asociată cu dezvoltarea NAFLD, latino-americanii purtând cea mai mare povară a NAFLD, iar afro-americanii cea mai mică [27,28]. Un studiu prospectiv pe 320 de persoane în ambulatoriu a constatat că prevalența NAFLD este de 58,3% la hispanici, 44,4% la caucazieni și 35,1% la afro-americani [29].
Pentru a înțelege în continuare riscul genetic asociat cu NAFLD, cercetările privind polimorfismele din proteinele reglatoare implicate în metabolismul lipidelor hepatice și în semnalizarea insulinei sunt în prezent în curs [13]. Fosfolipaza 3 asemănătoare patatinului (PNPLA3) și membrul superfamiliar 2 transmembranar 6 (TM6SF2) sunt două gene bine caracterizate implicate în patogeneza NAFLD [22]. PNPLA3 codifică adiponutrina, o proteină care ajută la metabolismul trigliceridelor, iar TM6SF2 codifică proteina TM6SF2 care ajută la secreția VLDL din ficat [22]. Polimorfismele PNPLA3 și TM6SF2 sunt asociate cu acumularea crescută de trigliceride hepatice și steatoza hepatică [22].
În plus față de factorii de risc menționați mai sus, există și cauze mai puțin frecvente ale NAFLD [30]. Există mai multe tulburări ale metabolismului lipidic care duc la NAFLD: abetalipoproteinemie, hipobetalipoproteinemie familială, hiperlipidemie familială combinată, boală de stocare a glicogenului, boală Weber-Christian și lipodistrofie congenitală [30]. Anumite cauze nutriționale, inclusiv nutriția parenterală totală, pierderea în greutate chirurgicală și foamea pot duce și la NAFLD [30]. Nutriția parenterală totală pe termen lung are ca rezultat epuizarea carnitinei și colinei, jucători cheie în transportul acizilor grași și stocarea lipidelor, ducând la steatoză [30]. Pierderea chirurgicală în greutate duce la o creștere a acizilor grași liberi, iar foamea duce la epuizarea proteinelor, inclusiv la sinteza apolipoproteinelor, ambele ducând la NAFLD [30]. În cele din urmă, s-a demonstrat că mai multe medicamente promovează NAFLD, inclusiv amiodaronă, tamoxifen, metotrexat, corticosteroizi și terapie antiretrovirală foarte activă [30].
5. Prezentare clinică și modalități de diagnostic
- UH Westshore Medici de îngrijire primară; Asistente medicale care oferă îngrijire primară în județele Lorain și Cuyahoga
- Ultra Trim Keto Review Funcționează pastilele cetone BHB Ultra Trim
- Tratamentul chirurgical al bolii hepatice grase nealcoolice atât în HMER sever
- Alimentația necontrolată și obezitatea la pacienții adulți de îngrijire primară - ScienceDirect
- Alimentația necontrolată și obezitatea la pacienții adulți de îngrijire primară - PubMed