Abstract
Scopuri/ipoteze
Efectul n-3 tratamentul cu acizi grași cu privire la percepția temperaturii ca modalitate a funcției nervoase senzoriale este incert. La pacienții cu boală hepatică grasă nealcoolică (NAFLD), atât cu cât și fără diabet de tip 2, am: (1) testat dacă tratamentul de 15-18 luni cu 4 g/zi de acid docosahexaenoic plus eicosapentaenoic (DHA + EPA) s-a îmbunătățit la cald (HPT) și pragurile de percepție a temperaturii la rece (CPT) și (2) au explorat factorii asociați cu HPT și CPT, într-un studiu randomizat, dublu-orb, controlat cu placebo.
Metode
Efectul tratamentului (n = 44) la HPT, CPT și indicele de percepție a temperaturii (TPI: diferența dintre HPT și CPT) a fost măsurat la degetul mare la 90 de indivizi fără neuropatie; n = 30). Participanții au fost randomizați 1: 1, folosind numerotarea secvențială, de către personal independent de echipa de studiu. Toți participanții și toți membrii echipei de cercetare au fost orbi la atribuirea grupului. Datele au fost colectate la Centrul de Cercetări Biomedicale al Institutului Național de Cercetare în Sănătate din Southampton. Efectele tratamentului și independența asociațiilor au fost testate prin modelare de regresie.
Rezultate
Vârsta medie ± SD a fost de 50,9 ± 10,6 ani. La bărbați (n = 53) și femein = 37), HPT (° C) au fost 46,1 ± 5,1 și 43,1 ± 6,4p = 0,02), CPT (° C) au fost 22,7 ± 3,4 și 24,5 ± 3,6p = 0,07) și TPIs (° C) au fost 23,4 ± 7,4 și 18,7 ± 9,5p = 0,008), respectiv. În analizele univariate, procentul total de grăsime corporală (măsurat prin absorptiometrie cu raze X cu energie duală [DXA]) a fost asociat cu HPT (r = –0,36 p = 0,001), CPTr = 0,35 p = 0,001) și TPIr = 0,39 p = 0,0001). În modelele de regresie ajustate multivariabil, ajustând în funcție de vârstă, sex și alte posibile confuzii, numai procentul de grăsime corporală a fost asociat independent cu HPT, CPT sau TPI (p = 0,006, p = 0,006 și p = 0,002, respectiv). Tratamentul DHA + EPA nu a modificat HPT, CPT sau TPI (p = 0,93, p = 0,44 și p = 0,67, respectiv). Nu au fost raportate efecte adverse importante sau efecte secundare.
Concluzii/interpretare
Procentul mai mare de grăsime corporală este asociat cu o percepție îmbunătățită a temperaturii. Nu a existat niciun beneficiu al tratamentului cu doze mari n-3 acizi grași la praguri pentru a detecta stimuli calzi sau reci.
Înregistrarea procesului:
Finanțarea:
Această lucrare a fost susținută de Institutul Național pentru Cercetări în Sănătate prin intermediul subvenției NIHR Southampton Biomedical Research Unit și de o bursă de formare în domeniul cercetării în domeniul sănătății Diabetes UK acordată KMcC (Diabetes UK. BDA 09/0003937).
Introducere
Neuropatiile mici ale fibrelor nervoase senzoriale (SFSN) dau naștere simptomelor afectării sensibilității nervoase și durerii neuropatice care afectează peste 90% dintre persoanele cu diabet zaharat tip 1 și tip 2 [1, 2] și sunt principalii factori inițiatori pentru ulcerarea piciorului și amputarea membrelor la persoanele cu diabet [3]. Mecanismele care stau la baza SFSN și durerea neuropatică nu sunt bine înțelese, dar pot include factori metabolici, cum ar fi niveluri crescute de glucoză intracelulară atât în țesuturile vasculare, cât și în țesuturile neuronale, care pot duce la creșterea stresului oxidativ și/sau a afectării microvasculare și la reducerea fluxului sanguin nervos [4, 5 ].
Testarea senzorială cantitativă (QST) este o metodă de evaluare a sistemului nervos somatosenzorial și este utilizată în mod obișnuit în evaluarea clinică a funcției fibrelor nervoase senzoriale mari și mici [6, 7]. Recent am arătat folosind QST al funcției nervoase mielinizate mari că atât îmbătrânirea, cât și o măsură a reactivității microvasculare au fost asociate independent cu pragul modificat de percepție a vibrațiilor (VPT) la 125Hz într-un grup de pacienți cu risc ridicat, fără dovezi de neuropatie periferică evidentă [8]. QST a fost, de asemenea, utilizat pentru a studia deficitele funcționale în neuropatiile cu fibre mici, pragurile de percepție a temperaturii fiind unul dintre testele cele mai utilizate [9-11]. Astfel de teste oferă o evaluare indirectă, dar reproductibilă, a funcției nervoase mici a omului [12, 13].
Nu există încă tratamente care să prevină sau să inverseze neuropatia diabetică dureroasă. Spray-urile vasodilatatoare pot îmbunătăți fluxul sanguin nervos [14] și acidul alfa lipoic [15] (ca produs care conține sulf derivat din acidul octanoic al acidului gras cu opt atomi de carbon) s-a dovedit a ameliora moderat durerea în studiile clinice, cu mai puține efecte secundare decât opioidele și antidepresivele [16]. Tratament cu doze mari polinesaturate cu lanț lung n-3 acizi grași, cum ar fi acidul eicosapentaenoic (EPA, 20: 5 n-3) și acid docosahexaenoic (DHA, 22: 6 n-3) s-a demonstrat că îmbunătățește percepția vibrațiilor și simptomele clinice ale neuropatiei la pacienții cu diabet zaharat de tip 2 [17] și îmbunătățește funcția endotelială în dislipidemia, bărbații supraponderali [18], precum și oferă neuroprotecție prin creșterea fluxului sanguin nervos într-un experiment model de neuropatie diabetică [19]. Cu toate acestea, beneficiul lanțului lung n-3 acizi grași la pacienții cu risc, dar fără neuropatie periferică, rămân incerti.
Într-un sub-studiu pre-specificat al evaluării Wessex a markerilor hepatici și cardiovasculari grași în NAFLD cu studiu OMacor thErapy (WELCOME) (ClinicalTrial.gov nr. De înregistrare NCT00760513) [20, 21] [un randomizat dublu-orb controlat cu placebo test), am testat efectul tratamentului DHA + EPA (Omacor/Lovaza) asupra pragurilor de percepție a temperaturii la cald și la rece. Scopul nostru general a fost să testăm ipoteza că cea mai mare doză autorizată de DHA + EPA n-Tratamentul cu 3 acizi grași (4 g/zi ca esteri etilici) pe o perioadă de minimum 15 luni și maximum 18 luni a avut efecte benefice asupra funcției nervoase senzoriale mici la pacienții cu risc crescut de neuropatie, care au avut rezistență la insulină și grăsimi nealcoolice boală hepatică (NAFLD) (cu sau fără diabet de tip 2).
Metode
Design de studiu
Participanții au făcut parte din studiul WELCOME și investigațiile au fost aprobate de comitetul local de etică al cercetării (REC: 08/H0502/165) [20, 21]. O sută cinci persoane au fost recrutate la studiu (a se vedea Materialul suplimentar electronic [ESM] Fig. 1 pentru diagrama consortului și testarea efectului intervenției asupra acestui obiectiv secundar). Participanții au fost excluși din analiza actuală dacă aveau dovezi de neuropatie periferică distală în picioare, așa cum sugerează eșecul lor de a detecta un monofilament de 10 g [22] (n = 4), sau dacă au avut dovezi ale bolii oculare diabetice la screeningul retinei (n = 0). Pragurile termice inițiale și la sfârșitul studiului au fost obținute la 90 de indivizi (53 de bărbați și 37 de femei; vârsta medie de 50,9 ± 10,6 ani) dintre care 44 au fost tratați activ și 46 au fost tratați cu placebo. Participanții și-au dat consimțământul scris în cunoștință de cauză. Măsurătorile biochimice și antropometrice au fost descrise anterior [8].
Testarea funcției neurologice și microvasculare periferice
Toate testele au fost efectuate într-o cameră cu temperatură controlată (22-24 ° C) așa cum s-a descris anterior [8]. Participanții s-au abținut de la băuturi care conțin cofeină, fumat și exerciții ≥ 2 ore înainte de testare. Măsurătorile au fost făcute la momentul inițial și la sfârșitul studiului.
Testarea percepției temperaturii
Pragurile de percepție a temperaturii la cald (HPT) și la rece (CPT) au fost măsurate pe pulpa degetului mare stâng folosind un anesteziometru termic (HVLab Diagnostics Instruments, Southampton, Marea Britanie) [23] (vezi Metode ESM pentru detalii). A fost construit un „indice” de percepție a temperaturii prag (TPI) pentru fiecare individ, calculat ca diferență aritmetică între HPT și CPT (° C) măsurată la momentul inițial [24].
Testarea percepției vibrotactile
VPT-urile la 125 Hz au fost măsurate pe pulpa degetului mare stâng așa cum s-a descris anterior [8] (a se vedea metodele ESM pentru detalii).
Funcția microvasculară
Fluxul sanguin microvascular cutanat a fost evaluat pe suprafața ventrală a antebrațului nedominant folosind fluximetria Doppler cu laser (MoorVMS LDF2, Moor Instruments, Axminster, UK) în repaus (RF) și în timpul răspunsului dilatatorului la ischemie tranzitorie (180 mmHg timp de 3 minute); flux maxim [MF]) [8] (vezi Metode ESM pentru detalii).
analize statistice
Analizele statistice au fost efectuate folosind IBM SPSS Statistics 21.0 (IBM UK). Coeficienții de corelație a rangului Pearson și Spearman au fost folosiți pentru a investiga asocierile dintre variabilele distribuite în mod normal și respectiv în mod normal. În toate cazurile o valoare de p
Rezultate
Caracteristicile grupului
Tabelul 1 prezintă caracteristicile inițiale ale participanților fără neuropatie evidentă sau boală microvasculară. Dintre participanți, 35 au fost tratați cu statine, 32 cu medicamente antihipertensive, șapte cu fibrate, 18 cu inhibitori ai ECA (ACEI), 24 cu metformină și 13 cu antidepresive.
Efectul n-3 intervenție cu acizi grași polinesaturați asupra pragurilor de percepție a temperaturii
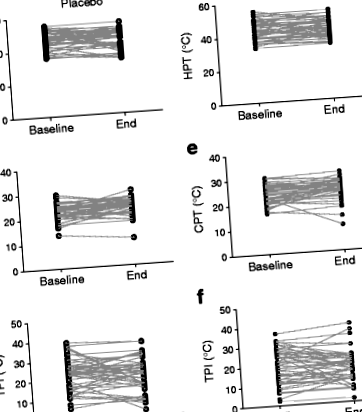
Măsurătorile individuale de bază și sfârșitul studiului pentru HPT, CPT și TPI pentru participanți sunt prezentate în Fig. 1. Tabelul 2 prezintă rezultatele modelării regresiei multivariabile care testează efectele intervenției DHA + EPA asupra modificării HPT, CPT și TPI (adică schimbarea între sfârșitul și începutul studiului) și nu prezintă niciun efect al tratamentului asupra fiecare dintre rezultatele interesului. Schimbarea HOMA-IR pentru starea de diabet a avut un efect redus asupra modelelor.
Efectul tratamentului de 15-18 luni cu DHA + EPA asupra HPT, CPT și TPI (diferența dintre HPT și CPT) măsurat la degetul mare. (A-c) grupul placebo; (d-f) grupul de tratament
Asocieri între HPT și CPT și factorii de risc cardiovascular și metabolic la momentul inițial
Comploturi împrăștiate care arată relația dintre (A) HPT și CPT de bază și (b) TPI (diferența dintre HPT și CPT) măsurat la degetul mare și procentul total de grăsime corporală măsurat utilizând DXA
Nu a existat nicio asociere semnificativă între HPT și CPT și măsurile stării glicemice (concentrația de glucoză în post sau HbA1c, participanți cu sau fără diabet) sau rezistența la insulină (HOMA-IR, participanți fără diabet). La persoanele cu diabet zaharat (n = 30), HPT a fost asociat cu durata diabetului (r = 0,471, p = 0,009), dar CPT nu a fostr = −0.267, p = 0,154).
HPT a fost asociat cu CPT (r = −0.670, p Tabelul 3 Modele de regresie multivariabile cu HPT, CPT și TPI ca rezultate, și covariabile cheie și potențiali confundatori ca variabile explicative
Discuţie
Noile noastre rezultate nu arată niciun beneficiu din tratamentul DHA + EPA la pragurile de percepție a temperaturii la cald sau la rece, la pacienții cu NAFLD, atât cu cât și fără diabet. Am examinat efectele celei mai mari doze autorizate de n-3 acizi grași (4 g/zi ca Omacor/Lovaza) pe măsurători ale funcției fibrelor nervoase senzoriale mici într-un studiu randomizat dublu-orb controlat cu placebo, cu o durată de minimum 15 luni și maxim 18 luni la participanții cu risc de a dezvolta diabet neuropatie și durere neuropatică. Din câte știm, studiul nostru este primul studiu randomizat dublu-orb controlat cu placebo care examinează efectele DHA + EPA asupra percepției temperaturii. De asemenea, arătăm pentru prima dată că pragurile de percepție termică la cald și la rece au fost puternic și independent asociate cu procentul total de grăsime corporală (dar nu cu grăsime hepatică sau cu control glicemic) la bărbați și femei.
Nu am găsit nicio asociere între pragurile de percepție a temperaturii la cald sau la rece și măsurile de sensibilitate la insulină sau HbA1c la acești pacienți care prezentau risc de neuropatie. Descoperirile noastre sunt în concordanță cu rezultatele unui studiu efectuat pe 156 de persoane cu neuropatie periferică în care nu a existat nicio asociere între neuropatie și control glicemic [26]. Pragurile ridicate la cald s-au dovedit a fi cel mai frecvent deficit senzorial la persoanele cu diabet, iar pragurile la cald s-au dovedit a fi corelate cu controlul glicemic în unele studii [9, 27], dar nu în toate [28, 29]. La persoanele cu diabet zaharat, HPT a fost asociată cu durata diabetului, posibil datorită stresului oxidativ crescut, deteriorării nervilor sau reducerii densității fibrelor nervoase care sunt evenimente timpurii la persoanele cu diabet [30].
Studiul actual extinde datele anterioare sugerând că funcțiile fibrelor senzoriale mici și mari sunt afectate la indivizii asimptomatici din punct de vedere neurologic, atât cu cât și fără diabet. Pragurile de percepție a temperaturii la stimulii reci și calzi asociați cu activarea fibrelor A-delta și a nervului C aferente senzoriale mici pe care le-am măsurat la degetul mare au fost puternic corelate cu fibra nervoasă senzorială mare VPT măsurată la 125Hz [8]. Disfuncția nervului cu fibre mari măsurată prin VPT prezice ulcerarea piciorului, amputarea membrelor inferioare și mortalitatea [26]. Cu toate acestea, în ce măsură evaluarea funcției fibrelor mici folosind QST poate reprezenta un instrument de screening suplimentar pentru a monitoriza progresia bolii și impactul terapeutic rămâne incert [34].
Limitări
QST-urile sunt teste psihofizice și utilizarea lor ca instrument de diagnostic singur sau în combinație cu alte teste mai directe este mult dezbătută [34]. Nu putem trece cu vederea faptul că există o serie de factori care pot afecta pragurile de percepție a temperaturii pe care nu am putut să le măsurăm, inclusiv vigilența și atenția, integrarea informațiilor senzoriale din zona stimulată a pielii și grosimea pielii [25]. Rezultatele noastre nu au furnizat nicio indicație a unei îmbunătățiri cu intervenția (Tabelul 2). Un calcul retrospectiv al puterii bazat pe o dimensiune a eșantionului de n = 90 cu n = 44 din brațul de tratament al studiului arată că am avut 84% putere pentru a detecta o diferență de temperatură de 3,5 ° C în HPT între momentul inițial și sfârșitul studiului cu tratament DHA + EPA. Faptul că am observat doar o diferență medie de temperatură de 1 ° C în HPT între linia de bază și sfârșitul studiului în brațul de tratament, sugerează cu tărie că nu a existat niciun efect al intervenției asupra acestei variabile, dar am fi avut nevoie de o dimensiune a eșantionului de zece ori mai mare pentru a demonstra nu a existat niciun efect al tratamentului. În plus, cu CV foarte scăzut (
6%) din tehnicile de măsurare a pragului de percepție a temperaturii, acest lucru ne oferă încredere suplimentară în validitatea constatărilor. Este interesant de observat că nu a existat o agravare a pragurilor de percepție a temperaturii în brațul placebo al studiului. Această constatare este în concordanță atât cu rezultatele studiului nostru anterior care investighează efectul intervenției DHA + EPA asupra VPT-urilor ca măsură a funcției mari a fibrelor nervoase senzoriale [8], cât și cu rezultatele altora [35]; și este plauzibil ca durata studiului nostru (minim 15 luni și maxim 18 luni) să fie insuficientă pentru a demonstra o deteriorare a pragurilor de percepție a temperaturii. În cele din urmă, nu putem fi siguri de efectul duratei diabetului asupra percepției temperaturii în cohorta noastră, deoarece identificarea datei de apariție a diabetului de tip 2 este adesea imprecisă în practica clinică.
Concluzii
Pe scurt, tratamentul cu cea mai mare doză licențiată de DHA + EPA (ca Omacor/Lovaza) nu a modificat percepția temperaturii mediată de fibrele nervoase mici la pacienții cu NAFLD atât cu cât și fără diabet. În acest grup de pacienți cu risc ridicat, fără dovezi de neuropatie periferică evidentă, procentul de grăsime corporală a fost asociat independent cu HPT și CPT. Atât HPT cât și CPT au fost mai puternic asociate cu măsurarea grăsimii corporale globale decât cu orice factori de risc metabolici.
- Procentul mai mare de grăsime corporală este asociat cu o percepție îmbunătățită a temperaturii în rezultatele NAFLD din
- Cum să pierzi procentul de grăsime corporală pentru femei - pierderea grăsimii cu nutriție
- Beneficiile pentru sănătate ale restricțiilor calorice legate de temperatura corporală redusă
- Conectarea restricției de calorii, a temperaturii corpului și a sănătății
- Conectarea restricției de calorii, temperatura corpului și sănătatea - ScienceDaily