Kshitiz Dwivedi
1 CSIR-Institutul Național de Cercetare a Ingineriei Mediului (NEERI), Nehru Marg, Nagpur, 440020 India
2 Rashtrasant Tukadoji Maharaj Nagpur University (RTMNU), Nagpur, India
Ashwinkumar P. Rudrashetti
1 CSIR-Institutul Național de Cercetare a Ingineriei Mediului (NEERI), Nehru Marg, Nagpur, 440020 India
2 Rashtrasant Tukadoji Maharaj Nagpur University (RTMNU), Nagpur, India
Tapan Chakrabarti
1 CSIR-Institutul Național de Cercetare a Ingineriei Mediului (NEERI), Nehru Marg, Nagpur, 440020 India
R. A. Pandey
1 CSIR-Institutul Național de Cercetare a Ingineriei Mediului (NEERI), Nehru Marg, Nagpur, 440020 India
Date asociate
Abstract
Carbamazepina (CBZ) este un medicament antiepileptic și anticonvulsivant utilizat pe scară largă pentru tratamentul epilepsiei și a altor tulburări bipolare. Ozonul ca proces avansat de oxidare a fost utilizat pe scară largă pentru degradarea CBZ, rezultând formarea de produse de transformare (ozonide). Prezenta cercetare își propune să izoleze și să identifice potențialul microorganism, capabil să degradeze CBZ și produsele sale de transformare. Viabilitatea celulară și citotoxicitatea CBZ pură și a produselor lor de transformare a ozonului au fost evaluate utilizând celulele Pseudomonas sp. tulpina KSH-1 prin teste de testare a viabilității celulare. Activitatea metabolică a celulelor a fost evaluată la concentrații variabile de CBZ (
10-25 ppm, CBZ pur) și cumulativ pentru produsele de transformare a ozonului. Pentru CBZ pur, viabilitatea celulară% scade odată cu creșterea concentrației CBZ, în timp ce, în cazul produselor de transformare CBZ post-ozonate, viabilitatea scade inițial și apoi crește la expunerea la ozon cu o viabilitate celulară maximă de 97 ± 2,8% evaluată timp de 2 ore probe post-ozonate.
Material suplimentar electronic
Versiunea online a acestui articol (10.1007/s12088-018-0715-3) conține materiale suplimentare, care sunt disponibile utilizatorilor autorizați.
Introducere
În ultimii ani, o mulțime de atenție a fost capturată de ingredientele farmaceutice active (API) și produsele farmaceutice și de îngrijire personală (PPCP) datorită apariției lor la nivel mondial, naturii recalcitrante și toxicității ecologice [1, 2]. Carbamazepina (CBZ) (Fig. S1 suplimentară) este API-urile cele mai frecvent utilizate pentru tratamentul epilepsiei și a altor tulburări bipolare [3]. CBZ, fiind recalcitrant, sunt extrem de rezistente la procesele convenționale de tratare a apei și a apelor uzate și raportate ca un marker antropogen pentru a indica poluarea ecosistemelor acvatice [4, 5]. Datorită naturii sale persistente și a perioadelor de înjumătățire mai lungi în mediu, CBZ își găsește prezența în mai multe corpuri de apă atât în țările în curs de dezvoltare, cât și în cele dezvoltate [6]. Acest lucru a determinat societatea să ia măsuri preventive pentru degradarea acestui compus doar la sursa sa punctuală. Mai mult, CBZ este dificil de biodegradat datorită complexității sale structurale. Cu toate acestea, puțini cercetători au raportat biodegradarea CBZ utilizând Pseudomonas sp. tulpina CBZ-4 izolată din nămolul activat la temperaturi foarte scăzute [7].
În ultimele decenii, o mulțime de cercetări s-au concentrat pe producția de materiale cu valoare adăugată și producția de energie pentru a face față crizei energetice globale din generațiile următoare. În acest context, apele uzate au fost, de asemenea, utilizate ca sursă alternativă de producere a energiei [8]. Procesele avansate de oxidare (AOP) au fost utilizate pe scară largă ca potențiale procese de tratament pentru îndepărtarea produselor farmaceutice din matricele reale și sintetice ale apelor uzate [9, 10]. Ozonul a fost încorporat ca potențial AOP pentru îndepărtarea produselor farmaceutice, deoarece oferă o degradare mai curată în comparație cu alte procese convenționale de tratament [11, 12]. Cu toate acestea, descompunerea parțială a CBZ a fost raportată prin atacul direct/indirect al ozonului care duce la formarea de produse de transformare (TP), care uneori prezintă o toxicitate mai mare decât compusul original [13, 14]. Prin urmare, este necesar să se evalueze toxicitatea TP-urilor formate după tratament și să se compare toxicitatea acestuia cu compusul părinte, înainte de eliberarea lor în corpurile de apă acvatice [15].
Prin urmare, pentru a evalua toxicitatea, microorganismele potențiale capabile să degradeze CBZ și TP-urile sale au fost izolate din probele de nămol activate. În acest aspect, scopul lucrării a fost împărțit în (a) îmbogățirea și aclimatizarea culturii microbiene mixte pentru screeningul microorganismelor potențiale capabile să degradeze CBZ într-un reactor de creștere suspendat (SGR) [16]; (b) izolarea și identificarea potențialei tulpini microbiene capabile de degradare CBZ [7] și (c) evaluarea citotoxicității CBZ pure și efectul cumulativ al TP-urilor asupra tulpinii bacteriene identificate utilizând teste de viabilitate celulară (test MTT). Activitatea metabolică a celulelor a fost evaluată prin conversia MTT (galben) în cristale formazon reduse (violet) de către o enzimă reductază mitocondrială dependentă de NAD (H).
Din câte știm, evaluarea citotoxicității CBZ și a TP-urilor lor de ozon pe Pseudomonas sp. nu a fost raportat până în prezent. Prin urmare, în prezentul studiu, ozonul a fost încorporat ca potențial AOP pentru tratamentul CBZ urmat de teste de viabilitate celulară (test MTT) pe Pseudomonas sp. tulpina KSH-1 izolată din cultură microbiană mixtă obținută din nămolul activat de instalația de tratare a efluenților comuni (CETP). Viabilitatea% a celulei a fost evaluată atât pentru CBZ pură (la doze variate), cât și pentru probele tratate cu ozon (creșterea timpului de expunere). Mai mult, calea degradării CBZ la ozonare a fost postulată și produșii majori de oxidare/transformare a CBZ au fost identificați prin analiza LC-ESI-MS și LC-MS/MS. Rezultatele referitoare la acestea au fost prezentate și discutate în această lucrare.
Materiale și metode
Produse chimice, reactivi și medii nutritive
CBZ (99% pur) și dimetil sulfoxid (DMSO) au fost procurate de la Sigma-Aldrich (SUA). Metanolul (HPLC), izopropanolul (99% v/v), acidul formic, au fost de calitate analitică cumpărate de la Fisher Scientific (India). MTT [3- (4,5-dimetiltiazol-2-il) -2,5-difeniltetrazolium bromură] a fost obținut de la Invitrogen, Thermo Fisher Scientific (India). Toate celelalte substanțe chimice și anume. K2HPO4, KH2PO4, (NH4) 2SO4, MgSO4 · 7H2O, NaCl, NaOH, Na2HPO4, CH3COONa, NH4Cl, CaCl2 · 2H2O, FeSO4 · 7H2O, MnSO4 · H2O, ZnSO4 · H2O, CuCOH2C au avut un grad de reactiv. Agarul nutritiv și bulionul nutritiv au fost achiziționate de la Himedia (India).
CBZ Apă uzată sintetică (SWW)
Soluția stoc CBZ de 100 mg/L a fost preparată prin dizolvarea CBZ pură în apă Milli Q. O soluție de lucru cu concentrații cunoscute (10, 15, 20 și 25 mg/L) a fost pregătită pentru studii de citotoxicitate utilizând soluția stoc CBZ. Experimentele de ozonare au fost efectuate folosind apă sintetică cu rezistență de cca. 25 mg/L de CBZ.
AOP Reactor System for Ozone Experiments
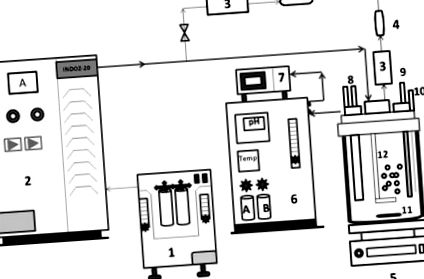
Sistem de reactor AOP format din sistem generator de ozon și vas de reactor din sticlă borosilicat pentru amestecarea omogenă a ozonului. Ozonul a fost produs prin metoda de descărcare a coroanei (răcită cu aer) folosind un generator de ozon (modelul INDOZ-20), Ozone Research & Applications India Pvt. Ltd. (ORAIPL), Nagpur. Dozarea ozonului a fost determinată prin măsurarea debitului de gaz la intrarea și ieșirea reactorului utilizând un analizor de ozon BMT (marca Germania). Ozonul nereacționat a fost monitorizat continuu la ieșire pentru a se asigura că reacția urmează viteza de reacție de primul ordin. Toate experimentele de ozonizare au fost efectuate la temperatura camerei prin pulverizarea directă a ozonului în apele reziduale sintetice CBZ (modul semi-lot) și cu agitare continuă pentru o distribuție omogenă și eficientă a ozonului [11]. Schemele sistemului reactorului AOP au fost reprezentate în Fig. 1 .
Diagrama schematică care prezintă configurarea experimentală pentru experimentele de ozonare (1) Concentrator de oxigen, (2) sistem de generare a ozonului (ORAIPL), (3) analizor de ozon BMT, Germania, (4) distructor de ozon, (5) Agitator magnetic, (6) )) Sistem de panou de comandă pentru reactor, (7) Sistem de achiziție de date, (8) Intrare și ieșire apă de răcire, (9) electrod pH, (10) Port de eșantionare, (11) Bara de agitare magnetică, (12) Sparger, ( 13)) Placă de cap, (14) Ambiant
Media de îmbogățire și cultura microorganismelor
Nămolul activ care cuprinde o cultură microbiană mixtă a fost colectat din unitatea rezervorului de aerare a unei industrii farmaceutice operaționale situată în regiunea de sud a Indiei. Microflora mixtă a fost îmbogățită într-un reactor de creștere suspendat (SGR) (balon de 2 L), prin utilizarea apelor uzate artificiale preparate conform protocolului menționat de Vasiliadou și colab. [16] cu mici modificări. Mărimea inoculului lichiorului de nămol a fost de 10% din volumul total de SGR. Toți nutrienții macro au fost adăugați în același raport, cu toate acestea, în cazul oligoelementelor, H3BO3, Na2MoO4 · 2H2O și KI nu au fost adăugați la SGR din cauza precipitării mediului și a reacției laterale. Mai mult, în locul adăugării extractului de drojdie, CH3COONa a fost adăugat pe mediu pe toată perioada de pornire, pentru a permite bacteriilor să se adapteze la cerințele nutriționale în schimbare. 50% din volumul SGR a fost înlocuit cu ape uzate artificiale proaspete care conțin CH3COONa (1,8 g/L, 527 mgC/L) ca sursă C.
Biodegradarea CBZ în SGR
După perioada de aclimatizare, CBZ a scăzut de la 5 la 0,5 mg/L (
Degradare de 90%, în termen de 7 zile), în același SGR utilizat pentru aclimatizarea microorganismelor degradante CBZ. Biodegradarea CBZ a fost confirmată în continuare prin efectuarea de experimente suplimentare folosind SGR proaspăt, dar folosind inocul de microorganisme aclimatizate și
80-90% din biodegradarea CBZ a fost observată comparativ cu concentrațiile inițiale de CBZ.
Izolarea și identificarea culturilor bacteriene potențiale
Culturile bacteriene dominante prezente în SGR au fost izolate folosind tehnica de diluție în serie pe plăci medii specifice. Mediile specifice utilizate pentru creșterea coloniilor potențiale cuprind medii minime (1 ×) (Compoziție: NH4Cl = 0,23 g/L, KH2PO4 = 4,5 g/L, Na2HPO4 = 4,5 g/L, MgSO4 · 7H2O = 0,2 g/L, CaCl2 · 2H2O = 0,02 g/L) cu CBZ (5 mg/L) ca singură sursă de C și 2% Agar a fost adăugat pentru solidificare. Mediile au fost autoclavizate timp de 15 minute la 121 ° C și au fost utilizate pentru prepararea plăcilor de mediu specifice.
Plăcile de medii specifice care conțin colonii dominante au fost selectate și striate pe plăci de medii specifice proaspete prin tehnica plăcilor de striat (patru moduri de striat) pentru a obține culturi pure. Culturile pure au fost caracterizate folosind teste morfologice și biochimice. În paralel, s-au efectuat experimentele de creștere a balonului din colonii morfologic diferite și s-a măsurat OD600. Cea mai dominantă și eficientă tulpină bacteriană care degradează CBZ (KSH-1) a fost selectată pentru izolarea și identificarea ADN-ului. Cultura bacteriană pură crescută peste noapte a fost utilizată pentru izolarea ADN-ului. Biomasa a fost centrifugată și lizată utilizând soluție tampon de liză (400 µL Tris - EDTA, 50 µL de 10% dodecil sulfat de sodiu (SDS), 50 µL (20 mg/mL) proteinază-K) și păstrată pentru incubare la 37 ° C timp de 2 ore. După perioada de incubație, un volum egal de amestec PCI (fenol: cloroform: alcool izoamilic, 25: 24: 1) a fost adăugat și amestecat corespunzător. Lizatul a fost centrifugat și ADN-ul a fost precipitat folosind 90% etanol. ADN-ul precipitat a fost dizolvat în tampon Tris - EDTA (TE). Puritatea și cuantificarea ADN-ului izolat au fost determinate de NanoDrop (ND-8000), Isogen Life Sciences.
Reacția în lanț a polimerazei (PCR) și secvențierea genei ARNr 16S
ADN-ul genomic a fost izolat din cultură și gena ARNr de 16 s a fost amplificată folosind primerii universali 27F (5'-AGAGTTTGATCMTGGCTCAG-3 ') și U1492R (5'-TACGGYTACCTTGTTACGACTT-3'). Amestecul PCR/100 uL volum conținea tampon Taq, polimerază Taq, trifosfați nucleozidici de deziriboză (dNTP), 0,2 uM din fiecare primer și ADN extras (50-100 ng). Amplificarea a fost efectuată utilizând un ciclotermic (GeneAmp 2700, Applied Biosystems, SUA) cu programul PCR: denaturare inițială (95 ° C, 10 min); 40 cicluri de temperatură de recoacere (94 ° C, 1 min, 52 ° C, 1 min, 72 ° C, 1 min); și prelungirea finală (72 ° C, 20 min). Produsul PCR rezultat de aproximativ 1500 bp a fost vizualizat prin electroforeză pe gel de agaroză (Fig. S2 suplimentar) și purificat prin extracție pe gel folosind trusa de eluare cu gel (Sigma Life Sciences). Mai mult, produsele PCR purificate au fost secvențiate utilizând metoda de secvențiere a ADN-ului Sangers Dideoxy. Fișierul FASTA secvențiat a fost trimis către NCBI și microorganismele au fost identificate folosind căutarea instrumentului de nucleotide BLAST împotriva bazei de date NCBI standard.
Metode de analiză
Parametri generali
PH-ul probelor pre-și post-ozonate a fost măsurat imediat folosind un pH-metru (Cyberscan Eutech 510, fabricat în SUA). Scanarea UV a fost efectuată folosind spectrofotometrul UV-1800 (Shimadzu; lățimea de bandă spectrală 1 nm) în timp ce conținutul de carbon organic total (TOC) al probelor a fost măsurat folosind instrumentul Shimadzu TOC-L echipat cu un autosampler ASI-V. Concentrația CBZ în probe pre-și post-ozonate a fost determinată folosind Waters HPLC (SUA) echipat cu detector Waters 2998 Photodiode array. Coloana C-18 de siliciu de înaltă rezistență (HSS), (4,6 mm × 250 mm, 5 µm, Waters, SUA) a fost utilizată pentru separarea CBZ. Probele au fost efectuate în mod izocratic cu un debit de 1,5 ml/min. Faza mobilă a fost preparată prin amestecarea apei deionizate Milli-Q și metanol (v: v = 30:70) și 0,1% acid formic. Volumul de injecție pentru fiecare probă a fost de 20 uL și temperatura cuptorului pe coloană a fost menținută la 25 ° C. Toate probele au fost filtrate utilizând filtre de seringă 0,22 sym înainte de analiză.
Analiza LC - MS/MS
Produsele majore de transformare ale CBZ au fost identificate utilizând sistemul UPLC-ESI - MS (Waters, SUA) echipat cu coloană Thermo accucore C-18 LC (100 mm × 3,0 mm, 2,6 µm) și spectrometru de masă Waters UPLC-TQD (ESI– MS, APCI-MS, LC - MS/MS) cu un interval de masă de 100-2000 Da. Cu toate acestea, cuantificarea produselor/intermediarilor de transformare nu a fost posibilă din cauza indisponibilității standardelor comerciale pentru produsele de transformare sau intermediari.
Faza mobilă utilizată pentru separarea TP-urilor a constat din (A) acetonitril și (B) 5 mM NH4Ac. Modul gradient de eluare a fost aplicat după cum urmează: 0-3 min, 20% A: 80% B; 3–6 min, 40% A: 60% B; 6-8 min, 70% A: 30% B; 8-10 min, 80% A: 20% B; 10-12 min, 20% A: 80% B. Debitul a fost menținut constant la 0,35 ml/min cu o rată a debitului de 0,45 min. ESI a fost operat cu următorii parametri: tensiune de pulverizare 3,5 kV, temperatură sursă 120 ° C, temperatură de desolvatare 350 ° C, mod MS scan - SIR (înregistrare ion selectată)/MRM (monitorizare reacție multiplă) Pentru achiziționarea spectrelor de masă, cromatogramele au fost obținute în modul curent total de ioni (TIC) cu un domeniu de scanare de m/z 50-350.
Analiza creșterii bacteriene și a viabilității celulare
Pentru studiul curbei de creștere bacteriană, cultura bacteriană a fost lăsată să crească peste noapte într-o soluție de mediu minim într-un incubator de agitare setat la 37 ° C, 120 rpm. Celulele bacteriene crescute peste noapte (din faza exponențială) au fost utilizate ca inocul pentru efectuarea experimentelor cu baloane. Au fost efectuate două seturi diferite de experimente în balon, unul la concentrații variabile de CBZ adăugate la mediul minim pentru a atinge concentrațiile CBZ (10 ppm, 15 ppm, 20 ppm, 25 ppm) și un alt set conținând mediu minim, dar, suplimentat cu volume egale de probe tratate cu ozon (inițiale și post-ozonate timp de 10 min, 30 min, 60 min și 120 min). Toate baloanele au fost autoclavizate (121 ° C, 15 min), inoculate (100 uL, crescute peste noapte) și incubate la 37 ° C cu agitare continuă (120 rpm). Creșterea (OD600) a culturii bacteriene a fost măsurată la intervale de 4 ore folosind spectrofotometru vizibil la UV.
Viabilitatea celulelor bacteriene a fost determinată folosind testul MTT (Fig. S3 suplimentară) [17]. Culturile bacteriene (950 uL fiecare) au fost colectate în tuburi de centrifugă (capacitate 1,5 mL) la intervale de 4 ore din fiecare balon experimental. MTT (1,28 mg/ml, câte 30 pl fiecare) și glucoză (0,5%, câte 20 pl fiecare) au fost adăugate în tuburi și incubate la 37 ° C, 1 oră în condiții de întuneric. Celulele au fost apoi recoltate, centrifugate (la 10.000 rpm, 5 min) și supernatantul (cuprinzând mediu de creștere și soluție MTT) a fost decantat. Peleta care conține cristale de formazan a fost în cele din urmă suspendată în soluție de dimetil sulfoxid (DMSO) (250 µL) pentru a dizolva cristalele și a fost măsurată absorbanța (A550 nm) corespunzătoare fiecărei godeuri utilizând cititorul de plăci de microtitrare Tecan infinite 200 PRO [18]. Toate testele experimentale au fost efectuate în triplicate (n = 3), iar rezultatele au fost prezentate în termeni de% viabilitate celulară (medie ± SD). Viabilitatea celulei a fost determinată utilizând următoarea ecuație:
Control pozitiv PC (mediu minim cu sursă C + 1% inocul); Controlul vehiculului VC (mediu minim + inocul, sursă C absentă), probe de testare (mediu minim cu CBZ variabil ca sursă C + 1% inocul fiecare).
Rezultate
Produse de transformare a CBZ după tratamentul cu ozon
Calea propusă de degradare a CBZ după tratamentul cu ozon
- Prinderea mercurului ionic folosind diferiți adsorbanți - Ojedokun - 2019 - CURĂ; # 8211; Sol, aer,
- Tratarea toxicității marijuanei
- Motivele pentru creșterea în greutate pentru divorț HuffPost Cititorii de divorț dau viața HuffPost
- Adevărat sau fals Utilizarea unui uscător în sinusurile dvs. va ucide difuzarea publică a Coronavirus Georgia
- Terapia genetică vizată pentru glomerulonefrita de șobolan folosind HVJ - imunolipozomi - Tomita - 2002 -