Zemfira N. Karamysheva
1 Departamentul de Științe Biologice, Universitatea Texas Tech, Lubbock, TX 79409, SUA
Sneider Alexander Gutierrez Guarnizo
2 Departamentul de biologie celulară și biochimie, Texas Tech University Health Sciences Center, Lubbock, TX 79430, SUA; ude.cshutt@zinraugs
3 Program de studiu și control al suprafețelor tropicale, Universitatea din Antioquia, Medellín 050010, Columbia
Andrey L. Karamyshev
2 Departamentul de biologie celulară și biochimie, Texas Tech University Health Sciences Center, Lubbock, TX 79430, SUA; ude.cshutt@zinraugs
Abstract
Leishmanioza reprezintă o problemă gravă de sănătate la nivel mondial, iar rezistența la medicamente este o preocupare din ce în ce mai mare. Paraziții Leishmania folosesc mecanisme neobișnuite pentru a-și controla expresia genelor. Spre deosebire de multe alte specii, acestea nu au reglare transcripțională. Lipsa controlului transcripțional este compensată în principal prin mecanisme post-transcripționale, incluzând controlul translațional strâns și reglarea stabilității/translabilității ARNm de către proteinele care leagă ARN. Modularea traducerii joacă un rol major în supraviețuirea și adaptarea paraziților la medii diferite în timpul schimbării gazdei; totuși, cunoștințele noastre despre mecanismele moleculare fine ale traducerii în Leishmania rămân limitate. Aici, analizăm progresul actual în ceea ce privește înțelegerea modului în care schimbările din mecanismele de translație promovează diferențierea paraziților în timpul transmiterii de la o muscă de nisip la o mamă gazdă și discutăm despre modul în care reprogramarea translațională poate contribui la dezvoltarea rezistenței la medicamente.
1. Introducere
Speciile de Leishmania sunt protozoari unicelulari care provoacă leishmaniases care afectează aproximativ 12 milioane de oameni din întreaga lume [1]. În prezent sunt recunoscute 53 de specii de Leishmania, dintre care 20 sunt patogene pentru oameni [2]. Leishmanioza viscerală, cunoscută și sub numele de kala azar, este cea mai severă formă a bolii, cu o rată a mortalității de aproape 100% dacă nu este tratată [3,4]. De obicei este cauzată de L. donovani și L. infantum. Pacienții prezintă mărirea splinei și ficatului, febră și scădere în greutate. Un alt tip, leishmanioza mucocutanată, produce leziuni care pot duce la distrugerea severă a membranelor mucoase ale cavităților nasului, gurii și gâtului. Este cauzată în principal de L. braziliensis și L. panamensis. Formele cutanate de leishmanioză sunt cele mai frecvente și se caracterizează prin prezența ulcerelor cutanate; acestea reprezintă aproximativ 90% din toate cazurile noi [5]. Până la 20 de specii pot provoca leishmanioză cutanată [2]. Din păcate, opțiunile de tratament pentru leishmanioză sunt foarte limitate, iar rezistența la medicamente este o mare problemă [6,7].
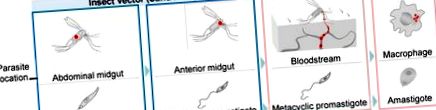
În timpul ciclului lor de viață, acești protozoari purtători de vectori alternează între promastigote flagelate, care trăiesc în formă extracelulară în intestinul mediu al muștelor de nisip, și amastigote, care locuiesc în compartimentul fagolizozomal al macrofagelor de mamifere (Figura 1). Controlul leishmaniozei este împiedicat de lipsa unui vaccin sigur, alegerea limitată a medicamentelor, toxicitatea ridicată a acestora și apariția tulpinilor rezistente la medicamente [8,9].
Etape majore în diferențierea parazitului Leishmania. În timpul ciclului de viață Leishmania, paraziții tranzitează de la vectori de muscă de nisip flebotomină la gazde vertebrate de mamifere. La gazda nevertebrate, Leishmania spp. adoptă două etape diferite. Promastigotele prociclice proliferează în intestinul mediu abdominal al insectelor, devenind progresiv promastigotele metaciclice care migrează spre intestinul mediu anterior. Apoi, paraziții se transmit gazdelor mamifere în timpul unei mese de sânge. Odată ajunși în gazda vertebratelor, paraziții intră în fagocite și se transformă în amastigote intracelulare. Amastigotii pot supraviețui și prolifera în interiorul fagolizozomului, distrugând în cele din urmă gazda celulară, infectând celule noi de mamifere și repornind o rundă de infecție în timpul unei noi mușcături de insecte. Punctele roșii indică localizarea paraziților.
Paraziții Leishmania posedă trăsături moleculare unice, cum ar fi transcrierea policistronică și, ca urmare, lipsa controlului transcripțional [10,11]. Transcrierile policistronice lungi care codifică proteinele fără legătură funcțională sunt produse de ARN polimeraza II. ARN-urile policistronice au fost prelucrate prin 5-trans-splicing al unei secvențe de lider spliced capped și 3 ′ poliadenilare pentru a genera mARN-uri mature [12]. Prin urmare, absența controlului transcripțional face din Leishmania un model bun pentru a studia reglarea post-transcripțională, inclusiv traducerea ARNm reprezentând mecanismul major al expresiei genice la speciile Leishmania.
Din moment ce Leishmania spp. lipsa controlului transcripțional, au evoluat pentru a avea o varietate de proteine care leagă ARN (RBP) pentru a controla expresia genelor post-transcripțional. RBP promovează diferențierea paraziților și susțin supraviețuirea lor la nevertebrate și vertebrate gazde, unde întâlnesc un mediu atât de diferit. Această reglare fină a reglării expresiei genelor în timpul ciclului de viață al parazitului se realizează prin modularea stabilității nivelului de ARNm și implicarea transcriptului în traducere.
În această revizuire, ne concentrăm pe rolul controlului translațional și al RBP-urilor în reglarea ciclului de viață al parazitului și capacitatea de a supraviețui și de a prospera în timpul transmiterii către o altă gazdă. Se pune un accent special pe rolul reprogramării translaționale în dezvoltarea rezistenței la medicamente. Descoperirea mecanismelor moleculare de control translațional utilizate de paraziții Leishmania pentru a înflori în diferite gazde, cum ar fi muștele de nisip și mamiferele, și descifrarea rolului reprogramării translaționale în rezistența la medicamente ajută la identificarea de noi ținte farmacologice și la dezvoltarea de noi tratamente în viitor.
2. Controlul translațional în timpul diferențierii Leishmania
Paraziții protozoarelor Leishmania au un ciclu de viață parazit complex, alternând între un vector de muscă de nisip și o gazdă de mamifer. Există ca promastigote foarte mobile care conțin flageli (la insecte) și ca amastigote cu flageli foarte scurți (la mamifere). Promastigotele flagelate trăiesc libere în intestinul mediu al insectei și suferă o transformare dramatică în gazda mamiferelor, unde devin amastigote care trăiesc în interiorul macrofagelor.
Reglarea traducerii în diferite etape ale ciclului de viață la paraziții Leishmania. Paraziții Leishmania suferă modificări dramatice în traducere în timpul schimbării gazdei. În timpul tranziției de la vectorul insectelor la gazda vertebrată, schimbările de temperatură, pH și nutriție promovează reprimarea tradițională generală prin fosforilarea eIF2α. În același timp, traducerea selectivă este reglată în amastigote, pentru a asigura supraviețuirea și adaptarea paraziților în macrofage. În zborul nisipului, paraziții experimentează o scădere substanțială a temperaturii și modificări ale pH-ului și nutriției. Promovează creșterea substanțială a traducerii și diferențierea amastigotei la promastigote extrem de proliferative. MΦ, macrofag; PP, promastigote prociclice; MP, promastigote metaciclice; AM, amastigote.
Inițierea traducerii poate juca un rol important în reprogramarea translațională atunci când paraziții intră într-o altă gazdă. Inițierea traducerii are loc prin legarea proteinei de legare a capacului eIF4E la structura capacului 5 ′, împreună cu partenerul său de legare eIF4G care servește ca proteină de schelă [20]. Apoi, o subunitate mare de ribozomi este recrutată atunci când complexul de inițiere ajunge la primul AUG [27]. Interesant este că genomurile tripanosomatide, inclusiv speciile Leishmania, au un număr mare de complexe care leagă capacul, inclusiv șase paralogi ai eIF4E și cinci paralogi pentru proteina eșafod eIF4G [30,31,32,33,34,35]. Prezența multor paralogi cu diferite activități de legare a capacelor și profiluri de expresie în timpul ciclului de viață al parazitului sugerează că fiecare paralog a evoluat pentru a îndeplini o funcție biologică diferită și o reglare foarte complexă a expresiei genelor, în timpul inițierii traducerii pentru a sprijini parazitul. supraviețuirea în medii în continuă schimbare. Cu toate acestea, rolul precis al acestor proteine în paraziții Leishmania rămâne neclar și necesită investigații suplimentare.
3. Proteinele de legare a ARN și rolul lor în reglarea traducerii și diferențierii paraziților
Reprezentarea schematică a interacțiunii proteinelor de legare a ARN (RBP) cu mARN în timpul traducerii în paraziții Leishmania. RBP-urile Leishmania sunt grupate în patru clase principale, proteinele Alba (acetilarea scade afinitatea de legare), proteinele Puf (factorul de legare Pumilio și Fem-3), proteinele CCCH degetului de zinc și proteinele motivului de recunoaștere a ARN (RRM). RMN-urile includ ARNm de legare de proteine în diferite părți ale regiunii 3 'netraduse (3'UTR) și poli (A). Proteina de legare poli (A) (PABP) este prezentată ca un exemplu de proteine RRM. RBP-urile modulează traducerea selectivă prin stabilitatea ARNm, degradarea ARNm, asocierea polisomilor sau procesul de stocare a ARNm.
Proteinele CCCH (Cys3His Zinc finger) sunt caracterizate prin prezența unui motiv definit cu degetul de zinc, cu preferința de a lega elemente bogate în AU în ARN [40]. Proteinele Tripanosom ZFP1 și ZFP2 aparțin familiei CCCH și ambele sunt importante pentru diferențierea de la fluxul sanguin la formele prociclice [40,53,54]. În timp ce ZC3H20 este necesar pentru formele prociclice, ZC3H11 este esențial în paraziții din sânge [55,56]. ZC3H11 este sugerat să acționeze ca o platformă în recrutarea PABP la 3'UTR și să regleze stabilitatea și traducerea ARNm [57]. ZC3H11 protejează un subgrup de ARNm de represiunea translațională în timpul șocului termic, iar multe dintre ARNm induse de căldură sunt, de asemenea, crescute în timpul diferențierii la formele infecțioase la mamifere [14]. Analiza bioinformatică a bazei de date a genomului TriTryp a identificat că Trypanosoma brucei are 48 de proteine CCCH, în timp ce Leishmania major poartă 54 de proteine, dintre care 8 sunt unice; cu toate acestea, rolul proteinelor CCCH în reglarea diferențierii paraziților Leishmania nu a fost încă abordat [58,59].
Se știe că proteinele Puf sunt implicate în reglarea localizării, stabilității și traducerii ARNm, prin legarea la motivul secvenței în 3'UTR al ARNm specific [60,61,62]. Proteinele Puf conțin un domeniu de legare a ARN format din mai multe repetiții imperfecte de aminoacizi numite repetiții Puf. Proteinele Puf promovează represiunea translațională și degradarea ARNm prin interacțiuni cu elemente cis în 3'UTR ale ARNm specifice [63,64,65,66]. Atât speciile Leishmania, cât și Trypanosoma conțin până la 10 proteine Puf diferite [67,68,69,70,71]. Proteina Puf6 reglează nivelurile de transcripție selectivă în timpul ciclului de viață al parazitului prin degradarea ARNm [72,73]. Proteinele Puf pot fi găsite împreună cu LeishIF4E-3 în granulele de stres induse de foamete în Leishmania [20]. Cu toate acestea, în general, se știe foarte puțin despre funcțiile biologice ale proteinelor Puf din Leishmania.
Alte proteine care interacționează cu 3'UTR sunt proteinele Alba [74]. Sunt proteine abundente care leagă ARNm care reglementează traducerea în tripanosomatide și pot fi găsite în asociere cu polizomi și traducători de ARNm [75]. Expresia proteinelor Alba este reglată în stadiu în Trypanosoma și contribuie la diferențierea paraziților în timpul dezvoltării lor în mușca tsetse [76]. În timp ce Trypanosoma are patru proteine cu domeniul Alba, genomul Leishmania infantum are doar două proteine Alba [39,77]. Proteina LiAlba3 poate lega delta-amastina 3'UTR și poate regla stabilitatea ARNm a amastinei în Leishmania infantum în timpul etapei amastigote [74]. Ambele proteine Alba au fost găsite asociate cu subunități ribozomale în Leishmania, spre deosebire de Trypanosoma, unde proteinele Alba sunt observate în polizomi; cu toate acestea, nu este clar modul în care contribuie la diferențele de funcție [78].
Astfel, paraziții Leishmania au o mare varietate de proteine de legare a ARN (RBP) care joacă un rol deosebit de important în reglarea traducerii proteinelor prin controlul stabilității/translabilității ARNm și asigurând reglarea fină a traducerii proteinelor în timpul diferențierii parazitului în absența transcripției. control. În timp ce etapele ciclului de viață ale Leishmaniei sunt bine studiate, suntem la începutul înțelegerii mecanismelor moleculare ale controlului translațional care funcționează în diferitele etape ale ciclului de viață al parazitului și a modului în care contribuie diferitele RBP la acesta.
4. Rezistența la medicamente și traducerea
Studiile de rezistență la medicamente din Leishmania s-au concentrat în principal pe Sb V, deoarece este principalul medicament utilizat în prezent pentru tratament. Studiile sugerează că Leishmania utilizează cel puțin patru mecanisme principale pentru a contracara medicamentul Sb V: (a) reducerea consumului de medicamente; (b) prevenirea activării drogurilor; (c) sechestrarea medicamentelor; și (d) creșterea efluxului de medicament (Figura 4 A).
O reducere a absorbției medicamentului poate fi realizată prin reglarea descendentă a proteinelor din membrană ca acvagliceroporină (AQP1) [91]. Activarea medicamentului ar putea fi blocată prin reglarea negativă a enzimelor specifice reductazei, protejând paraziții prin prevenirea reducerii de la Sb V (promedicament) la antimoniu trivalent (Sb III, formă activă de medicament). Acțiunea Sb V poate fi inactivată prin producerea de conjugați metal-tiol, ducând la sechestrarea medicamentului. În cele din urmă, supraexpresia transportorilor ABC mărește efluxul medicamentos de conjugate metal-tiol peste vezicule care se fuzionează cu membrana plasmatică în timpul exocitozei [92].
Este bine documentat că reprogramarea traducerii ARNm joacă un rol cheie în rezistența la medicamente în timpul tratamentului împotriva cancerului și țintirea elementelor specifice ale mecanismului de traducere apare ca o strategie inovatoare pentru terapia cancerului [101,102,103,104,105]. Deși rezistența la medicamente în Leishmania a fost studiată în ultimii 20 de ani, rolul reglementării translaționale a rămas în esență neglijat. Studiile discutate aici sugerează că sub presiunea medicamentului, Leishmania ar trebui să activeze reprogramarea coordonată a traducerii, modulând traducerea selectivă a ARNm și activând căile de combatere a medicamentului (Figura 4 B). Acest proces poate fi extrem de specializat în organismele tripanosomatide care nu au control transcripțional. În timp ce datele implică importanța controlului translațional, descoperirea modului în care paraziții își reprogramează traducerea pentru a rezista prezenței medicamentului și a dezvolta rezistență necesită studii viitoare.
5. Concluzii și perspective
Scopul acestei revizuiri este de a oferi progresul actual realizat în studiile privind controlul translațional la paraziții Leishmania. Controlul translațional este principalul mecanism care promovează transformarea promastigotelor (stadiul de acoperire a nisipului) în amastigote (stadiul mamiferelor) realizată prin scăderea traducerii globale prin fosforilarea eIF2α. Inițierea factorilor de traducere și o mare varietate de proteine care leagă ARN sunt toate importante pentru diferențiere, cu toate acestea, funcțiile biologice precise au fost caracterizate doar pentru câțiva dintre ei. Este necesară o investigație suplimentară a rolului diferiților regulatori de translație și RBP pentru o mai bună înțelegere a biologiei parazitului digenic.
Rezistența la medicamente este una dintre problemele majore în tratamentul leishmaniozei, iar eludarea problemei rezistenței la medicamente este esențială pentru succesul tratamentului în viitor. Pentru a combate eficient această boală, este esențială o mai bună înțelegere a mecanismelor fine de dezvoltare a rezistenței la medicamente. În timp ce modificările la niveluri genomice care contribuie la dezvoltarea rezistenței la medicamente sunt foarte bine studiate, rolul reprogramării translaționale rămâne în mare parte neexplorat. Înțelegerea mecanismului responsabil pentru reprogramarea translațională globală în timpul dezvoltării rezistenței la medicamente va fi foarte valoroasă în dezvoltarea de noi alternative terapeutice extrem de eficiente pentru tratamentul leishmaniozei.
Abrevieri
| eIF2α | subunitatea alfa a factorului de inițiere eucariotă 2 |
| RBP-uri | Proteine care leagă ARN-ul |
| Puf | Factorul de legare Pumilio și Fem-3 |
| Alba | acetilarea scade afinitatea de legare |
| RRM | Motiv de recunoaștere a ARN |
| PABP | Proteina care leagă poli (A) |
| CCCH | Cys3Degetul său de zinc |
| ZFP1 | proteină deget de zinc 1 |
| ZFP2 | proteina degetului de zinc 2 |
| UTR | regiune netradusă |
| CDPK1 | proteina kinaza 1 dependentă de calciu |
| TCA | ciclul acidului tricarboxilic |
Contribuțiile autorului
Z.N.K. și A.L.K. a scris manuscrisul; S.A.G.G. a participat la scrierea părții din manuscris despre rezistența la medicamente, a proiectat și a pregătit cifrele; toți autorii au discutat și editat manuscrisul. Toți autorii au citit și au acceptat versiunea publicată a manuscrisului.
Finanțarea
Această lucrare a fost susținută de fondurile Start-up de la Texas Tech University Health Sciences Center către A.L.K.
Conflicte de interes
Autorii nu declară niciun conflict de interese. Finanțatorii nu au avut niciun rol în proiectarea studiului; în colectarea, analiza sau interpretarea datelor; în scrierea manuscrisului sau în decizia de a publica rezultatele.
- Reglementarea și controlul calității suplimentelor alimentare; Explorează medicina integrativă
- Regulamentul de feedback negativ al semnalizării antivirale mediate de RIG-I de către ISG15 indus de interferon
- Regulament; Provocări de control al calității în industria suplimentelor alimentare; Știri despre medicul naturist
- Rețete de curățare a paraziților; Curățați ajutorul
- Parazit Cleanse; Detox - Ceaiul Swaye