Ronald McGregor
1 Administrația Veteranilor Sistemul de sănătate din Los Angeles, cercetare în neurobiologie (151A3), North Hills, California 91343 și
2 Departamentul de Psihiatrie și Științe Bio-Comportamentale și
3 Brain Research Institute, Universitatea din California la Los Angeles, Los Angeles, California 90095
Ming-Fung Wu
1 Administrația Veteranilor Sistemul de sănătate din Los Angeles, cercetare în neurobiologie (151A3), North Hills, California 91343 și
2 Departamentul de Psihiatrie și Științe Bio-Comportamentale și
3 Brain Research Institute, Universitatea din California la Los Angeles, Los Angeles, California 90095
Grace Barber
1 Administrația Veteranilor Sistemul de sănătate din Los Angeles, cercetare în neurobiologie (151A3), North Hills, California 91343 și
2 Departamentul de Psihiatrie și Științe Bio-Comportamentale și
3 Brain Research Institute, Universitatea din California din Los Angeles, Los Angeles, California 90095
Lalini Ramanathan
1 Administrația Veteranilor Sistemul de sănătate din Los Angeles, cercetare în neurobiologie (151A3), North Hills, California 91343 și
2 Departamentul de Psihiatrie și Științe Bio-Comportamentale și
3 Brain Research Institute, Universitatea din California din Los Angeles, Los Angeles, California 90095
Jerome M. Siegel
1 Administrația Veteranilor Sistemul de sănătate din Los Angeles, cercetare în neurobiologie (151A3), North Hills, California 91343 și
2 Departamentul de Psihiatrie și Științe Bio-Comportamentale și
3 Brain Research Institute, Universitatea din California din Los Angeles, Los Angeles, California 90095
Contribuțiile autorului: R.M., M.-F.W. și J.M.S. cercetare proiectată; R.M., M.-F.W., G.B. și L.R. cercetări efectuate; R.M., M.-F.W., G.B., L.R. și J.M.S. date analizate; R.M., M.-F.W., G.B., L.R. și J.M.S. a scris ziarul.
Abstract
Introducere
Disfuncția sistemului hipocretinei (Hcrt; orexin) la om, șoareci, șobolani și câini produce narcolepsie (Chemelli și colab., 1999; Lin și colab., 1999; Peyron și colab., 2000; Thannickal și colab., 2000; Sinton, 2011). La animalele normale, administrarea Hcrt într-o varietate de situri cerebrale (Nakamura și colab., 2000; España și colab., 2001; Korotkova și colab., 2003; Mieda și colab., 2004; Deadwyler și colab., 2007) este stârnirea și leziunea celulelor Hcrt (Gerashchenko și colab., 2001) provoacă somnolență. Neuronii Hcrt ating o activitate maximă în timpul trezirii și sunt minim activi în timpul somnului (Lee și colab., 2005; Mileykovskiy și colab., 2005). Un agent care blochează ambii receptori Hcrt s-a dovedit a fi eficient ca hipnotic (Brisbare-Roch și colab., 2007). O cantitate considerabilă de muncă a sugerat că eliberarea Hcrt este legată de consumul de alimente (Sakurai și colab., 1998), dar unele lucrări recente au ridicat îndoieli cu privire la specificitatea acestei relații (Wu și colab., 2002; Siegel, 2004; Funato și colab., 2009).
În general, studiile anterioare privind rolul comportamental al Hcrt la rozătoare au examinat funcția Hcrt numai în faza luminoasă (somn normal) sau întunecată (trezire normală), nu în ambele, și adesea în timpul unei singure sarcini. În studiul actual, am examinat atât capacitățile comportamentale ale șoarecilor Hcrt knock-out (KO), cât și activitatea neuronilor Hcrt, după cum se indică prin expresia Fos în colegii lor normali (WT). Am comparat aceste variabile în timpul fazelor de lumină și întuneric (de exemplu, perioadele de 12 ore în care luminile erau aprinse sau oprite). Am testat aceste animale pe sarcini motivate de întărirea hranei sau a apei, pe sarcini motivate de evitarea șocurilor, precum și ca răspuns la recompensă sau pedeapsă care nu depind de comportament.
În mod surprinzător, descoperim că șoarecii Hcrt KO au fost deficienți în a lucra pentru recompensă pozitivă în faza ușoară. Ei învață în același ritm ca și colegii lor de gunoi WT și au fost complet neafectați în a lucra pentru aceeași recompensă în faza întunecată.
În concordanță cu datele din KO, activitatea acestor celule în colegii lor WT, așa cum se indică prin expresia Fos, a fost maximă atunci când se lucra pentru recompensă pozitivă în timpul fazei luminoase, dar aceste celule nu au fost activate când au efectuat aceeași sarcină în întuneric fază. În plus, activarea celulelor Hcrt a fost dependentă de lumină, astfel încât aceste celule nu au fost activate de aceeași sarcină în faza de lumină circadiană la care au fost adaptate, în absența iluminării. Celulele Hcrt nu au fost activate numai prin recompensă. În timpul fazei luminoase, când animalele primesc recompense așteptate sau neașteptate, care nu depind de comportamentul de apăsare pe bară (operant), dar distribuite în același model și cantitate ca în sesiunile de presare pe bară, nu a fost observată nicio activare a Fosului în celulele Hcrt. Celulele Hcrt nu au fost activate în timpul evitării șocului în faza luminoasă sau întunecată, în ciuda nivelurilor maxime de excitare AEG. Ipotezăm că activitatea neuronilor Hcrt este legată de excitația necesară pentru a lucra pentru recompense în faza de lumină.
Materiale și metode
Subiecte
Aparat
Cuantificarea aportului de alimente
Pentru starea de presare a barelor alimentare, animalele au fost menținute la 85-90% din greutatea corporală inițială prin restricționarea consumului de alimente. Alimentele (LabDiet, PMI Nutrition) au fost raționate pe baza greutății zilnice a fiecărui animal. Odată ce greutatea animalului a devenit stabilă, aportul de alimente a fost restricționat și măsurat timp de 120 de minute între 11:00 A.M. și 1:00 P.M. în fiecare zi timp de 2 săptămâni în cușca de acasă. Apa era disponibilă ad libitum.
Cuantificarea aportului de apă
Pentru starea de presare a barei de apă, animalele au fost restricționate la apă, permițând accesul de două ori pe zi pentru un total de 90 de minute. Ședințele de băut au fost împărțite în două perioade: 60 min (11:00 AM până la 12:00 PM) și apoi 30 min (3:00 PM până la 3:30 PM). Odată ce animalele s-au adaptat la programul de băut, aportul de apă a fost măsurat timp de 60 de minute între 11:00 A.M. și 12:00 P.M. folosind un cilindru gradat în fiecare zi timp de 2 săptămâni în cușca de acasă. Mâncarea era disponibilă ad libitum.
Controlul camerei
Șoarecii au avut restricții alimentare pentru a menține 85-90% din greutatea lor corporală inițială, urmând aceeași procedură ca și pentru sarcina de operare a alimentelor. Odată ce greutatea animalelor s-a stabilizat, șoarecii au fost așezați zilnic în camerele de condiționare operante timp de 120 de minute, începând cu 2 ore după debutul fazei luminoase (între orele 9:00 și 13:00) sau 2 ore în faza întunecată (între orele 21:00 și 01:00). Atât lumina casei, cât și lumina tacului erau aprinse în timpul sesiunilor de lumină. Toate sesiunile experimentale au avut o durată de 120 de minute și au durat 5 săptămâni. Nu s-a dat mâncare, apă sau șoc în timpul ședințelor.
Proceduri chirurgicale: implantarea electrodului EEG și EMG
Opt animale, 5 KO și 3 WT au fost implantate cu EEG cortical și electrozi de electromiogramă a mușchilor gâtului (EMG) în condiții aseptice. Anestezia a fost indusă cu un amestec de ketamină/xilazină (100 mg/kg/15 mg/kg, i.p.) și apoi menținută cu un amestec gazos de izofluran în oxigen (0,6-1,2%) după ce animalele au fost plasate în dispozitivul stereotaxic. Temperatura corpului a fost menținută cu un tampon de încălzire circulat cu apă (Gaymar Industries). Capul a fost poziționat în cadrul stereotaxic, iar craniul a fost expus. Patru electrozi cu șurub din oțel inoxidabil, doi în oasele frontale [anteroposterior (AP): +1 mm; laterale: ± 1,5 mm, relativ la bregma) și două în oasele parietale (AP: +1 mm; lateral: ± 1,5 mm, relativ la lambda), au fost implantate pentru a înregistra EEG. Alți doi electrozi din sârmă din oțel inoxidabil au fost așezați în mușchii gâtului pentru a înregistra activitatea EMG. Toate cele șase conductoare ale electrodului au fost introduse într-un dop de plastic (SL6C/SB, Plastics One) care a fost apoi fixat pe craniu cu ciment dentar. A fost permisă o perioadă de recuperare postchirurgicală de 2 săptămâni înainte de efectuarea oricărui antrenament.
Înregistrări EEG și EMG
S-au făcut înregistrări ale șoarecilor atât în timpul spectacolului în camera operatorului, cât și în timpul ciclului spontan de somn/trezire în cuștile lor de acasă. EEG cortical a fost filtrat între 0,3 și 100 Hz și eșantionat la o rată de 128 Hz. EMG a fost filtrat între 30 Hz și 3 kHz și eșantionat la 1 kHz. Semnalele EEG și EMG au fost digitalizate cu interfața CED1401 Plus (Cambridge Electronic Design) și înregistrate pe un computer utilizând software-ul Spike2 (Cambridge Electronic Design).
Antrenament comportamental
Sarcini operante
Întărire pozitivă, recompensă alimentară.
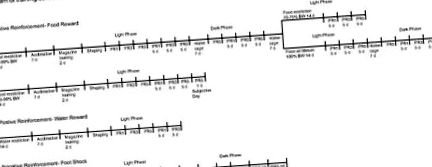
Programele de antrenament pentru toate experimentele comportamentale și histologice sunt prezentate în diagramele din Figura 1 (sarcini operante) și Figura 2 (sarcini neoperante). Șoarecii au avut restricții alimentare pentru a menține 85-90% din greutatea corporală inițială (cantitate de hrană: aproximativ 3–3,5 g/zi față de porțiunea regulată de 4–4,5 g/zi) și au fost expuși zilnic la 20 mg de pelete alimentare (Precizie fără praf) Pelete F0071, BioServe). Toate sesiunile de antrenament și cele mai multe experimente au fost efectuate în acest interval de greutate. În experimentele selectate descrise mai sus, animalele au fost ținute la 70-75% sau 100% din greutatea lor inițială.
Diagrama programelor de antrenament pentru condițiile de operare pentru animalele WT și KO. Condiții de operare: 1a, program de antrenament pentru întărirea alimentelor pentru fazele deschise și întunecate la 85-90% din greutatea corporală, diferitele niveluri ale greutății corporale (70-75% și 100%) în faza ușoară, 100% din greutatea corporală în întuneric fază; 1b, zi subiectivă; 2, program de pregătire pentru întărirea apei; 3, programul de antrenament pentru evitarea șocurilor. FR, Raport fix; PR, raport progresiv.
Diagrama programelor de antrenament pentru condiții neoperante pentru animalele WT și KO. Condiții neoperante: 1, recompensă așteptată și neașteptată; 2, șoc de picioare inevitabil; 3, controlul camerei; VI-4, interval variabil-4 min (livrare de alimente fără contingență la apăsarea pârghiei); FI-5 interval fix-5 min.
Pentru animalele care au finalizat sesiunea de 120 de minute, raportul final al preselor de bare pe peletă atins la sfârșitul sesiunii a fost utilizat pentru analiză. Pentru animalele care nu au finalizat sesiunea PR5 de 120 de minute (încetarea timpurie), punctul de pauză (TA) a fost definit operațional ca fiind ultimul raport finalizat (rezultând livrarea unei recompense alimentare) înainte de încheierea sesiunii. BP sau raportul final al ultimelor trei studii PR5 au fost mediate și utilizate pentru comparații statistice. Suplimentele alimentare au fost date după fiecare ședință pentru a menține toate animalele la greutatea lor corporală (70-75%, 85-90% sau 100% din greutatea lor inițială).
Ședințele operaționale pentru recompensarea alimentelor au fost desfășurate atât în timpul fazelor luminoase, cât și în cele întunecate. Pentru sesiunile de fază luminoasă, animalele au fost alergate începând cu 2 ore după debutul fazei luminoase (între orele 9:00 și 13:00). Pentru sesiunile de fază întunecată, animalele au fost alergate la 2 ore după debutul fazei întunecate (între orele 21:00 și 01:00).
Întărire pozitivă, recompensă pentru apă.
Armare negativă, evitare a șocurilor.
Șoarecii au primit o perioadă de 1 săptămână (120 min pe zi) pentru a se acomoda la camerele de condiționare operante. Apoi am determinat pragul de șoc pentru fiecare șoarece, variind nivelurile de șoc de la 0,06 la 0,4 mA (cu trepte de 0,05 mA) folosind metoda de titrare modificată a lui Turner și colab. (1967). Am efectuat mai întâi o serie ascendentă de intensitate a șocului, apoi o serie descendentă și în cele din urmă o secvență aleatorie pentru fiecare mouse. Fiecare șoc a durat 1 s cu un interval interstimular de 15 s și o pauză de 30 s între serie. Un observator orb de mărimea stimulului a cuantificat reacția pe o scară de la 0 la 4 (0 = fără răspuns, 1 = scuturare, 2 = hop/mișcare înainte sau înapoi, 3 = alergare și 4 = salt). A fost aleasă o intensitate pentru fiecare animal care a produs un răspuns la scară de 2.
Sesiuni operante pentru evitarea șocurilor au fost efectuate atât în fazele luminoase, cât și în cele întunecate. Pentru sesiunile de fază luminoasă, animalele au fost alergate începând cu 2 ore după debutul fazei luminoase (între orele 9:00 și 13:00). Pentru sesiunile de fază întunecată, animalele au fost alergate începând cu 2 ore după debutul fazei întunecate (între orele 21:00 și 01:00).
Sarcini neoperante
Recompensă alimentară așteptată și neașteptată.
Șoarecii au primit o săptămână de aclimatizare (120 de minute pe zi) în camerele de înregistrare cu lumina casei aprinsă în timpul fazei de lumină, urmată de expunerea zilnică la 20 mg de pelete alimentare. Raționarea alimentelor a început apoi să mențină 85-90% din greutatea corporală inițială. Odată ce greutatea animalelor sa stabilizat timp de 14 zile, au început sesiunile experimentale și animalele au fost împărțite în două grupuri. În grupul de recompensă așteptat, animalele au fost plasate zilnic în camera de condiționare și peleții alimentari au fost livrați la VI-4 min. Sesiunile au fost efectuate zilnic timp de 4 săptămâni. În grupul de recompensă neașteptat, animalele au fost plasate zilnic în camera de condiționare, dar peletele au fost livrate la VI-4 minute numai în ziua în care animalele au fost ucise. Pentru acest grup, peletele au fost livrate pe o tavă pentru alimente pe podeaua coliviei, mai degrabă decât în jgheabul obișnuit, astfel încât animalele să poată vedea peletele atunci când au fost livrate. În ambele cazuri, nu a fost necesară sau efectuată nicio presă cu bare pentru obținerea peletelor. Toate sesiunile experimentale au avut o durată de 120 de minute.
Șoc de picioare inevitabil.
Șoarecii au primit o perioadă de 1 săptămână (120 min/zi) pentru a se acomoda în camerele operatorii. Am determinat apoi pragul de șoc pentru fiecare mouse folosind aceeași procedură descrisă în grupul de evitare a șocurilor. A fost aleasă o intensitate (interval 0,25-0,4 mA) pentru fiecare animal care a produs un răspuns la scară de 2. După aceea, animalele au fost plasate zilnic în cameră (120 min) timp de 4 săptămâni. Doar în ziua uciderii animalelor, a fost livrat un șoc inevitabil (1 s) la un interval fix de 5 min (FI-5 min) în timpul sesiunii de 120 de minute.
Proceduri imunohistochimice
Imunohistochimia dublă pentru detectarea proteinei Fos și Hcrt a fost efectuată la animale după 120 de minute de sarcini operante, sarcini neoperante sau stație în cameră. Au fost utilizate unsprezece grupuri experimentale diferite; 8 în faza luminoasă și 3 în faza întunecată. Pentru sarcina de întărire a alimentelor, a fost utilizat un program PR3.
Pentru faza ușoară, au fost utilizate următoarele condiții: (1) alimente PR (vezi Fig. 6 aL1); (2) evitarea șocurilor (vezi Fig. 6 aL2); (3) controlul camerei (vezi Fig. 6 aL3); (4) mâncare așteptată; (5) mâncare neașteptată; (6) extincția șocului (animale antrenate pentru a evita șocul picioarelor până când au atins programul PR3-10, dar cu șocul nu a fost livrat în ziua uciderii); (7) șoc inevitabil; și (8) zi subiectivă (mâncare PR în fază luminoasă fără lumina casei în ziua uciderii).
Pentru faza întunecată, au fost utilizate următoarele condiții: (1) alimente PR (a se vedea Fig. 6 aD1); (2) evitarea șocurilor (Fig. 6 aD2); și (3) controlul camerei (Fig. 6 aD3).
Imediat după terminarea ședințelor, animalele au fost profund anesteziate cu Nembutal (100 mg/kg, ip) și perfuzate transcardic cu 0,03 L de PBS heparinizat (1000 U/L) PBS (0,1 m, pH 7,4) urmat de 0,07 l de 4% paraformaldehidă în tampon fosfat (PB; 0,1 m, pH 7,4). Creierul a fost îndepărtat și scufundat timp de 15 minute în paraformaldehidă 4% în PB. După postfixare, țesutul a fost transferat la o soluție de zaharoză de 20% și apoi la 30% pentru crioprotecție. Patruzeci și opt de ore mai târziu, creierul a fost înghețat și tăiat în secțiuni de 35 μm folosind un criostat (modelul 1800 Cryocut, Reichert Jung). Fiecare secțiune a fost plasată într-un godeu dintr-o tavă cu 6 godeuri care conține PBS. Procedurile imunohistochimice au fost efectuate imediat.
Detectarea Fos a fost efectuată prin incubarea secvențială a secțiunilor plutitoare libere. Secțiunile au fost incubate mai întâi în ser anti-Fos de iepure (PC-38, Calbiochem), 1: 10.000 în PBS, 0,3% Triton X-100 (PBST). Au fost apoi expuși la IgG capră biotinilată anti-iepure (Jackson Immunoresearch) 1: 600 în PBST, urmată de incubație în ABC standard (Vector Laboratories), 1: 400. Țesutul a fost prelucrat prin metoda cu tetrahidroclorură de diaminobenzidină (DAB) nichel-îmbunătățită, care a constat în imersia țesutului în 0,6% sulfat de nichel amoniu, 0,02% DAB și 0,03% peroxid de hidrogen în 10 ml de PBS, timp de 4-5 min. După marcarea Fos, țesutul a fost clătit în PBST și incubat în iepure anti-Hcrt B (H-003-32, Phoenix Pharmaceutical), 1: 10.000 și PBST. Ulterior, țesutul a fost scufundat în IgG 1: 600 capră biotinilată anti-iepure în PBST, urmată de incubare în standardul ABC 1: 400. Țesutul a fost apoi prelucrat cu metoda DAB timp de 4-5 min.
Numărul și distribuția celulelor Hcrt + și Fos +/Hcrt + au fost determinate în fiecare a treia secțiune de-a lungul hipotalamusului. A fost utilizat un microscop Nikon Eclipse 80i cu scenă motorizată pe trei axe, cameră video, interfață Neurolucida și software Stereoinvestigator (MicroBrightField). Numărarea celulelor a fost efectuată folosind obiectivul 60 × de către un histolog instruit, care a fost întotdeauna orb de tratamente. Criteriile utilizate în prezenta lucrare pentru a defini parcelarea anatomică a hipotalamusului s-au bazat pe atlasul Franklin și Paxinos (1997) al creierului șoarecelui. Zona perifornicală (PFA) a fost definită ca regiunea care înconjoară fornixul (140 μm din perimetrul structurii). Restul hipotalamusului a fost împărțit în continuare într-o subdiviziune medială [hipotalamus medial (MH)], care cuprindea zona de la limita medială a fornixului până la al treilea ventricul (3 V) și o subdiviziune laterală [hipotalamus lateral (LH) ], care s-a extins de la limita medială a fornixului până la marginea laterală a hipotalamusului (vezi Fig. 6 b).
Analiza datelor
Datele au fost supuse fie ANOVA, urmate de comparații post-hoc ale testului Newman-Keuls, fie testului t. Toate astfel de teste au fost cu două cozi. Rezultatele au fost considerate semnificative statistic dacă p Figura 3 a, b. A existat un efect semnificativ al genotipului (F (1,14) = 9,97, p Fig. 3 c). Animalele KO au arătat o reducere semnificativă a raportului TA/final atins în programul PR5 (52,3 ± 6,6 vs 141,3 ± 15,8 pentru WT, p Fig. 3 c). Toate animalele Hcrt KO au prezentat pauze frecvente în timpul studiilor și, în cele din urmă, toate au oprit apăsarea manetei timp de 15 min, îndeplinind criteriul de încheiere a sesiunilor experimentale de 120 min (durata medie a sesiunii KO 45,6 ± 4,7 min). O analiză detaliată a datelor a arătat că, în primele 10 minute ale sesiunilor experimentale în faza ușoară, KOs și WT au avut un model similar de performanță (Fig. 3 d). Cu toate acestea, pe măsură ce sesiunile au progresat, KO-urile au afișat o scădere semnificativă și constantă a ratei de apăsare a pârghiei, spre deosebire de WT-uri. A existat un efect semnificativ al genotipului (F (1,16) = 8,13, p Fig. 3 d). Pauzele frecvente în comportamentul operant au fost evidente în analiza intervalelor de interpresare; Animalele KO au prezentat un număr mai mare de intervale lungi de interpresare, în special cele> 2 s (toate p Fig. 3 e).
- Joaquin Phoenix detaliază scăderea enormă în greutate, dezvoltându-și râsul pentru rolul Joker - Consecința
- Matthew McConaughey arată uimitor de slab după ce a slăbit pentru rolul pacientului cu HIV în The Dallas
- Cum să mănânci bine când ai o boală Graves - Deși nu există o dietă specifică pentru a preveni sau trata
- Foarte recomandat
- IJERPH Prevalența gratuită a textului complet al efectului relativ de vârstă în fotbalul rus Rolul cronologic