Mansi Mehta
o Divizie de Nefrologie, Școala de Medicină NYU, New York, NY, SUA
David S. Goldfarb
o Divizie de Nefrologie, Școala de Medicină NYU, New York, NY, SUA
b New York Harbor VA Healthcare System, New York, NY, SUA
Lama Nazzal
o Divizie de Nefrologie, Școala de Medicină NYU, New York, NY, SUA
Abstract
Nefrolitiaza este o boală complexă cu prevalență mondială care este influențată atât de factorii genetici, cât și de factorii de mediu. Aproximativ 75% din calculii renali sunt compuși în principal din oxalat de calciu, iar oxalatul urinar este considerat un factor crucial de risc. Microorganismele pot avea un rol în patogeneza și prevenirea calculilor renali, iar implicarea microbiomului intestinal în această boală renală a fost un domeniu recent de interes. Oxalobacter formigenes este o bacterie gram negativă care degradează oxalatul din intestin scăzând excreția de oxalat urinar. În această revizuire, examinăm datele care studiază rolul oxigenilor formigeni în boala calculilor renali la oameni și animale, efectul antibioticelor asupra colonizării sale și rolul potențial al probioticelor și al comunităților microbiene întregi ca intervenții terapeutice.
1. Introducere
Nefrolitiaza este o boală complexă influențată de factori genetici și de mediu. Studiile efectuate pe gemene au evidențiat un risc de ereditate de 56% pentru calculi, în timp ce alți factori implicați includ dieta, exercițiile fizice, mediul de lucru și geografia [1]. În ultimii ani, a fost explorat rolul microbiomului intestinal în influențarea compoziției urinei, rezultând date care sugerează că afectează incidența calculilor renali. Vom revizui aici dovezile care susțin această ipoteză. Aici nu este analizat rolul bine descris al infecțiilor tractului urinar cu specii Proteus și alte organisme producătoare de uree asociate cu formarea de pietre de struvit.
Numărul enorm de microorganisme care colonizează corpul uman și formează comunități complexe este denumit microbiom. Funcțional, comunică cu celulele umane gazdă și efectuează diverse procese biologice. Există o îngrijorare din ce în ce mai mare că dieta și stilul de viață „occidental” au modificat compoziția genetică și activitatea metabolică a microbiomului intestinal. Efectele acestor modificări asupra populațiilor bacteriene au fost asociate cu o incidență tot mai mare a bolilor precum obezitatea, bolile vasculare coronariene, alergiile și sindromul metabolic [2]. Aceste efecte fac posibilă posibilitatea ca microbiomul intestinal să afecteze și absorbția și secreția substanțelor dizolvate relevante pentru formarea calculilor renali.
Până în prezent, se știe relativ puțin despre rolul general al microbiomului intestinal în fiziopatologia nefrolitiazei. Un studiu recent a identificat diferențe distincte în microbiomul intestinal al pacienților cu pietre la rinichi, comparativ cu pacienții fără pietre [3]. Probele de fecale și urine colectate de la ambele grupuri de pacienți au relevat 178 de genuri, dintre care cele mai abundente cinci enterotipuri sau comunități bacteriene distincte din fiecare grup au constituit mai mult de 50% din abundența bacteriană identificată. Genul Prevotella a fost cel mai abundent în grupul de control, în timp ce genul Bacteroides a fost cel mai abundent în grupul cu pietre la rinichi. Eubacterium a fost invers corelat cu nivelurile de oxalat și Escherichia invers corelat cu nivelurile de citrat. Dacă aceste diferențe în abundența bacteriană observate la formatorii de piatră și martori sunt cauzale în calea formării pietrei sau secundare altor variabile, cum ar fi expunerea la antibiotice sau dieta, este incert. Astfel de caracterizări largi ale microbiomului vor avea nevoie de investigații mai ample pentru a se lega de substanțe dizolvate specifice care compun pietre la rinichi și agenți specifici care afectează procesul de cristalizare.
2. Oxalobacter format
2.1. Caracteristici genetice și microbiologice
Descoperirea unei bacterii degradante a oxalatului, Oxalobacter formigenes (Oxf), de către Allison și colegii săi în 1985 a atras o atenție considerabilă cu privire la implicarea sa în boala de piatră a oxalatului de calciu [4]. Rezultatele clinice au sugerat că există o corelație directă între absența organismului și hiperoxalurie și formarea de piatră oxalată. Oxf este o bacterie anaerobă obligatorie Gram negativă, care face parte din flora bacteriană normală din intestinul gros al oamenilor și al altor specii de mamifere. Este unic prin faptul că necesită oxalat atât ca sursă de carbon, cât și pentru generarea de ATP, pe care îl găsește în lumenul intestinal [5]. A fost găsit în intestinul oamenilor, rozătoarelor, câinilor, porcilor și vitelor. Dacă este prezent, ar putea să degradeze oxalatul ingerat și să reducă absorbția intestinală și să stimuleze secreția de oxalat din colon, oferind protecție împotriva hiperoxaluriei.
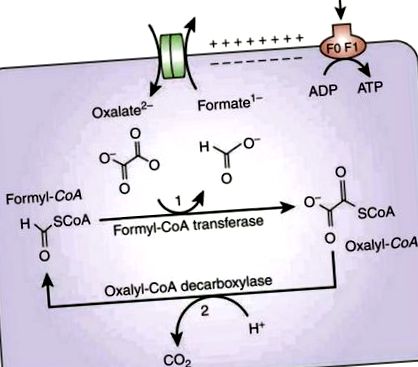
Metabolizarea oxalatului de către Oxf necesită absorbția oxalatului extracelular în schimbul formatului de către transportorul de membrană numit OxlT, codificat de gena oxIT (vezi Fig. 1). Gena frc codifică formil CoA transferaza, Frc, care activează oxalatul prin adăugarea unei molecule de coenzimă A pentru a forma oxalil-CoA. Oxalil-CoA este apoi decarboxilat în CO2 și formiat, iar acesta din urmă este apoi utilizat de oxlT pentru a prelua mai mult oxalat. Reacția de decarboxilare este catalizată de enzima oxalil-CoA-decarboxilază, codificată de gena oxc [6]. Un gradient interior pentru rezultatele protonilor, care determină producția de ATP.
Metabolismul oxalatului de către Oxf [6]. Reprodus cu permisiunea.
În timp ce O. formigenes este considerat a fi cel mai eficient degradant al oxalatului, rolul altor microbiote care degradează oxalatul în intestinul uman nu este pe deplin elucidat. Mai multe specii bacteriene au atât oxc cât și frc și demonstrează activitate de degradare a oxalaților in vitro [7]. Recent, Hatch și colab. a demonstrat că colonizarea Bifidobacterium lactis scade oxalatul urinar prin degradarea oxalatului alimentar și reducerea absorbției sale intestinale la un model de șoarece [8]. Într-un studiu efectuat pe bărbați din Africa de Sud, speciile Lactobacillus cu capacitate mare de degradare a oxalatului au fost identificate și asociate cu o prevalență mai mică a calculilor renali cu oxalat de calciu [9].
Comparația profilurilor de acizi grași celulari a 17 tulpini de Oxf a separat aceste tulpini în două grupuri principale, desemnate în prezent ca Grupul 1 (de exemplu tulpina OXCC13) și Grupul 2 (de exemplu tulpina HOxBLS). Secvențierea genomului acestor 2 tulpini ca parte a proiectului Microbiom uman a oferit o oportunitate de a ne spori înțelegerea proprietăților biologice importante ale organismului [10]. Analiza proteomică suplimentară a Oxf în culturi logare și în fază de creștere staționară a permis identificarea proteinelor specifice care sunt importante pentru creșterea și supraviețuirea sa [11].
Dezvoltarea unui test de detectare bazat pe PCR specific pentru genele oxc și/sau frc din Oxf a permis studiul rolului acestui organism în metabolismul oxalat. Detectarea rapidă a Oxf în culturile fecale și specimenele de scaun proaspete este posibilă cu un grad ridicat de sensibilitate și specificitate [12]. Măsurarea capacității de degradare a oxalatului scaunului este un alt mod de a determina indirect prezența sau absența și activitatea organismului [13].
Studiile au raportat o variație extinsă a gradului în care Oxf colonizează intestinul uman normal. Pot exista niveluri nedetectabile ale bacteriei sau poate fi prezentă cu până la 10 7 pe gram de fecale. Nivelurile de Oxf din probele de fecale au crescut de aproximativ 10 ori cu o creștere de 10 ori a oxalatului alimentar. În contrast, abundența organismului a scăzut odată cu creșterea aportului de calciu, care ar lega oxalatul și ar reduce disponibilitatea acestuia [14].
Recent am descris prevalența, abundența relativă și stabilitatea Oxf în microbiomul intestinal uman, așa cum au fost relevate de datele Proiectului Microbiomului Uman (HMP) [15]. Probele de fecale de la 242 de adulți tineri sănătoși au fost analizate folosind secvențierea pușcii genomice întregi (WGS) și secvențierea V13 sau V35 16S rRNA. Analiza setului de date WGS a arătat că 29 (31%) din 94 de subiecți au fost Oxf-pozitiv, în timp ce analiza datelor V13 și V35 a arătat prevalența Oxf la 15% (22/155) și respectiv 11% (23/210). Astfel, detectarea Oxf de către anchetatorii HMP depindea foarte mult de metodele utilizate: WGS a fost mai sensibil decât secvențierea ARNr 16S. Am constatat că toți cei 29 de subiecți pozitivi la Oxf din analiza WGS au fost colonizați cu tulpina OXCC13. Cu toate acestea, dintre acești 29, 59% au fost simultan colonizați cu tulpina HOxBLS. Astfel, co-colonizarea cu ambele tulpini a fost comună. Nu s-a stabilit dacă cele două tulpini au o semnificație clinică diferită.
3. Studii la om
3.1. Prevalența O. formigenes la om
Un procent mare din populație este colonizat cu Oxf. La adulții din SUA, rata colonizării Oxf a fost estimată să varieze între 38 și 62%, dar la nivel mondial, rata colonizării este mai mare la populațiile cu expunere limitată la antibiotice. De exemplu, în India, prevalența a fost raportată la aproximativ 60%; în Coreea, prevalența a fost de 77% [16,17]. Ratele scăzute de colonizare a Oxf au fost observate în mai multe condiții patologice, inclusiv boala inflamatorie a intestinului, nefrolitiaza recurentă, obezitatea morbidă, fibroza chistică și nefrolitiaza idiopatică a calciului, toate acestea fiind asociate cu calculii oxalat de calciu (Tabelul 1).
tabelul 1
Ratele de colonizare raportate la Oxf la diferite populații adulte.
| India | Normal | 48 | 56 |
| Boala inflamatorie a intestinului | 48 | 10 | |
| Statele Unite ale Americii | Normal | 26 | 62 |
| Boala inflamatorie a intestinului | 16 | 9 | |
| Statele Unite ale Americii | Normal | 259 | 38 |
| Formatori de piatră CaOx recurenți | 247 | 17 | |
| Germania | Normal | 61 | 69 |
| Formatori CaOx Stone | 145 | 43 | |
| Coreea | Normal | 233 | 77 |
| Formatori CaOx Stone | 103 | 46 |
Colonizarea de către Oxf a fost investigată într-un studiu transversal care a examinat copii din Ucraina [18]. Această populație a fost aleasă datorită accesului limitat la utilizarea de rutină a antibioticelor în timpul copilăriei. Organismul nu a putut fi detectat la sugari cu vârsta mai mică de 6-9 luni și a început să apară în tractul intestinal al copiilor în jurul vârstei de 1 an. La vârsta de 3-4 ani, toți copiii au prezentat colonizare, numărul copiilor colonizați scăzând între 8 și 12 ani. Un alt grup de pacienți cu un interes deosebit sunt cei cu fibroză chistică (CF), despre care se știe că au o prevalență crescută a calculilor renali. Pacienții cu CF sunt supuși mai multor cure de antibiotice ca urmare a susceptibilității lor crescute la infecții pulmonare. Într-un studiu privind excreția urinară de oxalat la pacienții cu CF, 71% din 21 de pacienți cu control non-CF au fost colonizați de Oxf, comparativ cu doar 16% din 43 de pacienți cu CF [19]. Toți cei 7 pacienți cu CF colonizați de bacterie au avut excreție normală de oxalat urinar, în timp ce 53% din 36 de pacienți necolonizați au avut hiperoxalurie, susținând ipoteza că prezența organismului protejată împotriva hiperoxaluriei.
3.2. Asocierea O. formigenelor și calculilor renali
Există mai multe studii epidemiologice care sugerează un rol protector pentru Oxf. Studiile la om au arătat, de asemenea, o asociere inversă puternică între colonizarea Oxf și calculii renali recurenti cu oxalat de calciu. Un studiu de control al cazurilor efectuat pe 247 de pacienți cu episoade recurente de calculi cu oxalat de calciu și 259 de subiecți fără boală de calculi, în funcție de vârstă, sex și regiune, a constatat o puternică asociere inversă între colonizarea cu Oxf și calculi recurenti cu oxalat de calciu cu o reducere a riscului de 70% [20]. . Dintre subiecții martor, s-a observat o creștere a prevalenței Oxf cu un consum crescut de oxalat; inversul a fost văzut cu utilizarea antibioticelor. Colecțiile de urină de 24 de ore au relevat o tendință puternică a riscului de calculi cu creșterea excreției de oxalat urinar. Cu toate acestea, nu a existat nicio diferență în excreția mediană de oxalat urinar la pacienții care au testat pozitiv sau negativ pentru Oxf.
O întrebare cheie fără răspuns este dacă absența Oxf crește riscul formării de piatră de oxalat de calciu prin creșterea excreției de oxalat urinar. În cadrul unei diete controlate și standardizate, s-a dovedit că excreția urinară de oxalat este mai mică la pacienții cu Oxf pozitiv decât la pacienții cu Oxf negativ [21]. Rezultatele unui studiu controlat pe dietă la 22 de pacienți care nu au format pietre, care au fost în mod natural colonizați sau necolonizați cu Oxf sugerează că diferențele în excreția urinară de oxalat pot fi afectate de diferențele în aportul alimentar de calciu și oxalat [14].
Duncan și colab. a arătat că ingestia orală a unei doze unice de Oxf, urmată de o încărcătură dietetică de oxalat, a dus la reducerea excreției de oxalat urinar, recuperarea activității de degradare a oxalatului în fecale și colonizarea prelungită la 3 din 3 participanți. Un studiu randomizat, multicentric, la pacienții cu hiperoxalurie primară nu a reușit să arate un efect clar al tratamentului Oxf pentru a reduce excreția urinară de oxalat. Doza și viabilitatea tratamentului bacterian administrat au fost puse la îndoială, deși rezultatele au sugerat un efect de tratament atunci când oxalatul de urină a fost normalizat pentru creatinină [22].
3.3. Efect antibiotic asupra O. formigenes la om și șoareci
Un alt studiu a examinat efectul impulsurilor antibiotice în plus față de modificările dietetice la șoareci pentru a înțelege perturbările fiziologice rezultate [24]. În tratamentul cu antibiotice pulsate (PAT) în modelul timpuriu al șoarecilor, șoarecii au fost împărțiți în 3 grupuri. Grupul de control nu a primit antibiotice, în timp ce celelalte două au primit 3 impulsuri de tilozină (o macrolidă) sau amoxicilină. Pentru a vedea efectul modelului PAT asupra degradării oxalatului, abundența relativă medie a fiecăreia dintre cele trei gene implicate în metabolismul oxalat a fost măsurată în timp. Oxc, frc și oxlT nu au fost specifice Oxf, dar ar putea proveni de la alte bacterii care degradează oxalatul. FIG. 2 arată că impulsurile antibiotice și modificările dietetice au cauzat modificări semnificative în abundența relativă a expresiei genice a oxc, frc și oxlT în timpul dezvoltării; totuși direcția schimbării nu a fost uniformă. Acest lucru ar putea indica un efect diferențial al acestor variabile asupra bacteriilor care degradează oxalatul, inclusiv Oxf.
- Relația dintre boala de piatră și obezitate în Iordania Abu Ghazaleh LA, Budair Z - Saudi J Rinichi
- Dieta cu pietre la rinichi Nu este atât de restrictivă pe cât ați putea crede - Baltimore Sun.
- Urocit-K (citrat de potasiu), Tratament cu pietre la rinichi
- Suprimarea formării de acid uric din acidul nucleic dietetic cu alopurinol The American Journal
- Medicul a vorbit despre rolul usturoiului și ghimbirului în întărirea sistemului imunitar Știri Știri