Rong-Ze Yang
1 Divizia de endocrinologie, diabet și nutriție, Facultatea de Medicină a Universității din Maryland
Jacob B. Blumenthal
2 Divizia de Gerontologie și Medicină Geriatrică, Facultatea de Medicină a Universității din Maryland
3 Serviciul de cercetare VA, Centrul de cercetare, educație și clinică geriatrică, Centrul medical pentru administrația veteranilor din Baltimore
Nicole M. Glynn
1 Divizia de endocrinologie, diabet și nutriție, Facultatea de Medicină a Universității din Maryland
Mi-Jeong Lee
1 Divizia de endocrinologie, diabet și nutriție, Facultatea de Medicină a Universității din Maryland
Andrew P. Goldberg
2 Divizia de Gerontologie și Medicină Geriatrică, Facultatea de Medicină a Universității din Maryland
3 Serviciul de cercetare VA, Centrul de cercetare, educație și clinică geriatrică, Centrul medical pentru administrația veteranilor din Baltimore
Da-Wei Gong
1 Divizia de endocrinologie, diabet și nutriție, Facultatea de Medicină a Universității din Maryland
3 Serviciul de cercetare VA, Centrul de cercetare, educație și clinică geriatrică, Centrul medical pentru administrația veteranilor din Baltimore
Alice S. Ryan
2 Divizia de Gerontologie și Medicină Geriatrică, Facultatea de Medicină a Universității din Maryland
3 Serviciul de cercetare VA, Centrul de cercetare, educație și clinică geriatrică, Centrul medical pentru administrația veteranilor din Baltimore
Abstract
Obiectiv
Scopul studiului a fost de a determina efectul pierderii în greutate (WL) singur și cu exerciții aerobice (WL + AEX) asupra nivelurilor de SAA și a secreției adipoase de SAA din depozitele gluteale și abdominale.
Proiectare și metode
Nouăzeci și șase de femei în postmenopauză supraponderale sau obeze au efectuat un WL de 6 luni singure (n = 47) sau cu antrenament de exerciții aerobe (n = 49) (WL de 6 luni și WL + AEX sunt considerate WL atunci când grupurile au fost combinate). Nivelurile lor de SAA serice, greutatea corporală și secreția SAA adiposă ex vivo din depozitul gluteal și abdominal au fost măsurate înainte și după intervențiile WL.
Rezultate
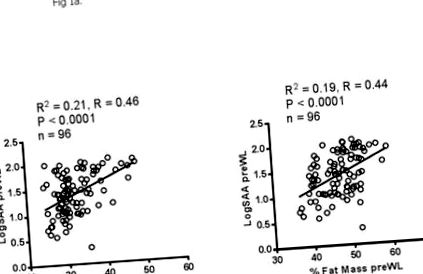
Participanții au pierdut în medie 8% din greutatea corporală, cu o scădere de 10% a serului SAA. Nivelurile serice de SAA au rămas semnificativ corelate cu greutatea corporală înainte și după WL. Cu toate acestea, modificările nivelului SAA seric nu s-au corelat cu modificările greutății corporale. Țesutul adipos gluteal secretat
50% mai mult SAA decât țesutul abdominal, dar modificările secreției abdominale, dar nu gluteale, corelate [R 2 = 0,19, p 25 kg/m 2, interval de 25-48 kg/m 2] femeilor cu vârste cuprinse între 49 și 76. Femeile erau în postmenopauză și nu aveau menstruația ≥ 1 an. Detalii despre acest program WL au fost descrise în altă parte (20). Pe scurt, toate femeile din WL și WL + AEX participau la cursuri săptămânale de WL conduse de un dietetician înregistrat. Femeile au fost instruite să-și reducă aportul caloric cu 300-500 kcal/zi. Pentru intervenția WL + AEX, femeile au făcut exerciții de trei ori pe săptămână timp de șase luni folosind benzile de alergat și antrenorii eliptici, așa cum este descris (20). -absorptiometrie cu raze X cu energie (Prodigy; Lunar Radiation Corp., Madison, WI.) Probele de sânge au fost obținute dintr-o venă antecubitală după un post de 12 ore peste noapte, 36-48 de ore după ultima perioadă de exercițiu în WL + AEX, și stocate la -80 ° C până la analiză. Nivelurile serice rapide de SAA au fost măsurate înainte și după interval participare.
Cultura țesutului adipos și măsurarea SAA
Unii dintre participanți au suferit biopsie de țesut adipos înainte și după regimul WL. Biopsiile au fost efectuate la 36-48 de ore după ultima perioadă de exercițiu în grupul WL + AEX. Probele de țesut adipos abdominal și gluteal au fost obținute de la subiecții la jeun peste noapte prin aspirare cu o canulă de 3 mm sub anestezie locală cu lidocaină așa cum s-a descris anterior (21). Fragmentele de țesut adipos au fost incubate timp de 3 ore în M199-1% BSA (
100 mg/ml) și mediul a fost colectat și depozitat la -80 ° C așa cum s-a descris anterior (22), până la testul SAA.
Nivelurile serice de SAA au fost măsurate cu un kit de test imunosorbent legat de enzime (ELISA) conform instrucțiunilor producătorului (BioSource, Camarillo, CA, SUA). Pentru măsurarea sensibilă a nivelurilor SAA într-un volum mic de medii condiționate ale culturii adipoase umane acute, s-a folosit un test multiplex de electrochiluminiscență (ECL) Meso Scale Discovery (Meso Scale Discovery, Gaithersburg, MD, SUA). Sensibilitățile de detectare SAA de către ELISA și MSD au fost de 5 ng/ml, respectiv 8 pg/ml. Pentru ELISA, coeficienții de variație (CV) intra și inter-test au fost de 5%, respectiv 8%, în timp ce pentru MSD, CV-ul intra-test a fost de 4%. CV-ul inter-test nu a fost determinat, deoarece toate probele au fost testate într-o singură dată. Corelația co-eficientă dintre cele două teste a fost de 0,87. Toate probele au fost testate în duplicat și media a fost utilizată pentru analiza datelor.
analize statistice
10%, FIG. 1b) în întreaga cohortă, modificările interindividuale ale nivelurilor serice de SAA au variat dramatic, variind de la -84 la 248% comparativ cu modificările relativ înguste ale WL între -2,1 și -24,0%. Nu a existat nicio corelație între modificările valorilor SAA serice și modificările greutății corporale exprimate în termeni absoluți sau relativi, fie în ceea ce privește procentul (Fig. 2), fie procentul transformat în log (nu este prezentat) la participanții grupați sau separați pe grup.
Relația dintre modificările IMC și modificările SAA serice.
Efectele WL asupra secreției SAA
Nivelurile reduse de SAA serice post-WL ar putea fi rezultatul secreției normale de SAA din masa redusă de grăsime și/sau secreția redusă din adipos sau alte țesuturi. Pentru a investiga aceste posibilități, 42 de subiecți au suferit biopsie de țesut adipos abdominal și gluteal înainte și după WL și secreția SAA adiposă a fost măsurată ex vivo. Deoarece nu a existat nicio diferență semnificativă în efectul WL vs. WL + AEX pe secreția SAA adiposă (datele nu sunt prezentate), datele despre secreția SAA au fost reunite din ambele grupuri pentru analize statistice ulterioare. Ca rezultat (Fig. 3), țesutul adipos gluteal a secretat
50% mai mult SAA decât abdominalul (p Fig. 3a). Cantitatea de SAA secretată din regiunea gluteală a fost bine corelată cu cea din depozitul abdominal anterior (R = 0,54, p Fig. 3b). În special, a existat o variație mai mare de până la 100 de ori diferență în secreția SAA înainte și după WL. Astfel, deși secreția generală SAA adiposă a scăzut cu 30% (p = 0,09) și 22% (p = 0,6) în depozitele abdominale și, respectiv, gluteale, după WL, reducerea după WL nu a atins semnificația statistică.
Corelarea modificării SAA sistemice cu modificarea secreției SAA adiposă din depozitul adipos abdominal, dar nu gluteal, în timpul WL.
Discuţie
19 și 26% din variația sistemică a SAA în stările pre și post-WL (Fig. 1) și mecanismele independente de masa grăsimii (de exemplu, rata secreției SAA adipoase și a secreției SAA ne-adipoase) au un efect mai mare pentru a determina niveluri SAA sistemice.
Deoarece există diferențe regionale în expresia și reglarea genelor în depozitul de grăsime subcutanat (26-28), am examinat modificările eliberării SAA ex vivo a probelor de adipos din regiunile abdominale și gluteale. Rezultatele arată că țesutul adipos din depozitul gluteal secretă
50% mai mult SAA decât cel abdominal, atât înainte, cât și după WL. Se observă o corelație puternică în cantitatea de secreție de SAA între cele două depozite, sugerând un mecanism de reglare similar pentru producția de SAA adipos între depozite. În mod remarcabil, s-a observat o mare variație individuală a secreției SAA în timpul WL, indicând faptul că rata secreției SAA este foarte variabilă în rândul indivizilor înainte și după WL. Drept urmare, dramaticul
Reducerea cu 25% a secreției SAA după WL nu a atins semnificația statistică.
Acest studiu constată o corelație moderată între reducerea nivelurilor serice de SAA și cea a secreției abdominale SAA (R = 0,43, Fig. 4), sugerând că scăderea secreției abdominale SAA ar putea contribui la scăderea SAA în circulație după WL. Este interesant de observat că, deși țesutul adipos gluteal eliberează mai mult SAA decât țesutul adipos abdominal, numai secreția SAA din țesutul adipos abdominal este semnificativ legată de nivelurile de SAA circulante. O posibilă explicație este că starea abdominală locală facilitează eliberarea SAA la nivelul întregului corp. Acest lucru este susținut de constatarea faptului că debitul sanguin în depozitul abdominal este de trei ori mai mare decât cel din depozitul gluteal (29). Mai mult, temperatura pielii abdominale este cu 1 ° C mai mare decât glutealul (33,3 vs. 32,2 ° C), ceea ce poate spori eliberarea SAA din depozitul abdominal în circulație. O altă posibilitate este prin intermediul unui mecanism indirect, în care țesutul adipos abdominal eliberează sistemic mai mulți acizi grași pro-inflamatori (29). Reducerea locală a SAA ar reduce lipoliza și producția de acizi grași și citokine inflamatorii în circulație, rezultând într-o reducere sistemică a stării inflamatorii și a producției de SAA din țesutul non-adipos, cum ar fi ficatul.
Colectiv, datele noastre susțin în continuare faptul că IMC și masa de grăsime sunt un factor determinant al nivelurilor sistemice de SAA. Cu toate acestea, reducerea SAA sistemică post-WL nu pare a fi o consecință directă a reducerii IMC sau a masei grase singure și poate fi atribuită altor boli cronice, cum ar fi stresul, hipertensiunea și osteoartrita (30-32). O variație atât de mare ar putea fi ascunsă sau copleșită contribuția modificărilor masei grase la nivelurile SAA sistemice în timpul WL. Motive pentru individul mai mare pre- vs. variația post-WL în secreția SAA ex vivo din țesutul adipos nu este clară. Explicațiile posibile includ că SAA este o proteină cu reglare înaltă și rapidă; prin urmare, variația mare a SAA în studiul cu explant acut poate reflecta starea reală a dinamicii rapide a producției și secreției de SAA, precum și a SAA nou sintetizate în momentul biopsiei de grăsime. În plus, constatarea că la același individ, secreția SAA gluteală și abdominală se corelează bine pre și post-WL (Fig. 3), sugerează că mecanisme de reglare similare pot exista în cele două regiuni de grăsime ca răspuns la pierderea greutății corporale.
Pe scurt, aceste constatări arată că IMC și masa de grăsime sunt factorii determinanți ai nivelurilor circulante de SAA. Măsura generală a serului de scădere a SAA este comparabilă cu cea a pierderii în greutate cu și fără exerciții în cohortă, dar numai colectiv cu modificările din SAA se referă direct la reducerea masei grase. De asemenea, constatăm că țesutul adipos gluteal secretă
50% SAA mai mult decât țesutul adipos abdominal, iar acea secreție adiposă de SAA tinde să scadă după pierderea în greutate; cu toate acestea, numai reducerea secreției abdominale de SAA a fost corelată cu cea a SAA sistemică. Astfel, atât scăderea masei grase, cât și scăderea secreției de SAA adipos abdominal, împreună cu alți factori încă neidentificați, contribuie la reducerea nivelurilor sistemice de SAA după pierderea în greutate.
Ceea ce se știe deja despre acest subiect?
SAA este o adipokină și este considerată a fi o legătură între obezitate și bolile asociate acesteia.
- Intervenția dietetică personalizată evită pierderea de greutate neintenționată și modulează miARN-urile circulante
- CONTROLUL HIPERGLICEMIEI DIABETICII OBESEI PRIN REDUCEREA GREUTĂȚII Analele Medicinii Interne
- Efectul pierderii în greutate induse de dietă moderată și regăsirea greutății asupra structurii cardiovasculare și
- Demistificarea dietelor pentru slăbit Ecologia alimentelor și nutriției Vol. 45, nr. 5
- Efectul tratamentului cu olanzapină, risperidonă și haloperidol asupra greutății și indicelui de masă corporală în