David Jacobi
1 Departamentul de genetică și boli complexe; Departamentul de Nutriție; Divizia de Științe Biologice; Scoala de Sanatate Publica Harvard; Boston, MA SUA
2 CHRU de Tours; Serviciul de Medicină Nutriție Internă; Tours, Franța
3 INSERM U 921; Universitatea François Rabelais; Tours, Franța
Kristopher Stanya
1 Departamentul de genetică și boli complexe; Departamentul de Nutriție; Divizia de Științe Biologice; Scoala de Sanatate Publica Harvard; Boston, MA SUA
Chih-Hao Lee
1 Departamentul de genetică și boli complexe; Departamentul de Nutriție; Divizia de Științe Biologice; Scoala de Sanatate Publica Harvard; Boston, MA SUA
Abstract
În ultimii ani, s-a recunoscut că inflamația țesutului adipos alb este asociată cu obezitatea. Adipocitele și macrofagele asociate țesutului adipos (ATM) secretă molecule bioactive, inclusiv adipokine, chemokine/citokine și acizi grași liberi care modulează dezvoltarea inflamației de grad scăzut și a rezistenței la insulină, responsabile de bolile metabolice și cardiovasculare legate de obezitate. Receptorii nucleari, în special receptorii activați cu peroxizom-proliferator, sunt senzori ai lipidelor dietetice și controlează programele transcripționale ale căilor metabolice și inflamatorii cheie în adipocite și macrofage. Această revizuire se concentrează pe mecanismele prin care receptorii nucleari mențin homeostazia țesutului adipos alb. Va fi prezentată identificarea ATM-urilor ca jucători activi în inițierea inflamației cronice și a legăturilor dintre semnalizarea inflamatorie și disfuncția metabolică, urmată de discuția dovezilor recente pentru receptorii nucleari în funcția ATM, cu accent pe interacțiunea paracrină dintre adipocite și ATM-uri.
Introducere
Studiile au arătat că receptorii nucleari sunt puncte intracelulare de convergență pentru metabolism și inflamație. În ultimul deceniu, mai mulți receptori nucleari au fost identificați ca senzori pentru lipidele dietetice care reglează programele transcripționale ale căilor metabolice cheie. Descoperirile recente au evidențiat în continuare un rol pentru receptorii nucleari în fiziopatologia sindromului metabolic prin controlul funcției adipocite și activarea ATM. Această revizuire va discuta mecanismele prin care receptorii nucleari modulează semnalizarea WAT și modul în care activitățile receptorilor nucleari din WAT se raportează la complicațiile metabolice ale obezității. Va fi prezentat un raport despre legătura dintre inflamația cronică, ATM-urile și bolile metabolice, urmat de o discuție despre implicarea receptorilor nucleari în menținerea homeostaziei în cadrul WAT. De asemenea, vom revizui dovezile recente pentru receptorii nucleari în funcția ATM, concentrându-ne pe interacțiunea paracrină dintre adipocite și ATM-uri.
Țesutul adipos: o sursă importantă de inflamație metabolică
Dicotomia M1/M2 a macrofagelor de țesut adipos
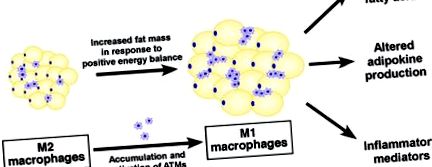
figura 1. Țesutul adipos alb și complicațiile metabolice ale obezității. În plus față de funcția sa de stocare a energiei, țesutul adipos este acum considerat un organ endocrin, producând molecule circulante, inclusiv adipokine (de exemplu, leptină și adiponectină), mediatori inflamatori (de exemplu, TNF-α, IL-6, IL-1β și MCP -1) și lipide bioactive (de exemplu, FFA) care au impacturi importante asupra homeostaziei metabolice. Neadaptarea adipocitelor ca răspuns la echilibrul energetic pozitiv cronic conduce la creșterea producției de chemokine/citokine pro-inflamatorii și eliberarea de FFA neesterificate, rezultând infiltrarea macrofagelor pro-inflamatorii (M1) și o schimbare a echilibrului între pro - și populații de macrofage antiinflamatoare (M2) din țesuturile adipoase albe. Această așa-numită „parainflamare” sau inflamație metabolică este asociată cu sindromul metabolic legat de obezitate.
Legături între inflamație și rezistența la insulină
Dovezile care susțin inducerea dependentă de semnalizare proinflamatorie a disfuncției metabolice au precedat înțelegerea interacțiunilor adipocite/macrofage. Există date care arată o corelație pozitivă între infiltrarea macrofagelor de grăsime viscerală și severitatea leziunilor hepatice la pacienții obezi. 24 de experimente knockout specifice în linia mieloidă oferă informații despre implicarea macrofagelor în anomaliile sindromului metabolic. Cu toate acestea, aceste studii nu au specificat contribuțiile ATM.
Suprimarea inflamației la obezitate îmbunătățește rezistența la insulină
Pierderea macrofagelor activate alternativ facilitează rezistența la insulină
Folosind modele de șoarece în care activarea alternativă a macrofagelor (M2) a fost afectată genetic, susceptibilitatea la obezitate indusă de dietă, steatoza hepatică, rezistența la insulină și intoleranța la glucoză au crescut. 33, 34 Vom discuta aceste studii mai detaliat mai jos.
Semnalizarea insulinei macrofage în inflamații și boli metabolice
Se crede că semnalizarea insulinei afectează funcția macrofagelor. Cu toate acestea, lipsesc cunoștințele mecaniciste în acest domeniu. Studiile au arătat că ștergerea genei Sorb1 care codifică proteina asociată Cbl (Cap), o moleculă implicată în absorbția de glucoză stimulată de insulină, protejează împotriva rezistenței la insulină indusă de dietă bogată în grăsimi și reduce inflamația. Fenotipul de sensibilitate la insulină ar putea fi transferat șoarecilor de tip sălbatic în urma unei diete bogate în grăsimi prin transplant de măduvă osoasă Sorb1 -/- 35, susținând un rol pentru semnalizarea insulinei macrofage în modularea sensibilității sistemice la insulină. Studiile asupra aterosclerozei cu receptor de insulină elimină macrofagele arată rezultate contradictorii. În fundalul șoarecilor knock-out ai receptorilor LDL, aceste macrofage prezintă o capacitate afectată de a trata apoptoza indusă de stresul ER, ducând la agravarea plăcilor aterosclerotice. 36 În schimb, receptorii de insulină și macrofagele apoE duble knockout au fost asociate cu mai puțină inflamație și cu leziuni aterosclerotice mai mici. 37
Originea inflamației metabolice în obezitate
Figura 2. Macrofagele țesutului adipos și originea inflamației metabolice. La obezitate, macrofagele rezidente ale țesutului adipos prezintă un fenotip M1/pro-inflamator. Acestea sunt activate fie de o inflamație cronică sistemică înainte de a intra în țesuturile adipoase, fie de mediatori inflamatori produși local. Din punct de vedere histologic, se vede că sunt concentrate în jurul celulelor adipoase pe moarte (insert, panoul superior). Aceste macrofage M1 produc citokine pro-inflamatorii (de exemplu, TNF-α și IL-1β) cunoscute pentru a induce disfuncții metabolice și rezistența la insulină în adipocite învecinate prin kinaze de semnalizare inflamatorie (de exemplu, JNK și IKK), creând un răspuns inflamator irezolvabil.
Receptoare nucleare cu sensibilitate lipidică în homeostazia țesutului adipos
Deși descoperirile discutate mai sus sugerează puternic o legătură între adipozitatea crescută, inflamația sistemică și rezistența la insulină prin activarea ATM-urilor, o întrebare critică fără răspuns este dacă activarea ATM poate fi modulată farmacologic. Deoarece anumiți receptori nucleari acționează ca senzori pentru grăsimile dietetice și sunt, de asemenea, implicați în reglarea inflamației, aceștia reprezintă ținte atractive care pot fi drogate pentru a controla inflamația metabolică și bolile asociate. Ne vom concentra pe membrii familiei receptorilor activați de proliferare a peroxizomilor (PPAR) care detectează acizi grași, deoarece sunt cunoscuți că reglează funcția adipocitelor și răspunsul imun al macrofagelor și, ca atare, joacă un rol important în homeostazia WAT.
Acțiunea transcripțională a receptorilor nucleari
Receptoare nucleare și funcția adipocitelor
Receptoare nucleare și activarea macrofagelor
Noțiunea că PPARγ este esențială pentru diferențierea adipocitelor a determinat investigarea unor funcții similare în alte tipuri de celule. Studiile timpurii au arătat că PPARγ a fost implicat într-o cale de semnalizare care controlează diferențierea în celulele monocitice, 75, 76, deși lucrările ulterioare folosind modele genetice ale șoarecilor PPARγ -/- au arătat că diferențierea macrofagelor nu depinde în mod critic de PPARγ. 77, 78 Aceste studii au inițiat un nou domeniu de cercetare care examinează efectele reglatoare ale receptorilor nucleari asupra inflamației. Știm acum că, pe lângă activitatea imuno-supresivă bine caracterizată a receptorului glucocorticoid, activarea mai multor receptori nucleari, în special PPAR și LXR, sunt capabili să moduleze activarea macrofagelor prin mai multe mecanisme anti-inflamatorii sau prin polarizarea Th2.
Mecanisme antiinflamatorii
Polarizarea Th2
Citokinele Th2, în special IL-4 și IL-13, mediază activarea M2. 26 Observația că atât nivelurile PPARγ, cât și PPARδ în macrofage sunt crescute de IL-4/IL-13 a inițiat o examinare mai atentă a rolului PPAR macrofagelor în modelele de șoarece de obezitate indusă de dietă. 33, 34, 92 - 95 În macrofag, activarea alternativă indusă de IL-4/IL-13 este asociată cu creșterea β-oxidării acizilor grași și a metabolismului oxidativ, programe care sunt controlate transcripțional de PPARγ și PPARδ. 33, 34, 94, 96, 97 În consecință, s-a arătat că PPARδ și PPARγ reglează expresia anumitor gene M2 și controlează activarea alternativă în macrofag. 33, 34, 93 Șoarecii cu deleție specifică mieloidă de PPARδ sau PPARγ prezintă M1 crescut și scăderea markerilor M2 în WAT și ficat. 33, 34, 92, 93, 98 De remarcat, într-un studiu separat, șoarecii lipsiți de PPARγ sau PPARδ în celulele hematopoietice nu au prezentat fenotipuri metabolice așteptate. 99 Interesant este că STAT6, un factor de transcripție Th2, a arătat că facilitează răspunsul PPARγ la IL-4 la nivel transcripțional în macrofage, efectul net fiind o creștere a numărului de gene reglate și a amplorii răspunsurilor. 100
Receptori nucleari în interacțiunea paracrină a macrofagelor rezidente ale țesutului adipos cu adipocite
Figura 4. Rolul PPAR-urilor în interacțiunea paracrină dintre adipocite și macrofage ale țesutului adipos. Ca senzori ai acizilor grași din dietă, PPAR joacă un rol important în menținerea homeostaziei țesutului adipos alb. În adipocite, activarea PPARγ reduce efluxul de acizi grași prin promovarea depozitării grăsimilor și creșterea producției de adiponectină, care îmbunătățește metabolismul sistemic al lipidelor și glucozei. În macrofag, PPAR-urile pot suprima răspunsurile inflamatorii prin mecanisme antiinflamatorii sau prin polarizarea Th2, ceea ce crește producția unei citokine antiinflamatorii, IL-10. Citokinele Th2 sunt produse local de multe tipuri de celule (eozinofile, limfocite T, mastocite și adipocite) pentru a activa factorii de transcripție din aval în macrofag, inclusiv STAT6 și PPARδ/PPARγ. Studiile au demonstrat că întreruperea căii paracrine IL-13-PPARδ duce la inflamația țesutului adipos alb și la rezistența la insulină, subliniind importanța semnalizării PPAR în controlul inițierii inflamației metabolice.
Concluzie
La nivel de semnalizare, procesele inflamatorii și metabolice sunt integrate și sunt legate de componentele bolilor metabolice. Modularea activităților receptorilor nucleari este o strategie terapeutică potențială pentru a restabili dezechilibrul semnalizării proinflamatorii și antiinflamatorii pentru prevenirea și/sau tratarea bolilor metabolice și cardiovasculare legate de obezitate, despre care se crede că sunt declanșate de inflamații cronice nerezolvate. De fapt, agoniștii PPAR sunt utilizați în prezent pentru a trata diabetul de tip 2 și dislipidemia. Cu toate acestea, efectele secundare ale liganzilor PPARγ în complicațiile cardiovasculare și-au limitat utilizarea. Studiile viitoare care vizează izolarea efectelor localizate ale PPAR în microambientul WAT, fie prin țintirea co-activatorilor/co-represorilor specifici țesuturilor sau identificarea modulatorilor sintetici selectivi, vor oferi noi oportunități terapeutice. Noile cunoștințe mecaniciste derivate din aceste studii vor ajuta, de asemenea, la definirea contribuțiilor relative ale semnalizării PPAR în adipocite sau celule imune în controlul inflamației metabolice și al bolilor asociate.
- Heterogenitatea țesutului adipos Implicarea diferențelor de depozit în țesutul adipos pentru obezitate
- Metabolismul țesutului adipos maro în arsenic sănătatea mediului și obezitatea - Ro - 2019 - The FASEB
- Hipoxia țesutului adipos în obezitate și impactul acesteia asupra diabetului de reglementare a adipocitokinelor
- Efectele benefice ale afinei în prevenirea obezității și a complicațiilor metabolice aferente
- Efectele benefice ale ghimbirului Zingiber officinale Roscoe asupra obezității și sindromului metabolic o recenzie