Harman D Kaur
1 Departamentul de Biofizică, Universitatea Panjab, Chandigarh 160014, India
Mohinder P Bansal
1 Departamentul de Biofizică, Universitatea Panjab, Chandigarh 160014, India
Abstract
fundal
Ateroscleroza este o tulburare cronică a peretelui arterial care începe prin formarea de dungi grase și evoluează treptat în plăci aterosclerotice. Nivelurile sanguine de lipoproteine cu densitate mare (HDL) sunt invers corelate cu ateroscleroza. Acest efect benefic al HDL a fost parțial atribuit proprietăților sale antioxidante mediate de paraoxonază1 (PON1) sau factorul activator de trombocite acetilhidrolază (PAF-AH). Prezentul studiu a vizat studierea enzimelor asociate HDL, adică PON1 și PAF-AH sub hipercolesterolemie experimentală și posibila lor modulare pe supliment de seleniu (Se; un antioxidant). Șobolanii masculi Sprague Dawley au fost împărțiți în trei grupuri și hrăniți cu dieta de control, dieta bogată în grăsimi (HFD) și respectiv HFD + Se pentru perioada de 4 luni.
Rezultate
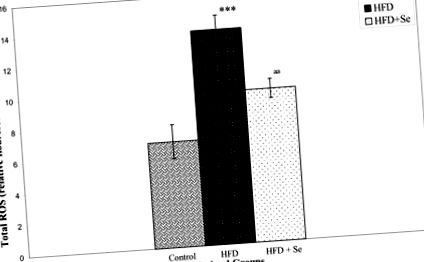
Nivelurile de colesterol, trigliceride, HDL și LDL au fost semnificativ crescute prin hrănirea HFD. Suplimentarea cu seleniu a scăzut nivelul trigliceridelor, în timp ce celelalte valori lipidice au rămas neschimbate. Nivelurile serice de seleniu au fost reduse cu 31%, iar nivelurile ROS în ficat au fost de două ori crescute cu HFD. Suplimentarea se, cu toate acestea, a diminuat nivelurile ROS induse de HFD cu 29%. Mai mult, Se a îmbunătățit, de asemenea, reducerea mediată de HFD a activității serice a enzimei PON1 cu 34% și a nivelurilor de proteine PON1 cu 21%. Cu toate acestea, nu a fost detectat niciun efect semnificativ al Se asupra nivelurilor reduse de proteine PAF-AH la șobolanii hrăniți cu HFD. Expresia ARNm a PON1 și PAF-AH în ficat nu a fost afectată în grupurile tratate cu Se.
Concluzie
Suplimentarea se pare a fi protectoare în hipercolesterolemie prin restabilirea proprietăților antioxidante ale enzimei asociate HDL, adică PON1, întrucât sistemul biologic vizează menținerea acelorași niveluri de PAF-AH chiar și pe suplimentarea cu seleniu, indicând rolul său probabil atât în activitățile anti, cât și în cele pro-aterogene. Prin urmare, suplimentarea ar putea fi o abordare valoroasă pentru a limita efectele adverse ale hipercolesterolemiei și poate necesita investigații suplimentare.
fundal
Hipercolesterolemia reprezintă unul dintre factorii de risc importanți și recunoscuți pentru ateroscleroză [1]. Există dovezi convingătoare care indică importanța tipului de grăsimi decât cantitatea totală de grăsimi în ceea ce privește riscul bolilor cardiovasculare [2]. Colesterolul este transportat în lipoproteine în fluxul sanguin. Nivelurile de colesterol cu lipoproteine de înaltă densitate (HDL) sunt invers legate de riscul apariției evenimentelor aterosclerotice [3] și se constată că posedă activitate anti-aterogenă [4]. Printre factorii de risc, raportul colesterol total/HDL este considerat cel mai predictiv pentru ateroscleroză [5]. Efectul protector al HDL este legat parțial de enzimele asociate cu HDL [6-8] și datorită participării sale la transportul invers al colesterolului [9].
Paraoxonaza 1 (PON1) este una dintre enzimele asociate cu HDL [10]. S-a demonstrat că PON1 protejează împotriva stresului oxidativ [11,12], fenomen care poate fi atribuit capacității sale de a modula lipidele oxidate în LDL și HDL [13,14], în macrofage [15,16] și, de asemenea, în plăcile aterosclerotice. [17]. PON este capabil să hidrolizeze peroxizii lipidici în LDL [18]. PON1 asociat HDL seric reduce stresul oxidativ în lipoproteine, în macrofage și în leziunea aterosclerotică, unde PON2 acționează ca un antioxidant la nivel celular și nu umoral. Atenuarea la ateroscleroză este legată de creșterea nutrițională indusă de anti-oxidativ a activității HDL-PON [19].
PAF-AH este enzima principală responsabilă de catabolismul lipidelor PAF și PAF, care sunt, de asemenea, mediatorii puternici ai inflamației [20,21]. Deficiența genetică de PAF-AH în populațiile umane definite crește severitatea aterosclerozei și a altor sindroame [22]. PAF-AH are o preferință marcată pentru fosfolipide cu porțiuni cu lanț scurt în poziția syn-2 și, cu excepția PAF, poate hidroliza în mod egal fosfolipide oxidate conținând în poziția syn-2 reziduuri de acil gras polinesaturate [23]. Cu toate acestea, în timpul hidrolizei fosfolipidelor oxidate, PAF-AH eliberează acizi grași liberi bioactivi [24] și generează lizofopsfatidilcolină, ambele fiind implicate în acțiunile biologice ale ox-LDL [25]. Astfel, PAF-AH ar putea juca atât roluri pro-aterogene, cât și roluri anti-aterogene.
Seleniul, un oligoelement esențial, este asociat cu boli cardiovasculare de ani de zile. Deficitul de seleniu este legat de creșterea nivelului de colesterol plasmatic [26,27], miopatia cardiacă [28], alte boli cardiovasculare și bolile ischemice ale inimii [29,30]. Suplimentarea cu seleniu duce la scăderea nivelului total de colesterol și trigliceride [31,32].
Ținând cont de acestea, în studiul actual influența seleniului a fost explorată asupra enzimelor asociate HDL, PON1 și PAF-AH.
Rezultate
Nivelurile de seleniu
A - expresie ARNm a PON1 și PAF-AH prin RT-PCR. B - Analiza densitometrică a expresiei ARNm PON1 și PAF-AH. Datele sunt reprezentate ca medie ± S.D. din patru observații independente. Datele sunt analizate statistic prin testul t al elevului.
Exprimarea proteinelor PON1 și PAF-AH de către ELISA
masa 2
Nivelurile PON1 și PAF-AH de către ELISA după 4 luni de control, programul de hrănire HFD și HFD + Se
| MON1 | 1,55 ± 0,13 | 1,06 ± 0,01 ** | 1,28 ± 0,12 a |
| PAF-AH | 0,26 ± 0,01 | 0,25 ± 0,01 * | 0,26 ± 0,01 |
Tabelul 3
Compoziția de control și dieta bogată în grăsimi (HFD):
| Amidon de porumb | 71.0 | 61,5 |
| Cazeină | 16.0 | 16.0 |
| Ulei de arahide | 8.0 | 0,0 |
| Ulei de cocos | 0,0 | 15.0 |
| Colesterol | 0,0 | 2.0 |
| Colat de sodiu | 0,0 | 0,5 |
| Amestec de sare | 4.0 | 4.0 |
| Amestec de vitamine | 1.0 | 1.0 |
| Perchlorat de potasiu | 0,0 | 25 mg/100 g B.W./rat/24 ore |
Animalelor din grupa III, adică Grupul HFD + Se, 1 ppm seleniu a fost dat ca selenit de sodiu și a fost administrat împreună cu dieta bogată în grăsimi. Seleniul a fost ales astfel încât nivelul este mai mare decât nivelurile adecvate de seleniu (0,2 ppm), dar mult sub limitele sub toxice (2,0 ppm).
Nivelurile de seleniu
Nivelurile de seleniu au fost estimate în ser prin metoda fluorimetrică [60]. Testul se bazează pe principiul conform căruia conținutul de Se în probe pentru digestia acidă este transformat în acid selenos. Reacția dintre acidul selenos și aromatic-o-diamine, cum ar fi 2, 3-diaminonapathalene, conduce la formarea de 4, 5-benzopiazselenol care prezintă o fluorescență strălucitoare verde-verde, atunci când este excitat la 366 nm în ciclohexan. Emisia de fluorescență în extractul de ciclohexan a fost citită pe spectrofotometrul de fluorescență folosind 366 nm ca excitație și 520 nm ca lungimi de undă de emisie.
Profilul lipidic
Analiza profilului lipidic s-a făcut în ser folosind truse colorimetrice pentru a estima nivelul colesterolului total, trigliceridelor, HDL, LDL. Nivelul colesterolului total a fost estimat folosind kitul bazat pe CHOP-PAP (Human Diagnostic Germany). Nivelurile de trigliceride au fost estimate folosind kitul bazat pe GPO (Accurex Biomedical India). Nivelurile de colesterol HDL și LDL au fost estimate folosind kitul enzimatic (Fortress direct kit).
Nivelurile speciilor reactive de oxigen (ROS)
Determinarea ROS s-a bazat pe metoda modificată a Driver et al [61]. Omogenatele hepatice au fost preparate în tampon Locke rece ca gheața (154 mM NaCI, 5,6 mM KCl, 3,6 mM NaHCO3, 2 mM CaCl2, 10 mM d-glucoză și 5 mM HEPES pH 7,4). Omogenatele au fost lăsate să se încălzească la 21 ° C timp de 5 minute. Amestecul de reacție conținând 10 μM DCFH-DA și 5 mg țesut/ml a fost incubat timp de 15 minute la temperatura camerei (21 ° C). După încă 30 de minute de incubație, conversia DCFH în produsul fluorescent 2, 7 dicloroflorescceină (DCF) a fost măsurată folosind un spectrofotometru de fluorescență cu excitație la 485 nm și emisie la 530 nm. Fluorescența de fond (conversia DCFH-DH în DCF în absența omogenatului) a fost corectată prin includerea de semifabricate paralele. Intensitatea relativă a fluorescenței a fost luată ca o măsură a cantității de ROS în diferite grupuri.
Măsurarea activității PON1
Activitatea PON1 a fost evaluată în ser prin măsurarea ratei inițiale de hidroliză a paraoxonului pentru a se obține p-nitrofenol la 412 nm la 25 ° C. Amestecul de analiză bazală a inclus 2 mM Paraoxon, 2 mM CaCI2 și 0,5 ml ser în tampon Tris/Cl 100 mM. Coeficientul de extincție pentru reacție este de 18290 M -1 cm -1. Activitatea este exprimată ca μM Paraoxon hidrolizat/mg proteină/min [62].
Izolarea ARN și expresia mARN a PON1 și PAF-AH utilizând RT-PCR
ARN-ul total a fost izolat din ficat proaspăt folosind Tri-reactiv (Molecular Research Center, Inc. Ohio, SUA) și calitatea ARN-ului izolat a fost verificată pe electroforeză pe gel de agaroză 1,2%. Pentru reacția în lanț a polimerazei cu transcriptază inversă (RT-PCR), primerii pentru PON1, PAF-AH au fost proiectați cu ajutorul software-ului și primerul β-actină a fost preluat din literatură. Exemplul de secvență pentru PON1 a fost Fav- 5'-TGGCATTGGCATTTCCCTTG-3 ', Rev-5'-CAGTAGCTTTCACTCCGGTAA-3' și pentru PAF-AH Fav- 5'-CTGATGACAAGACCCTCCGTG-3 ', Rev-5'-CCGATAGC Fav- 5'-AGAGCTATGAGCTGCCTGAC-3 ', Rev-3'-CTGCATCCTGTCAGCCTACG-5'. După experimentele pilot, s-a constatat că produsele PCR pentru PON1, PAF-AH au fost amplificate progresiv la 35 de cicluri și, prin urmare, au fost efectuate 35 de cicluri de amplificare. Reacția RT-PCR (kitul Qiagen) a folosit un șablon ADNc urmat de amplificare PCR cu ADN polimerază Accu Taq în același tub. Produsele PCR au fost analizate prin electroforeză cu gel de agaroză 1,5%. Analiza densitometrică din șase observații independente a fost realizată de software-ul Image-J.
Expresia proteinei PON1 și PAF-AH prin ELISA
Puțurile au fost acoperite cu 5 μg de probă pentru PON1 și PAF-AH în 100 μl de tampon carbonat 0,05 M (pH 9,6) și păstrate peste noapte la 4 ° C, într-o cameră umedă. Plăcile au fost rotite pentru a îndepărta soluția de antigen nelegată și godeurile au fost blocate cu 1% BSA în soluție salină tampon fosfat 0,1 M (pH 7,2) timp de 1 oră la 37 ° C. Plăcile au fost flick și godeurile au fost spălate cu 200 pl de PBS conținând 0,05% (v/v) Tween-20. Puțurile au fost apoi incubate cu anti-PON1 și respectiv anti-PAF-AH, diluate în PBS (conținând 0,05% Tween și 1% BSA) și păstrate timp de 2 ore la 37 ° C. Plăcile au fost spălate din nou și incubate cu anticorp secundar anti-capră (marcat cu peroxidază) pentru PON1 (1: 1000) și PAF-AH (1: 1000) timp de 2 ore la 37 ° C. Puțurile au fost spălate în continuare de trei ori așa cum s-a descris mai sus și culoarea a fost dezvoltată prin adăugarea reactivului acidului 2, 2'-azino-di (3-etil) -benzotiozolinsulfonic și absorbția la 405 nm a fost măsurată de cititorul ELISA.
Analize statistice
Datele sunt reprezentate ca medie ± S.D. Analiza statistică a datelor a fost efectuată prin testul T al elevului.
Abrevieri
A260: Absorbție la 260 nm; A412: Absorbție la 412 nm; B.W: Greutatea corpului; LCAT: Lecitină colesterol acil transferază; LDL: lipoproteine cu densitate scăzută; OD: Densitate optică; oxLDL: Lipoproteină oxidată cu densitate scăzută; PAF: Factor de activare a trombocitelor; PAF-AH: Factor activator de trombocite-Acetil hidrolaza; PON1: Paraoxonază1; Se: Seleniu; SRB1: Receptorul Scavenger B (clasa) 1 (tip); VLDL: Lipoproteine cu densitate foarte mică.
Interese concurente
Autorii declară că nu au interese concurente.
Contribuțiile autorilor
MPB a proiectat studiul și a participat la elaborarea manuscrisului și a analizei rezultatelor. HDK a efectuat toate lucrările experimentale, a participat la analiza statistică și la elaborarea manuscrisului sub îndrumarea MPB. Toți autorii au citit și au aprobat manuscrisul final.
Mulțumiri
Autorii recunosc sprijinul acordat de Director: Prof. Tapas Mukhopadhyay (Departamentul de Genomică Umană, Universitatea Panjab, Chandigarh, 160014 India) pentru utilizarea diferitelor echipamente.
- Creșterile legate de obezitate ale leucinei plasmatice sunt asociate cu modificări ale enzimelor implicate în
- Factorii de risc asociați cu excesul de greutate și obezitatea caninului într-un studiu bioRxiv raportat de proprietar
- Omiterea micului dejun asociat cu întărirea arterelor - Colegiul American de Cardiologie
- Obezitatea și rezultatul chirurgiei fistulei perianale asociate cu Crohn Un studiu de caz-control
- Proteina tirozin fosfatază 1B este o nouă țintă pentru tratamentul obezității și asociate