Subiecte
Abstract
Introducere
În special, părtinirea celulelor T care se infiltrează în ficat, împreună cu citokinele lor secretate, joacă un rol esențial în inflamația și progresia NASH 7. Între timp, microbiota intestinală joacă un rol esențial în menținerea homeostaziei sistemului imunitar adaptativ și reglează funcțiile celulelor T, care pot fi parțial atribuite metaboliților precum acizii grași cu lanț scurt (SCFA) 8,9,10. Astfel, am efectuat această explorare și am emis ipoteza că FMT va îmbunătăți ecosistemele microbiotei gastrointestinale, va regla metaboliții intestinali, cum ar fi acizii grași cu lanț scurt și va corecta dezechilibrul sistemului imunitar al ficatului, ducând la atenuarea dietei bogate în grăsimi (HFD) indusă steatohepatită și șoareci.
Materiale și metode
Experimente pe animale
Șoarecii C57BL/6 de sex masculin fără patogeni specifici (SPF) (SLAC animal co. De laborator, LTD, Shanghai, China) au fost adăpostiți în cuști cu eficiență ridicată, filtrate cu aer, cu așternut sterilizat și hrănite cu chow și apă autoclavizate ad libitum. Toate experimentele pe animale au fost aprobate de Comitetul instituțional de îngrijire și utilizare a animalelor din spitalul Xinhua, care este afiliat la Școala de Medicină a Universității Shanghai Jiao Tong și toate experimentele au fost efectuate în conformitate cu Ghidul Consiliului Național de Cercetare pentru Îngrijirea și Utilizarea Animalelor de Laborator.
Șoarecii au fost împărțiți în mod aleatoriu în trei grupuri (12 șoareci per grup). Grupul de control a fost alimentat cu chow standard timp de 16 săptămâni. Grupul HFD a fost hrănit cu HFD (88% dietă standard, 10% untură de porc și 2% colesterol) timp de 16 săptămâni. Grupul HFD + FMT a fost alimentat cu HFD timp de 16 săptămâni și tratat cu FMT în ultimele 8 săptămâni. Toți șoarecii au primit o combinație de penicilină (2000 U/ml) și streptomicină (2 mg/ml) (Sigma Aldrich, SUA) în apa de băut timp de 3 zile pentru a elimina microorganismele intestinale indigene. După acest tratament, 200 mg de scaun proaspăt au fost colectate din grupul de control imediat după defecare și au fost resuspendate în 5 ml de soluție salină normală, vortexate timp de 3 minute și lăsate să se stabilească prin gravitație timp de 2 minute, iar scaunul proaspăt a fost colectat în fiecare zi . Transplantul în șoareci primiți a fost realizat prin gavaj cu 200 μl de supernatant din proba fecală o dată pe zi timp de 8 săptămâni 11 .
Fiecare șoarece a fost cântărit o dată pe săptămână și s-a calculat consumul săptămânal de alimente pe șoarece pentru diferitele grupuri. Șoarecii au fost sacrificați după 16 săptămâni, iar sângele de post din inimă a fost colectat. Țesutul hepatic, intestinul subțire, conținutul cecal și țesutul adipos epididimal de la fiecare șoarece au fost fie fixate într-o soluție de paraformaldehidă de 4%, congelate în gel de temperatură optimă de tăiere, fie congelate în azot lichid și depozitate la -80 ° C.
Analiza microbiană a fecalelor
Analize serice
Alanina aminotransferază (ALT), aspartatul aminotransferază (AST) și glucoza din sânge (FBG) au fost măsurate folosind un analizor automat (Sysmex CHEMIX-180, Japonia). Insulina serică (Kit ELISA pentru șobolani/șoareci, Merck-Millipore) a fost măsurată printr-un test imunosorbent legat de enzimă, concentrația de endotoxină de șoarece în ser a fost măsurată prin test imunosorbent legat de enzimă (Kit ET ELISA Mouse ET, Trust Speciality Zeal) și probe iar standardele au fost prelucrate conform instrucțiunilor producătorului. Evaluarea modelului de homeostazie a rezistenței la insulină (HOMA-IR) a fost calculată prin ecuația: FBG (mmol/L) × insulină (mU/L)/22,5. Indicele de sensibilitate la insulină (ISI) a fost calculat prin ecuația: 1/(FPG (mmol/L) × insulină (mU/L)).
Măsurători ale trigliceridelor și colesterolului în ficat
Trigliceridele intrahepatice (TG) și colesterolul au fost măsurate printr-un kit de testare a trigliceridelor sau un set de testare a colesterolului (Applygen Technologies Inc., Beijing, China). Probele și standardele au fost apoi prelucrate conform instrucțiunilor producătorului. Concentrațiile finale de trigliceride și colesterol au fost corectate pentru conținutul de proteine.
Analiza histologică
Secțiunile de parafină fixate în paraformaldehidă ale ficatului și intestinului subțire au fost colorate cu hematoxilină - eozină pentru analiză patologică sau cu colorare tricromă Masson pentru fibroză. Scorul de activitate a ficatului gras nealcoolic (NAS) a fost evaluat și secțiunile de ficat înghețate au fost colorate cu roșu ulei O. Pentru colorarea imumohistochimică, au fost utilizate secțiuni încorporate în parafină. S-a aplicat anticorp secundar conjugat cu peroxidază de hrean și reacția a fost vizualizată de tetrahidroclorură de 3, 3'-diaminobenzidină. Diapozitivele au fost contracolorate cu hematoxilină. Zonele pozitive au fost cuantificate cu imaginea J2x. Anticorpii anti-Foxp3 și anti-ZO-1 au fost cumpărați de la Abcam (MA, SUA), iar IFN-γ, IL-4, IL-17 și IL-22 au fost achiziționați de la Bioworld (MN, SUA).
Reacție în lanț cantitativă în timp real a polimerazei (qPCR)
ARN-ul total a fost extras din ficat, intestin subțire sau grăsime epididimală folosind Trizol (D9108B, Takara, Dalian, China) și a fost transcris invers în ADNc folosind Primescript RT Master Mix (RR036A, Takara, Dalian, China). QPCR în timp real a fost efectuat pe un sistem PCR în timp real Applied Biosystems 7500 folosind SYBR Premix Ex Taq (Tli RnaseH Plus) (RR420A, Takara, Dalian, China). Grundele pentru genele țintă au fost sintetizate de Sangon Biotech (Shanghai, China). Secvențele primare pentru gene sunt enumerate în tabelul suplimentar 1. Specificitatea primerului a fost confirmată printr-o curbă de disociere utilizând software-ul SDS al sistemului 7500. Gliceraldehidă 3-fosfat dehidrogenază (GAPDH) a fost utilizată ca control intern.
Analiza Western blot
Ficatii au fost lizați în tampon de testare a imunoprecipitării la rece ca gheața (RIPA) care conține inhibitori de protează și fosfatază (fluorură de fenilmetilsulfonil, PMSF) (Beyotime, Shanghai, China). Proteina totală a fost măsurată prin metoda de analiză a proteinelor acidului bicinchoninic (BCA, Beyotime, Shanghai, China). Foxp3, IFN-γ, IL-4, IL-17, IL-22 și receptorul de insulină (IR, Abcam) din ficat au fost detectate și actina a fost utilizată ca control al încărcării. Complexe imune au fost detectate folosind substrat imobilon western chemiluminescent HRP (Millipore Corporation, Billerica, MA). Benzile au fost cuantificate prin Image Lab versiunea 2.0.1 (Bio-Rad, Hercules, CA).
Cuantificarea acizilor grași cu lanț scurt de conținut de cecal
Pentru a determina nivelul SCFA, s-a efectuat cromatografia lichidă de înaltă presiune (HPLC, Agilent 1200, Wilmington, DE, SUA). Pe scurt, soluțiile standard de acetat, propionat și butirat (toate de la Sigma-Aldrich) au fost preparate la diferite concentrații (3-6000 ng/ml). Aceste soluții au fost analizate utilizând HPLC, iar conținutul de cecal a fost dizolvat în acid formic 0,1% și analizat în mod similar pentru a măsura concentrația totală a tuturor celor trei acizi grași liberi 11 .
analize statistice
Rezultatele sunt prezentate ca medie cu eroarea standard de medie (SEM). Prisma Graph Pad (versiunea 6.01) a fost utilizată pentru efectuarea tuturor testelor statistice. Comparațiile au fost efectuate utilizând o analiză unidirecțională a testului de varianță (ANOVA) și au fost efectuate analize post hoc Student - Newman - Kuels atunci când> 2 grupuri. Rezultatele au fost considerate semnificative statistic atunci când p
Rezultate
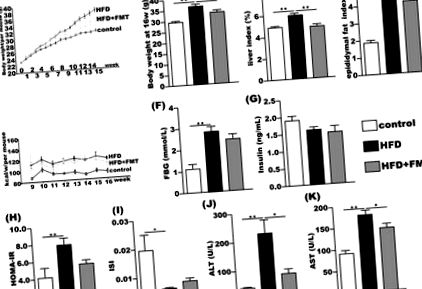
Efectele FMT asupra greutății corporale, HOMA-IR și transaminazelor serice
După 16 săptămâni de experiment, șoarecii din grupul HFD au câștigat mai multă greutate corporală decât grupul martor. Indicele hepatic și indicele de grăsime epididimală au crescut semnificativ cu 20%, respectiv 125%, comparativ cu grupul martor. După 8 săptămâni de intervenție FMT, greutatea corporală, indicele hepatic și indicele de grăsime epididimală în grupul HFD + FMT au fost semnificativ reduse comparativ cu cele din grupul HFD (Fig. 1A - D). Cu toate acestea, aportul săptămânal de energie nu a arătat nicio diferență semnificativă între grupurile HFD și HFD + FMT (Fig. 1E). FBG a fost semnificativ crescut în grupul HFD comparativ cu grupul martor, dar nu a prezentat nicio diferență semnificativă între grupul HFD și HFD + FMT (Fig. 1F). Nivelul insulinei serice nu a fost modificat semnificativ în rândul celor trei grupuri (Fig. 1G). HOMA-IR a crescut și ISI a scăzut în grupul HFD comparativ cu cele din grupul de control, dar HOMA-IR și ISI nu au fost îmbunătățite semnificativ în grupul HFD + FMT în comparație cu grupul HFD (Fig. 1H, Eu). Nivelurile serice de ALT și AST au fost semnificativ crescute în grupul cu HFD comparativ cu grupul de control și au scăzut semnificativ după intervenția de 8 săptămâni a FMT (Fig. 1J, K).
Îmbunătățirea FMT asupra microbiotei intestinale și creșterea concentrațiilor de butirat ale conținutului cecal
Pentru a dezvălui efectele HFD și FMT asupra structurii microbiotei, am secvențiat ARNr 16S bacterian la momentul inițial și după 16 săptămâni. Au fost efectuate analize PCoA, PCoA și NMDS neponderate pentru a oferi o imagine de ansamblu asupra compoziției microbiotei intestinale a celor șase grupuri de animale la momentul inițial și la sfârșitul studiului. Scorurile reprezentate grafic nu au indicat nicio diferență detectabilă în compoziția microbiotei dintre grupuri înainte de intervenție, dar au separat în mod clar șoarecii 16w-HFD de șoarecii martor 16w, cu grupul 16w-HFD + FMT distribuit între. Acest lucru a indicat faptul că intervenția FMT a deplasat structura generală a microbiotei intestinale afectate de HFD către cea a șoarecilor martor (Fig. 2A - C). Mai mult, analiza ierarhică a clusterului a arătat că comunitățile de control 1w, 1w-HFD, 1w-HFD + FMT și comunitățile de control 16w grupate împreună și apoi grupate cu comunitățile 16w-HFD + FMT și 16w-HFD în ordine (Fig. . 2D).
Șaisprezece săptămâni de hrănire cu HFD au indus modificări pe scară largă în structura comunității microbiene intestinale la nivel de filum comparativ cu martorul. A existat o creștere a abundenței de bacteroidete (63,1%) vs.. 52,9%) și scade abundența Actinobacteriei (0,04%) vs.. 0,15%) și Firmicutes (35,8%) vs.. 44,6%). Cu toate acestea, intervenția FMT a atenuat creșterea indusă de HFD în Actinobacteria și Firmicutes și creșterea indusă de HFD în Bacteroidetes. La nivel de gen, Lactobacillus, Christensenellaceae_uncultură, Prevotellaceae_uncultură au fost scăzute în grupul HFD comparativ cu controlul, toate acestea fiind inversate prin intervenția FMT. Intervenția FMT a scăzut abundența de Odoribacter și Oscilibacter comparativ cu grupul HFD (Fig. 2E, F). Analiza LefSe a arătat, de asemenea, că intervenția FMT a fost asociată cu modificări la nivelul genului (Fig. 2G, H).
Concentrațiile de acetat și propionat din conținutul de cecal nu au prezentat diferențe între cele trei grupuri (Fig. 2I, J). Concentrația de butirat în conținutul cecal nu a arătat nicio diferență între grupul martor și grupul HFD, dar a fost semnificativ crescută în grupul HFD + FMT (Fig. 2K).
Intervenția FMT a îmbunătățit joncțiunea strânsă și morfometria intestinului subțire și endotoxemia
Colorarea HE a arătat că leziunea mucoasei intestinale indusă de HFD a fost ameliorată prin intervenția FMT (Fig. 3A). Imunohistochimia și qPCR au demonstrat că expresia ZO-1 în intestinul subțire a fost semnificativ crescută după intervenția FMT comparativ cu grupul HFD (Fig. 3B, C). În plus, nivelul seric al endotoxinei a fost semnificativ crescut în grupul HFD, dar a fost redus după intervenția FMT (Fig. 3D).
Tratamentul FMT steatohepatita indusă de HFD atenuată
Incidența steatohepatitei indusă de hrănirea cronică cu HFD a fost de 100% în grupul cu HFD. Colorarea hepatică HE a arătat că grupul martor nu a acumulat lipide și s-a observat o acumulare marcată de lipide în grupul HFD, care a fost atenuat semnificativ prin tratamentul cu FMT (Fig. 4A). Acest rezultat a fost confirmat în continuare de colorarea cu roșu ulei O (Fig. 4B). Scorul mediu NAS al ficatului a fost de 6,90 ± 0,233 în grupul HFD și a fost redus la 4,58 ± 0,260 după intervenția FMT (Fig. 4C). Conținutul de TG intrahepatic și colesterol a fost crescut de aproximativ de 4 ori respectiv de 17 ori, în grupul HFD, comparativ cu grupul martor. Această creștere a fost redusă semnificativ după intervenția FMT (Fig. 4D, E). PPAR-α mARN în ficat a crescut de două ori după HFD în comparație cu grupul martor, dar a fost scăzut prin intervenția FMT. Nu a existat nicio diferență în mARN-ul PPAR-y hepatic între grupurile HFD și grupul martor, dar a crescut semnificativ în grupul HFD + FMT (Fig. 4F).
Deși colorarea cu ficat a lui Masson nu a prezentat fibroză la toate cele trei grupuri (Fig. 4G), nivelurile de ARNm ale genelor asociate fibrozei din ficat, cum ar fi TGF-β1, α-SMA, Smad7 și Smad2, au crescut de două ori mai mult în grupul HFD decât grupul control, în timp ce intervenția FMT a redus expresia acestor gene în ficat (Fig. 4H). TLR4 hepatic și Myd88 mARN au fost, de asemenea, crescute semnificativ în grupul HFD comparativ cu grupul martor și au fost suprimate prin intervenția FMT (Fig. 4H). Iar nivelul proteic al receptorului de insulină din ficat a crescut semnificativ după intervenția FMT comparativ cu grupul HFD (Fig. 4I, J).
Efectul FMT asupra imunității intrahepatice
Nivelurile de ARNm de TNF-α, MCP-1, IL-1β, IL-2 și IL-6 în ficat au fost reglate în sus în grupul HFD comparativ cu grupul martor, toate acestea fiind reduse prin intervenția FMT (Fig. 5A ).
Comparativ cu grupul de control, nivelurile de proteine hepatice ale Foxp3, IL-4 și IL-22 din grupul HFD au fost semnificativ scăzute și expresiile IFN-γ și IL-17 au fost semnificativ crescute. Intervenția FMT a inversat în mod eficient acești factori imuni dezechilibrați, care au crescut nivelurile de Foxp3, IL-4 și IL-22 și au scăzut IFN-γ și IL-17 în ficat (Fig. 5B, C).
Expresiile Foxp3, IFN-γ, IL-4, IL-17 și IL-22 în ficat au fost, de asemenea, detectate prin colorare imumohistochimică. Rezultatele au arătat că Foxp3, IL-4 și IL-22 au scăzut, în timp ce IFN-γ și IL-17 au fost relativ crescute în grupul HFD comparativ cu grupul de control. Acest lucru a fost inversat prin intervenția FMT (Fig. 5D - I).
Efectul FMT asupra țesutului adipos epididimal
ARNm-urile PPAR-α și PPAR-γ din țesutul adipos epididimal au fost semnificativ reglate în jos în grupul HFD comparativ cu grupul martor și semnificativ reglate în sus după intervenția FMT (Fig. 6A). Mai mult, nivelurile de mARN de TNF-α și MCP-1 în țesutul adipos epididimal au fost crescute în grupul HFD comparativ cu grupul martor, care au fost suprimate prin intervenția FMT (Fig. 6B).
Discuţie
În acest studiu, am demonstrat că microbiota intestinală și profilurile de citokine intrahepatice la șoareci au fost perturbate semnificativ de HFD de 16 săptămâni. Cu toate acestea, intervenția FMT de 8 săptămâni a corectat perturbarea microbiotei intestinale într-un anumit grad și a crescut producția de butirat în conținutul de cecal, împreună cu corectarea dezechilibrului citokinelor pro și antiinflamatoare și inversarea steatohepatitei la șoareci hrăniți cronic. cu HFD. Aceste rezultate au indicat faptul că FMT poate avea implicații profunde în tratamentul NASH.
Studiul nostru are următoarele limitări. În primul rând, nu am efectuat o analiză metabolomică a conținutului cecal. Această analiză ar fi utilă pentru a elucida influențele FMT asupra șoarecilor. În al doilea rând, am efectuat doar secvențierea ARNr de 16s a microbiotei intestinale. Secvențierea întregului genom ar fi mai precisă pentru găsirea interacțiunilor interne din perspectiva funcției genetice.
Pe scurt, rezultatele noastre au arătat că FMT a atenuat steatohepatita indusă de HFD la șoareci. până în prezent, pacienții care suferă FMT sunt în principal prin endoscopie, deci este imposibil să se efectueze FMT pe o frecvență ridicată. Rezultatul nostru susține o posibilă modalitate de FMT orală prin metode mai economice și mai convenabile, cum ar fi capsulele fecale, care este în curs de investigare la om. Ar trebui luată în considerare dezvoltarea unor strategii terapeutice orientate către microbiomi pentru a deschide ușa către noi modalități de prevenire și tratament al NASH.
Referințe
Rinella, M. E. Boală hepatică grasă nealcoolică. Peşteră 313(2263), 5370–73, doi: 10.1001/pit.2015.5370 (2015).
Gkolfakis, P., Dimitriadis, G. și Triantafyllou, K. Microbiota intestinală și boala hepatică grasă nealcoolică. Boli hepatobiliare și pancreatice internaționale 14, 572-581 (2015).
- Degradarea variabilă a cartilajului la șoareci cu disfuncție metabolică indusă de dietă, pentru gândire -
- Dermatita ulcerativă la șoarecii C57BL6NCrl pe o dietă cu conținut scăzut de grăsimi sau cu conținut ridicat de grăsimi, cu sau fără
- Efectele anti-obezitate ale Tongbi-san într-un model de șoarece obez indus de o dietă bogată în grăsimi, model BMC
- Ce mănâncă șoarecii de câmp Aflați obiceiurile alimentare ale șoarecelui de câmp
- Ce mănâncă șoarecii Diete de șoarece Terminix