Abstract
fundal
Recent, s-a observat că medicamentele pe bază de plante naturale pot fi eficiente în tratarea obezității. Tongbi-san (TBS) este un medicament tradițional utilizat de obicei pentru disurie (adică urinarea dureroasă), conținând trei plante medicinale, Cyperus rotundus L., Citrus unshiu Markovich și Poria cocos. În acest studiu, ne-am propus să examinăm dacă TBS poate inhiba adipogeneza indusă de dieta bogată în grăsimi (HFD) în ficat și țesutul adipos epididimal al șoarecilor obezi.
Metode
Șoarecii masculi C57BL/6 N au fost hrăniți cu o dietă normală, un HFD, un HFD plus orlistat 10 sau 20 mg/kg sau un HFD plus TBS 50 sau 100 mg/kg timp de 11 săptămâni. Greutatea corporală a fost verificată săptămânal și s-au investigat examinările histologice ale țesuturilor. De asemenea, a fost evaluată o expresie a genelor implicate în adipogeneză.
Rezultate
Administrarea orală de TBS a redus semnificativ greutatea corporală și a scăzut greutatea țesutului adipos alb epididimal și visceral (WAT). În plus, am constatat că TBS a îmbunătățit expresia protein kinazei activate cu adenozină monofosfat (AMPK) și a inhibat expresia factorilor de transcripție, cum ar fi CCAAT/proteinele care leagă amplificatorul (C/EBPs), proteina 1 care leagă elementul de reglare a sterolului ( SREBP1) și receptorul activat de proliferatorul peroxizomului γ (PPARγ) în ficat și epididimal WAT măsurat prin reacție în lanț cantitativă a polimerazei cu transcripție inversă (qRT-PCR).
Concluzie
Aceste descoperiri demonstrează că efectele anti-obezitate ale TBS pot fi legate de activarea AMPK.
fundal
Obezitatea se caracterizează printr-o creștere excesivă a masei țesutului adipos și devine rapid o problemă de sănătate publică care afectează milioane de oameni din întreaga lume [1]. Țesutul adipos a fost considerat a fi un regulator principal al homeostaziei energetice [2]. Datorită unui dezechilibru între consumul și consumul de energie, obezitatea dă naștere unei creșteri excesive și a expansiunii țesutului adipos [3]. Țesutul adipos alb (WAT) este un organ endocrin complex compus din diferite depozite, inclusiv depozite WAT subcutanate (de exemplu, inghinale) și intra-abdominale (de exemplu, epididimale și mezenterice) [4]. WAT este extins în mod corespunzător pentru a stoca surplusul de energie, cu toate acestea, în timpul obezității, acesta poate deveni grav disfuncțional și poate eșua pentru aceste funcții. Expansiunea WAT nesănătoasă a fost corelată cu numeroase rezultate dăunătoare, cum ar fi inflamația, hipoxia, fibroza și funcția mitocondrială perturbată [5]. Astfel, inhibarea măririi țesutului adipos poate fi o țintă importantă pentru a preveni și trata obezitatea.
Procesul prin care sunt generate adipocitele mature, adipogeneza, este foarte reglementat de factori transcripționali, inclusiv CCAAT/proteina de legare a amplificatorului α (C/EBPα), receptorul activat proliferator al peroxizomului γ (PPARγ) și proteina 1 de legare a elementului de reglare a sterolului (SREBP1 ) [6, 7]. PPARγ este exprimat în mod specific în țesutul adipos și acționează ca un regulator principal în diferențierea adipocitelor și metabolismul glucozei [8]. C/EBPα este puternic exprimat în țesutul adipos și ficatul atât al rozătoarelor, cât și al oamenilor [9] și s-a raportat că șoarecii knock-out C/EBPα se avortează pentru a acumula lipide în adipocite [10]. SREBP ajustează expresia multor enzime implicate în sinteza colesterolului, acizilor grași, triacilglicerolilor și fosfolipidelor. În consecință, SREBP reglează lipogeneza celulară și homeostazia lipidelor [11]. SREBP-urile sunt împărțite în trei izoforme: SREBP-1a, SREBP-1c și SREBP2 [12]. SREBP-1 controlează în principal expresia genelor implicate în metabolismul acizilor grași și triacilglicerolului, în timp ce SREBP-2 reglează în principal metabolismul colesterolului [13].
Protein kinaza activată cu adenozină monofosfat (AMPK) este un senzor principal de energie, definit ca o proteină kinază activată printr-o creștere a raportului de energie AMP/ATP [14]. AMPK este, de asemenea, o enzimă heterotrimerică care joacă un rol principal în homeostazia energetică a țesutului adipos [15] și este asociată cu reglarea C/EBPα și PPARγ [16]. În plus, SREBP1 este, de asemenea, reglementat negativ de AMPK [17]. În consecință, este probabil ca expresia AMPK să fie o țintă latentă a genei pentru suprimarea adipogenezei. În acest studiu, am emis ipoteza că activarea AMPK poate juca un rol decisiv într-un model de șoarece indus de o dietă bogată în grăsimi (HFD) prin inhibarea C/EBPα, PPARγ și SREBP1, suprimând astfel adipogeneza.
Metode
Substanțe chimice și reactivi
TBS constă din C. rotundus L., C. unshiu Markovich și Poria cocos. Cele trei plante au fost cumpărate de la Nanum Pharmaceutical Company (Seul, Republica Coreea). Probele de plante au fost efectuate pentru testul senzorial în conformitate cu „The Korean Herbal Pharmacopeea” de Prof. Yun-Yeop Cha și doar cele care au trecut standardul coreean de farmacopee au fost selectate și utilizate pentru acest experiment. TBS a fost realizat folosind un raport 1: 1: 1 al acestor plante (400 g fiecare). Ierburile au fost apoi extrase în apă la 99 ° C timp de 3 ore. Extractul a fost liofilizat, iar rata randamentului a fost calculată la 33,20% (33,20 g la 100 g de extract lichid). Pulberea a fost dizolvată în apă distilată pentru acest experiment, iar pulberea reziduală a fost depozitată la - 20 ° C. HFD de 30% a fost obținut de la Research Diets (New Brunswick, NJ, SUA). Anticorpii p-AMPK și AMPK au fost obținuți de la Cell Signaling Technology (Danvers, MA, SUA). Primii oligonucleotidici PPARγ, C/EBPα, SREBP1, AMPK și gliceraldehidă-3-fosfat dehidrogenază (GAPDH) au fost achiziționați de la Bioneer Corporation (Daejeon, Republica Coreea), iar SYBR Premix Ex Taq a fost achiziționat de la Takara Bio Inc. (Otsu, Japonia). Orlistat a fost achiziționat de Tokyo Chemical Industry Co. Ltd. (Tokyo, Japonia) și alți reactivi au fost cumpărați de la Sigma-Aldrich Co. LLC (St. Louis, MO, SUA).
Modelul de șoarece obezitate indusă de HFD
Analiza serului
La sfârșitul fiecărui experiment, probele de sânge ale șoarecilor tratați au fost colectate și centrifugate la 1000 ×g timp de 20 min. Concentrația serică colectată a fost utilizată pentru a determina colesterolul total (TC), azotul uree din sânge (BUN), aspartat aminotransferaza (AST) și alanina aminotransferaza (ALT) utilizând metode enzimatice din kiturile disponibile comercial (BioVision; Milpitas, CA, SUA).
Analiza histologică
Ficatul și țesutul adipos epididimal de la un șoarece reprezentativ din fiecare grup au fost fixate în formalină tamponată 10%, încorporate în parafină și tăiate în secțiuni groase de 8 μm. Unele secțiuni au fost colorate cu hematoxilină și eozină (H&E) pentru examinarea histologică a picăturilor de lipide și imaginile au fost obținute cu ajutorul unui microscop Olympus SZX10 (Tokyo, Japonia).
Analiza Western blot
Segmente de ficat sau țesut adipos epididimal au fost suspendate în soluția de extracție a proteinelor PRO-PREP ™ (Intron Biotechnology, Seoul, Republica Coreea) și incubate timp de 20 de minute la 4 ° C. Resturile celulare au fost îndepărtate prin micro-centrifugare, urmată de înghețarea rapidă a supernatantului. Concentrația de proteine a fost determinată utilizând reactivul de testare a proteinelor Bio-Rad (Bio-Rad, Hercules, CA, SUA) conform instrucțiunilor producătorului. Proteinele celulare din extracte de celule tratate și netratate au fost electroblotate pe o membrană de fluorură de poliviniliden după separare prin 10-12% SDS-PAGE. Blotul a fost incubat timp de 1 oră cu soluție de blocare (lapte degresat 5%) la temperatura camerei, urmată de incubare peste noapte cu anticorp primar (1: 1000) la 4 ° C. Bloturile au fost spălate de trei ori cu soluție salină tamponată Tween 20/Tris (T/TBS) și incubate cu anticorp secundar conjugat cu peroxidază de hrean (1: 2000) timp de 2 ore la temperatura camerei. Bloturile au fost din nou spălate de trei ori cu T/TBS și apoi dezvoltate prin chemiluminescență îmbunătățită (GE Healthcare, Waukesha, WI, SUA). Analiza densitometrică a fost efectuată utilizând software-ul Bio-Rad Quantity One.
Analiza cantitativă în timp real a reacției în lanț a polimerazei (qRT-PCR)
Ficatul și epididimul WAT au fost omogenizate, iar ARN-ul total a fost izolat folosind reactivul Easy-Blue® conform instrucțiunilor producătorului (Intron Biotechnology; Seongnam, Republica Coreea). ADNc a fost sintetizat conform unei proceduri raportate anterior [22]. Primerii oligonucleotidici pentru PPARγ de șoarece au fost ATCGAGTGCCGAGTCTGTGG (înainte) și GCAAGGCACTTCTGAAACCG (invers); pentru C/EBPα de șoarece au fost GGAACTTGAAGCACAATCGATC (înainte) și TGGTTTAGCATAGACGTGCACA (invers); pentru mouse-ul SREBP1 au fost ATCGCAAACAAGCTGACCTG (înainte) și AGATCCAGGTTTGGGTGGG (invers); pentru mouse-ul AMPK au fost GGTGGATTCCCAAAAGTGCT (înainte) și AAGCAGTGCTGGGTCACAAG (invers); pentru mouse-ul GAPDH au fost GACGGCCGCATCTTCTTGT (înainte) și CACACCGACCTTCACCATTTT (invers). Expresia genică a fost calculată conform metodei ciclului de prag comparativ (Ct).
analize statistice
Fiecare rezultat este exprimat ca medie ± deviație standard (SD) a experimentelor triplicate. Analiza statistică a fost efectuată utilizând software-ul de analiză statistică SPSS (versiunea 19.0; International Business Machines, Armonk, NY, SUA). Diferențele semnificative din punct de vedere statistic au fost determinate utilizând analiza varianței și testul post hoc al lui Dunnett și P-valori mai mici de 0,05 au fost considerate semnificative statistic.
Rezultate
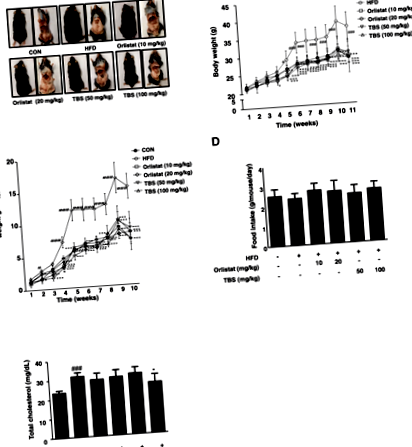
TBS a suprimat dimensiunea țesutului adipos și greutatea corporală la șoareci cu obezitate indusă de HFD
TBS a suprimat masa totală de grăsime la șoareci cu obezitate indusă de HFD
Masa WAT este influențată de adipogeneză, procesul de bază al diferențierii pre-adipocite în adipocite mature [23]. Așa cum se arată în FIG. 2a și b, a existat o diferență semnificativă în greutatea WAT epididimală între grupul CON și grupul HFD. Grupurile tratate cu TBS au avut greutăți semnificativ mai mici decât grupul HFD. Mai mult, a existat, de asemenea, o diferență remarcabilă în greutatea WAT viscerală între grupul CON și grupul HFD. Grupurile tratate cu TBS au prezentat o greutate semnificativ mai mică decât grupul HFD (Fig. 2c și d). Masa WAT epididimală, viscerală și totală a scăzut cu 59,56, 64,17 și respectiv 55,03% în grupul tratat cu TBS (100 mg/kg) comparativ cu cei din grupul HFD (Fig. 2).
TBS a suprimat acumularea de lipide indusă de HFD în țesutul adipos epididimal
Pentru a identifica efectele TBS asupra acumulării de lipide induse de HFD în WAT epididimal, probe de țesut adipos au fost preparate din fiecare grup și colorate cu soluție de H&E. Așa cum se arată în FIG. 3a, rezultatele colorării H&E pentru WAT epididimale din fiecare grup și datele au arătat că acumularea de lipide în WAT epididimală a crescut remarcabil în grupul HFD comparativ cu grupul CON. Cu toate acestea, administrarea TBS a redus semnificativ acumularea de lipide la șoarecii alimentați cu HFD. În al doilea rând, diametrul mediu al adipocitelor în WAT epididimal a crescut la șoarecii alimentați cu HFD și tratamentul cu TBS a scăzut semnificativ diametrul adipocitelor acestor șoareci (Fig. 3b).
TBS a suprimat expresia indusă de HFD a genelor legate de adipogeneză în țesutul adipos epididimal
Pentru a investiga efectele TBS asupra expresiei proteinelor p-AMPK și a nivelurilor de ARNm de AMPK, PPARγ, C/EBPα și SREBP1 în epidermatul WAT, Western blot și qRT-PCR au fost, de asemenea, efectuate. Așa cum se arată în FIG. 4a, nu a existat nicio diferență în expresia proteinei fosforilării AMPK Thr172 în grupul HFD în comparație cu cea a grupului CON, în timp ce grupurile tratate cu TBS au îmbunătățit semnificativ expresia p-AMPK Thr172 în WAT epididim. În mod similar, tratamentul cu TBS la o doză de 100 mg/kg a crescut semnificativ nivelul de ARNm al AMPK în WAT epididimal (Fig. 4b). Mai mult, a existat o creștere a expresiei mARN a PPARγ, C/EBPα și SREBP1 a grupului HFD comparativ cu grupul CON, în timp ce administrarea orlistat și TBS a scăzut în mod eficient expresia mARN a PPARγ, C/EBPα și SREBP1 în WAT epididim (Fig. 4c, d și e).
TBS a suprimat acumularea de picături lipidice induse de HFD în țesutul hepatic
Li și colab. au raportat că hrănirea cu HFD a luminat semnificativ culoarea ficatului într-un model de șobolan cu boală hepatică grasă nealcoolică [24]. Pentru a determina efectul TBS în morfologia țesutului hepatic, s-au observat probe de țesut folosind analize macroscopice. Așa cum se arată în FIG. 5a, țesutul hepatic al șoarecilor din grupul HFD a devenit palid în comparație cu cel al șoarecilor din grupul CON. Administrarea orală de TBS (50 sau 100 mg/kg) a suprimat în mod semnificativ modificarea morfologică observată în țesutul hepatic comparativ cu cea din grupul HFD. Grupurile tratate cu Orlistat au prezentat, de asemenea, morfologia țesutului hepatic recuperat. În plus, probele de țesut au fost colorate cu H&E. Așa cum se arată în FIG. 5b, în grupul HFD, picăturile de lipide au apărut ca mici vacuole în celulele hepatice. Mărirea picăturilor de lipide a fost mai pronunțată în țesutul hepatic al șoarecilor aparținând grupului HFD decât cea a grupurilor tratate cu TBS (50 sau 100 mg/kg).
Efectele TBS asupra morfologiei țesutului hepatic și asupra acumulării de lipide. (A) Analiza macroscopică a țesutului hepatic de șoarece. (b) Țesutul hepatic de la șoareci reprezentativi din fiecare grup a fost fixat, încorporat în parafină și colorat cu soluție de H&E. Imaginile sunt afișate la mărirea inițială de 100x. CON: grup dietetic normal; HFD: grup dietetic bogat în grăsimi; Orlistat: grup HFD plus orlistat (10 sau 20 mg/kg); TBS: grup HFD plus TBS (50 sau 100 mg/kg). Bara de scală este de 100 μm
TBS a suprimat expresia indusă de HFD a genelor legate de adipogeneză în țesutul hepatic
AMPK acționează ca un comutator principal, care fosforilează enzimele țintă asociate cu metabolismul lipidic în multe țesuturi, inclusiv ficatul [25]. Expresia PPARγ, C/EBPα și SREBP1 este indusă în ficatul șoarecilor induși de HFD [26,27,28]. În acest studiu, expresia proteinelor a nivelurilor hepatice de p-AMPK și mARN de hepatic AMPK, PPARγ, C/EBPα și SREBP1 au fost examinate în ficatul șoarecilor hrăniți cu HFD plus TBS prin Western blot și respectiv qRT-PCR. Expresia proteinei fosforilării AMPK Thr172 în ficatul grupului HFD a fost diminuată în comparație cu gruparea CON și grupurile tratate cu TBS au îmbunătățit expresia p-AMPK Thr172 (Fig. 6a). În mod similar, tratamentul cu TBS (100 mg/kg) a crescut semnificativ nivelul de ARNm de AMPK în țesutul hepatic (Fig. 6b). Mai mult, expresia mARN a PPARγ, C/EBPα și SREBP1 a fost reglată în sus în grupul HFD comparativ cu cea din grupul CON, iar administrarea de orlistat și TBS a inhibat considerabil expresia mARN a PPARγ hepatic, C/EBPα și SREBP1 (Fig. 6c, d și e).
Discuţie
Obezitatea este o boală multifactorială caracterizată printr-o superfluitate a adipozității și un consum excesiv de grăsimi dietetice [29]. De asemenea, este caracterizat ca o stare de inflamație cronică și hipoxie a țesutului adipos, care duce la dereglarea producției de adipokine și activarea căilor pro-inflamatorii, care pot promova progresia tumorii [30]. Bolile legate de obezitate au devenit principala cauză de deces în societățile moderne și s-a constatat că supra-nutriția este asociată cu tipuri complexe de cancer [31]. În consecință, este necesar să se trateze obezitatea ca sursă a multor boli. Efectele secundare frecvente ale tratamentelor farmacologice convenționale pentru obezitate și afecțiuni conexe, cum ar fi hipertensiunea arterială, aritmia cardiacă, constipația, cefaleea, steatoreea și deficiențele vitaminelor liposolubile și acizilor grași esențiali, au contribuit la utilizarea crescută a medicinei tradiționale pe bază de plante ca modalitate de asistență medicală pentru această afecțiune care pune viața în pericol [32]. În consecință, compușii naturali care sunt relativ siguri primesc atenție în tratarea obezității. În studiul de față, ne-am propus să evaluăm efectele TBS asupra greutății corporale și expresia genelor de adipogeneză înrudite la șoarecii obezi induși în dietă bogată în grăsimi.
TBS este una dintre rețetele tradiționale de medicină asiatică extrase dintr-o carte medicală coreeană reprezentativă, Donguibogam și a fost utilizată pe scară largă pentru tratarea disuriei, cum ar fi infecția sistemului urinar, calculul, chiluria și hematuria. Cyperus rotundus Teren Citrus unshiu Markovich, componentele majore ale TBS, au fost, de asemenea, raportate a fi benefice în prevenirea creșterii în greutate și, respectiv, a obezității [19, 20]. În consecință, componentele active ale acestor trei plante pot fi asociate cu efectul puternic al TBS la șoarecii obezi hrăniți cu HFD.
Ficatul este considerat mai ales ca un organ esențial în metabolismul lipidelor. Dezechilibrul dintre depunerea și îndepărtarea lipidelor are ca rezultat acumularea de lipide hepatice, care este legată de creșterea lipogenezei hepatice, absorbția crescută a lipidelor și/sau exportul scăzut al trigliceridelor de β-oxidare [41]. Țesutul hepatic al șoarecilor din grupul HFD a devenit palid, în timp ce grupurile tratate cu TBS au îmbunătățit acest semn de toxicitate a țesutului hepatic (Fig. 5a). Așa cum se arată în FIG. 5b, acumularea de lipide a fost puternic indusă la șoarecii hrăniți cu HFD, dar a fost inhibată la șoarecii tratați cu TBS așa cum se observă în reducerea picăturilor de lipide din țesutul hepatic. Aceasta înseamnă că ficatul șoarecilor tratați cu TBS avea mai puține adipocite decât șoarecii hrăniți cu HFD. Aceste constatări evidențiază faptul că TBS este, de asemenea, competent în reducerea acumulării de lipide în țesutul hepatic, precum și în WAT epididim.
Luate împreună, descoperirile noastre au arătat că TBS a inhibat în mod eficient acumularea de lipide în ficat și în țesutul adipos epididimal. Recuperarea expresiei AMPK, PPARγ, C/EBPα și SREBP1 este implicată în mecanismul care stă la baza efectelor anti-adipogeneza TBS (Fig. 7). Luate în considerare toate acestea, studii suplimentare pot contribui la înțelegerea actuală a eficacității TBS și utilizarea TBS ca candidat benefic pentru controlul obezității ar trebui explorată în continuare.
Mecanismul TBS. Injecțiile cu TBS au redus semnificativ acumularea de lipide prin reglarea expresiei AMPK, PPARγ, C/EBPα și SREBP1 în ficat și țesutul adipos alb epididimal al unui model de șoarece obez indus de HFD
- Efectele modelului de proces paralel extins asupra soldaților obezi; cunoștințe, atitudini și
- Analiza transcriptomului și metilomului ADN-ului într-un model de șoareci al previziunilor obezității induse de dietă
- Mecanismele moleculare ale efectelor descendenților din sarcina obeză - FullText - Obesity Facts 2013
- Efectul obezității materne asupra eliberării de ADN fără celule placentare la un model de șoarece - PubMed
- Efectul unui supliment antioxidant asupra unui model de șoarece al bolii Alzheimer; Știri; Colegiul din