Abstract
Revarsările pleurale maligne (MPE) sunt o cale terminală comună pentru multe tipuri de cancer, cu o incidență estimată în Statele Unite de peste 150.000 de cazuri pe an. MPE este o boală agresivă cu un prognostic fatal fatal și o speranță de viață de numai 3 până la 12 luni. Dezvoltarea unei terapii țintite eficiente reprezintă o nevoie urgentă nesatisfăcută. Acest comentariu se concentrează pe modul în care componentele celulare și umorale condiționează spațiul pleural ca un mediu care promovează tumoarea și vindecă rănile. În ciuda abundenței potențialelor antigene și celule efectoare în pleură, izolarea fizică a acestora prin bariera mezotelială, concentrația de citokine și chemokine care conduc tranziția epitelială la mezenchimală (EMT) și polarizarea M2/Th-2, suprimă imunitatea specifică tumorii răspunsuri efectoare. Susținem că repolarizarea imună locală trebuie să preceadă fie punctul de control imun, fie terapia celulară pentru a eradica cu succes tumoarea pleurală. Ipotezăm în continuare că, din cauza conținutului său celular, un spațiu pleural repolarizat va oferi un mediu imunitar eficient pentru generarea de răspuns sistemic antitumoral.
Introducere
Imunoterapie localizată
Conceptul de activare a sistemului imunitar în situația malignității toracice datează din anii 1970, când anchetatorii au observat o supraviețuire îmbunătățită la pacienții cu empiem după rezecții pentru cancerul pulmonar [4], justificând în mare măsură studiile nereușite cu Baccilus Calmette-Guérin (BCG) intrapleural [5]. ] și alți antigeni bacterieni. Instilarea directă a citokinelor recombinate interferon ɣ [6], interferon α2b [7] și IL-2 [8, 9] au fost de asemenea testate. IL-2 intrapleurală a fost bine tolerată în cancerul pulmonar cu celule mici (NSCLC). Mai mult, nivelurile de IL-2 administrate intrapleural au fost de 6000 de ori mai mari decât în plasmă [8], indicând faptul că IL-2 administrat local (formula greutate = 15,5 kDa) este sechestrat în spațiul pleural. Aceasta este o observație foarte importantă, deoarece alte molecule biologice mari, cum ar fi anticorpii, pot fi de așteptat să fie concentrate în mod similar atunci când sunt administrate direct în pleură. Deși IL-2 intrapleurală a eliminat revărsările la 28 din 31 de pacienți studiați [9], iar răspunsurile parțiale au fost observate cu alte modalități de citokine, timpul mediu până la progresie a variat de la zile [7] la luni [8]. Astfel, instilarea citokinelor asociate cu doze mari Th1 a fost insuficientă de la sine pentru a depăși mediul imunosupresor al spațiului pleural.
Utilizarea terapeutică a celulelor T pleural-infiltrante (PIT)
Inhibitori ai punctului de control imunitar în MPE
PD-L1 este exprimat pe mezoteliomul malign [13] și alte tumori maligne și, prin urmare, este potențial vizabil de anticorpii anti-PD-L1. Celulele T din NSCLC MPE prezintă o expresie crescută a PD-1, TIM-3 și CTLA-4, în comparație cu controalele non-maligne [14], posibil datorită nivelurilor ridicate de TGF-β în revărsarea secretată de PD-L1 + macrofage M2 asociate tumorii.
Către o terapie localizată eficientă cu imunoterapie
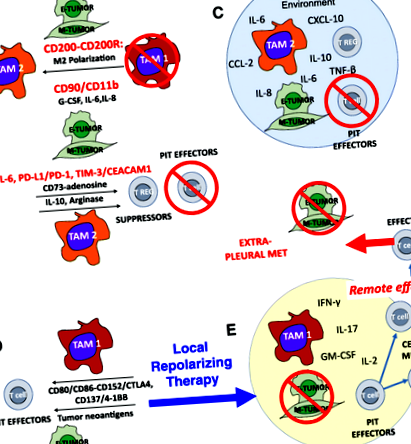
Devine din ce în ce mai clar că atât încercările convenționale, cât și cele imunoterapeutice au eșuat în MPE, deoarece spațiul pleural este un mediu sechestrat în care celulele tumorale și celulele imune interacționează în beneficiul tumorii. În spațiul pleural, citokinele și chemokinele vindecătoare ale rănilor sunt concentrate, iar interacțiunile juxtacrine ale tumorii, macrofagelor și celulelor mezoteliale sunt favorizate de apropierea lor. Rezultatul este perpetuarea unui mediu de vindecare a rănilor în care efectorii celulelor T sunt suprimate sau ucise, iar macrofagele sunt canalizate către un program M2 care ajută angiogeneza și metastazele, toate culminând cu promovarea unui fenotip tumoral EMT agresiv și invaziv.
Mediu sechestrat
Spațiul pleural reprezintă un mediu local sechestrat format din celule mezoteliale unite prin joncțiuni strânse [15]. Produsele biologice ale proteinelor, cum ar fi IL-2, rămân foarte concentrate atunci când sunt administrate intrapleural, cu concentrații locale de mii de ori mai mari decât cele ale plasmei [8]. Mișcarea proteinelor de la plasmă la pleură este, de asemenea, împiedicată, deși într-o măsură mai mică, iar raportul de revărsat pleural la plasmă al concentrațiilor de proteine este invers legat de greutatea lor moleculară [16]. Acest lucru este extrem de relevant pentru administrarea sistemică de anticorpi terapeutici, care în mod previzibil nu ar trece cu ușurință în spațiul pleural, cavitatea abdominală sau spațiile interstițiale [17].
Secretomul pleural
Interacțiuni juxtacrine
Apropierea și concentrația ridicată de celule T, macrofage, celule mezoteliale și tumori în spațiul pleural favorizează contactul celulă-celulă și semnalizarea juxtacrinei. Exemplele includ promovarea EMT prin legarea CD90 și EphA4 de tumoră la CD11b și, respectiv, Ephrin pe macrofage [23]. În mod similar, PD-L1 și PD-L2 exprimate pe macrofage tumorale și pleurale se leagă de PD-1 pe celulele T, promovând anergia, dezvoltarea celulelor T reglatoare induse (iTregs) și apoptoza [32]. Alți liganzi exprimați pe tumoare pleurală, cum ar fi CEACAM1 care se leagă de TIM-3, pot interacționa cu receptorii punctului de control imun exprimat pe PIT. MPE, care sunt drenate în mod curent terapeutic, oferă o fereastră unică către interacțiunile care sunt mai greu de observat în alte setări metastatice.
Concluzie
În ciuda eforturilor continue de a oferi terapii citotoxice sistemice și localizate eficiente și bazate pe terapii imune, în prezent nu există un tratament eficient pentru revărsările pleurale maligne. Susținem că spațiul pleural, datorită barierei fizice oferite de mezoteliu, acționează ca un bioreactor în care interacționează celulele carcinomului, TAM, PIT și stroma (Fig. 1). Concentrația citokinelor și chemokinelor de vindecare a rănilor și polarizarea mediului, rezultată din aceste interacțiuni de feedback multiplu, promovează comportamentul EMT și agresiv al tumorii și împiedică răspunsurile efectorului imun antitumoral prin multiple mecanisme distincte și probabil sinergice. Beneficiul administrării intrapleurale este că substanțele biologice cu greutate moleculară mare sunt sechestrate în spațiul pleural [8, 33] de același mecanism care permite acumularea de concentrații mari de citokine secretate local. Astfel, combinațiile de tratament repolarizante care ar avea toxicități inacceptabile care limitează doza atunci când sunt administrate sistemic, pot avea profiluri de toxicitate mai acceptabile atunci când sunt administrate direct în spațiul pleural la o fracțiune din doza sistemică.
Progresul remarcabil al imunoterapiei împotriva cancerului în ultimul deceniu cere ca noi să concepem noi metode pentru a trata mai degrabă decât paliază revărsările pleurale maligne. Recunoscând spațiul pleural ca un mediu sechestrat în care sunt prezente toate componentele necesare pentru un răspuns eficient antitumoral, dar recrutate într-un mod de vindecare a plăgilor, susținem că o combinație de terapie locală de repolarizare în combinație cu blocarea punctului de control imun și terapie celulele efectoare pot fi suficiente pentru a transforma o situație clinică gravă în avantaj terapeutic.
Abrevieri
Molecula de adeziune celulară legată de antigenul carcinoembrionar
Proteina citotoxică asociată limfocitelor T 4
Tranziția epitelială la mezenchimală
Receptor cristalizabil fracțional
celule T reglatoare induse
Polarizarea macrofagelor de tip M2
Revărsat pleural malign
Ligand de moarte programat
Celula T infiltrată pleurală
Macrofag asociat tumorii
Factor de creștere transformator
Polarizarea celulei T de tip Th2
Limfocitul care se infiltrează în tumoră
Imunoglobulină cu celule T și domeniu de mucină care conține-3
Factorul de creștere endotelial vascular
Referințe
Clive AO, Kahan BC, Hooper CE, Bhatnagar R, Morley AJ, Zahan-Evans N, și colab. Prezicerea supraviețuirii în revărsatul pleural malign: dezvoltarea și validarea scorului prognostic LENT. Torace. 2014.
American Thoracic S. Managementul revărsărilor pleurale maligne. Am J Respir Crit Care Med. 2000; 162 (5): 1987-2001.
Warren WH, Kalimi R, Khodadadian LM, Kim AW. Managementul revărsărilor pleurale maligne utilizând cateterul Pleur (x). Ann Thorac Surg. 2008; 85 (3): 1049–55.
Ruckdeschel JC, Codish SD, Stranahan A, McKneally MF. Empiemul postoperator îmbunătățește supraviețuirea în cancerul pulmonar. Documentarea și analiza unui experiment natural. N Engl J Med. 1972; 287 (20): 1013-7.
Bakker W, Nijhuis-Heddes JM, van der Velde EA. BCG intrapleural postoperator în cancerul pulmonar: un raport de urmărire pe 5 ani. Cancer Immunol Immunother. 1986; 22 (2): 155-9.
Yanagawa H, Haku T, Hiramatsu K, Nokihara H, Takeuchi E, Yano S și colab. Instilația intrapleurală a interferonului gamma la pacienții cu pleurezie malignă din cauza cancerului pulmonar. Cancer Immunol Immunother. 1997; 45 (2): 93-9.
Sartori S, Tassinari D, Ceccotti P, Tombesi P, Nielsen I, Trevisani L, și colab. Studiu prospectiv randomizat al bleomicinei intrapleurale versus interferonul alfa-2b prin sondă toracică cu alezaj mic ghidat cu ultrasunete în tratamentul paliativ al revărsărilor pleurale maligne. J Clin Oncol. 2004; 22 (7): 1228–33.
Goey SH, Eggermont AM, Punt CJ, Slingerland R, Gratama JW, Oosterom R și colab. Administrarea intrapleurală a interleukinei 2 în mezoteliomul pleural: un studiu de fază I-II. Br J Rac. 1995; 72 (5): 1283-8.
Castagneto B, Zai S, Mutti L, Lazzaro A, Ridolfi R, Piccolini E și colab. Activitatea paliativă și terapeutică a imunoterapiei IL-2 în mezoteliomul pleural malezant nerezecabil cu revărsat pleural: rezultatele unui studiu de fază II pe 31 de pacienți consecutivi. Cancer de plamani. 2001; 31 (2): 303-10.
Chu H, Du F, Gong Z, Lian P, Wamg Z, Li P și colab. Eficiență clinică mai bună a TIL-urilor pentru revărsatul pleural malign și ascită decât cisplatina prin perfuzie intrapleurală și intraperitoneală. Anticancer Res. 2017; 37 (8): 4587–91.
Maeda K, Hazama S, Tokuno K, Kan S, Maeda Y, Watanabe Y și colab. Impactul chimioterapiei pentru cancerul colorectal asupra celulelor T reglatoare și imunității tumorale. Anticancer Res. 2011; 31 (12): 4569-74.
Mani NL, Schalper KA, Hatzis C, Saglam O, Tavassoli F, Butler M, și colab. Evaluarea cantitativă a eterogenității spațiale a limfocitelor care se infiltrează în tumori în cancerul de sân. Cancerul de sân Res. 2016; 18:78.
Khanna S, Thomas A, Abate-Daga D, Zhang J, Morrow B, Steinberg SM și colab. Revărsările maligne ale mezoteliomului sunt infiltrate de celulele T CD3 + care exprimă foarte mult PD-L1, iar celulele tumorale PD-L1 + din aceste revărsări sunt susceptibile la ADCC de anticorpul anti-PD-L1 Avelumab. Jurnal de oncologie toracică: publicație oficială a Asociației Internaționale pentru Studiul Cancerului pulmonar. 2016.
Li L, Yang L, Wang L, Wang F, Zhang Z, Li J și colab. Funcția afectată a celulelor T în revărsatul pleural malign este cauzată de TGF-beta derivat predominant din macrofage. Int J Rac. 2016; 139 (10): 2261-9.
Amasheh S, Markov AG, Volgin GN, Voronkova MA, Yablonsky PK, Fromm M. Funcția barieră a mezoteliului pleurei umane este constituită de joncțiuni strânse. FASEB J. 2011; 25 (1_supplement): 1036.3-.3.
Telvi L, Jaubert F, Eyquem A, Andreux JP, Labrousse F, Chretien J. Studiul imunoglobulinelor în pleură și revărsări pleurale. Torace. 1979; 34 (3): 389-92.
Khaowroongrueng V, Jadhav SB, Fueth M, Otteneder MB, Richter W, Derendorf H, editori. Aplicarea microdializei cu pori mari în eșantionarea interstițială a anticorpului monoclonal terapeutic. Farmacologie clinică în dezvoltarea medicamentelor. San Diego, CA: Wiley; 2017.
Psallidas I, Kalomenidis I, Porcel JM, Robinson BW, Stathopoulos GT. Revărsat pleural malign: de la bancă la pat. Eur Respir Rev. 2016; 25 (140): 189.
Chen Y-M, Yang W-K, Whang-Peng J, Kuo BI-T, Perng R-P. Creșterea nivelurilor de interleukină-10 în revărsatul pleural malign. Cufăr. 1996; 110 (2): 433-6.
Hooper CE, Elvers KT, Welsh GI, Millar AB, Maskell NA. VEGF și sVEGFR-1 în revărsările pleurale maligne: asocierea cu rezultatele supraviețuirii și pleurodezei. Cancer de plamani. 2012; 77 (2): 443-9.
Thomas R, Cheah HM, Creaney J, Turlach BA, Lee YCG. Măsurarea longitudinală a biochimiei lichidului pleural și a citokinelor în revărsările pleurale maligne. Cufăr. 2016; 149 (6): 1494–500.
Dore P, Lelievre E, Morel F, Brizard A, Fourcin M, Clement C, și colab. Receptorii IL-6 și IL-6 solubili (sIL-6R și sgp130) în revărsările pleurale umane: producție masivă de IL-6 independent de bolile subiacente. Clin Exp Immunol. 1997; 107 (1): 182-8.
Lu H, Clauser KR, Tam WL, Frose J, Ye X, Eaton EN și colab. O nișă de celule stem de cancer mamar susținută de semnalizarea juxtacrinei de la monocite și macrofage. Nat Cell Biol. 2014; 16 (11): 1105-17.
Fujino S, Yokoyama A, Kohno N, Hiwada K. Interleukina 6 este un factor de creștere autocrină pentru celulele mezoteliale pleurale normale ale omului. Am J Respir Cell Mol Biol. 1996; 14 (6): 508-15.
Malhotra D, Fletcher AL, Astarita J, Lukacs-Kornek V, Tayalia P, Gonzalez SF, și colab. Profilarea transcripțională a stromei de la ganglionii limfatici inflamați și în repaus definește semnele imunologice. Nat Immunol. 2012; 13 (5): 499-510.
Mittendorf EA, Philips AV, Meric-Bernstam F, Qiao N, Wu Y, Harrington SM și colab. Expresia PD-L1 în cancerul de sân triplu negativ. Cancer Immunol Res. 2014.
Scheller J, Chalaris A, Schmidt-Arras D, Rose-John S. Proprietățile pro și antiinflamatoare ale citokinei interleukină-6. Biochim Biophys Acta. 2011; 1813 (5): 878-88.
Lo C-W, Chen M-W, Hsiao M, Wang S, Chen C-A, Hsiao S-M și colab. IL-6 trans-semnalizare în formarea și progresia ascitei maligne în cancerul ovarian. Cancer Res. 2011; 71 (2): 424.
Lee SO, Yang X, Duan S, Tsai Y, Strojny LR, Keng P, și colab. IL-6 promovează creșterea și tranziția epitelial-mezenchimală a celulelor CD133 + ale cancerului pulmonar cu celule mici. Oncotarget. 2016; 7 (6): 6626-38.
Ando K, Takahashi F, Motojima S, Nakashima K, Kaneko N, Hoshi K și colab. Rol posibil pentru tocilizumab, un anticorp anti-receptor al interleukinei-6, în tratarea cașexiei cancerului. J Clin Oncol. 2013; 31 (6): e69-72.
Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, și colab. Celule T de receptor antigenic chimeric pentru remisii susținute în leucemie. N Engl J Med. 2014; 371 (16): 1507-17.
Jin H-T, Ahmed R, Okazaki T. Rolul PD-1 în reglarea imunității celulelor T. În: Ahmed R, Honjo T, editori. Co-receptori negativi și liganzi. Berlin, Heidelberg: Springer Berlin Heidelberg; 2011. p. 17–37.
Ruf P, Kluge M, Jager M, Burges A, Volovat C, Heiss MM și colab. Farmacocinetica, imunogenitatea și bioactivitatea anticorpului terapeutic catumaxomab administrat intraperitoneal la pacienții cu cancer. Nr. J Clin Pharmacol. 2010; 69 (6): 617-25.
Mulțumiri
Finanțarea
Această lucrare este susținută de Fundația pentru Chirurgie Toracică pentru Cercetare și Educație STS Grant Grant (7/2016–7/2018), BC032981, BC044784, W81XWH-12-1-0415 și BC132245_W81XWH-14-0258 de la Departamentul Apărării, National Cancer Institute acordă R21 CA191647, Fundația Glimmer of Hope și Fondul David Downing.
Disponibilitatea datelor și a materialelor
Informatia autorului
Albert D. Donnenberg și Vera S. Donnenberg au contribuit în mod egal la această lucrare.
Afilieri
Departamentul de Medicină, Divizia de Hematologie-Oncologie, Facultatea de Medicină a Universității din Pittsburgh, Pittsburgh, PA, SUA
Albert D. Donnenberg
Departamentul de Chirurgie Cardiotoracică, Divizia de Chirurgie Toracică și Intestinală, Facultatea de Medicină a Universității din Pittsburgh, Pittsburgh, PA, SUA
James D. Luketich, Rajeev Dhupar și Vera S. Donnenberg
Departamentul de Științe Farmaceutice, Școala de Farmacie a Universității din Pittsburgh, Pittsburgh, PA, SUA
Vera S. Donnenberg
Departamentele de Medicină și Boli Infecțioase și Microbiologie, Universitatea din Pittsburgh, Școala de Medicină și Școala Absolventă de Sănătate Publică, Hillman Cancer Center, Research Pavilion, 5117 Center Ave, Pittsburgh, PA, 15213, SUA
Albert D. Donnenberg
Departamentele de Chirurgie Cardiotoracică și Științe Farmaceutice, Universitatea din Pittsburgh, Școli de Medicină și Farmacie, Hillman Cancer Center, Research Pavilion, 5117 Center Ave, Suite 2.42, Pittsburgh, PA, 15213, SUA
Vera S. Donnenberg
Puteți căuta acest autor și în PubMed Google Scholar
- Strategia de tratament pentru cistadenomul mucinos gigant pediatric Un raport de caz
- Tratamentul glioamelor maligne cu diete restrânse ketogenice sau calorice O revizuire sistematică a
- Importanța refacerii masei grase corporale în tratamentul anorexiei nervoase
- Revizuire sistematică a stimulării electrice gastrice în tratamentul obezității Expert Review of Medical
- Cauze, simptome și tratament ale teniei