Hae-Won Shin
1 Departamentul de Neurologie, Colegiul de Medicină al Universității Chung-Ang, Seul, Republica Coreea
2 Secțiunea de control al motorului uman, Institutul Național de Tulburări Neurologice și Accident vascular cerebral, Institutul Național de Sănătate, Bethesda, MD, SUA
Hee Kyung Park
3 Departamentul de Neurologie, Universitatea Inje Spitalul Ilsan-Paik, Goyang, Republica Coreea
4 Movement Disorder Center, Departamentul de Neuroștiințe, Universitatea din California San Diego, San Diego, CA, SUA
Abstract
fundal
Degenerarea hepatocerebrală dobândită (AHD) se referă la un sindrom neurologic cronic la pacienții cu boli hepatobiliare avansate. Această revizuire cuprinzătoare se concentrează pe constatările patomecanismului și neuroimagisticii din AHD.
Metode
O căutare PubMed a fost efectuată folosind termenii „degenerescență hepatocerebrală dobândită”, „degenerare hepatocerebrală cronică”, „degenerare hepatocerebrală non-wilsoniană”, „parkinsonism legat de ciroză” și „boală de mangan și ficat”.
Rezultate
Mecanisme multiple care implică acumularea de substanțe toxice, cum ar fi amoniacul sau manganul și neuroinflamarea, pot duce la o neurodegenerare pe scară largă în AHD. Caracteristicile clinice includ tulburări de mișcare, în principal parkinsonism și sindromul ataxie-plus, precum și tulburări cognitive cu caracteristici psihiatrice. Studiile de neuroimagistică a AHD cu parkinsonism arată hiperintensitate în globul pallidus bilateral pe imaginile de rezonanță magnetică ponderate T1, în timp ce imagistica moleculară a sistemului dopaminergic presinaptic prezintă constatări variabile. Sindromul Ataxia-plus în AHD poate demonstra leziuni cu semnal ridicat în pedunculii cerebeloși medii pe imaginile ponderate T2.
Discuţie
Sunt necesare studii viitoare pentru a elucida rezultatele exacte ale patomecanismului și neuroimagisticii acestui sindrom eterogen.
Introducere
Acest articol de revizuire abordează conceptele de bază și actualizările recente privind AHD, concentrându-se în principal pe descoperirile de patomecanism și neuroimagistică asociate cu fiecare sindrom clinic distinct.
Metode
Epidemiologie
Prevalența și incidența exactă a AHD sunt necunoscute, deoarece epidemiologia sa a fost rareori raportată. Prevalența AHD în afecțiunile hepatice cronice este estimată la 1-2%. Prevalența 2-4 AHD a fost raportată ca fiind mai mare la bărbați decât la femei, 1, 2, 4 - 7, dar alții au raportat rezultate contradictorii. 3, 8 Această discrepanță în ratele de prevalență raportate între sexe poate fi atribuită prevalenței LC, care este mai frecventă la bărbați (72,7%) decât la femei (27,3%). 9 În plus, sexul masculin poate fi el însuși un factor de risc pentru AHD. 2
S-a constatat că o varietate de tulburări de mișcare, în principal parkinsonism și ataxie cerebeloasă, apar la aproximativ 60% dintre pacienții cu AHD. 3, 7 Parkinsonismul este prezent la 10,5-25% dintre pacienții cu AHD. 3, 5, 7 În plus, parkinsonismul este prezent la 3,5-4,2% dintre pacienții cu LC. 10, 11 Frecvențele simptomelor în AHD sau LC sunt variabile, ceea ce poate explica variația caracteristicilor grupurilor de pacienți raportate și a metodologiilor utilizate în diferite studii.
Etiologie și patologie
AHD apare într-o mare varietate de boli hepatobiliare avansate. Manevrarea portosistemică este un factor important predispozant pentru dezvoltarea AHD, deoarece prezența sa poate permite substanțelor toxice să pătrundă în creier prin circulația sistemică, rezultând în cele din urmă acumularea de substanțe toxice în creier. 12 Nu s-a găsit nicio relație între tipul de boală hepatobiliară și AHD. 13 pacienți cu AHD au LC moderată până la severă (clasa B și C Child-Pugh); 2, 3, 5 cu toate acestea, severitatea bolii nu poate fi asociată cu dezvoltarea AHD, având în vedere că funcția ficatului poate fi normală în prezența manevrării portosistemice. 13
Durata dintre diagnosticele de boală hepatică și sindromul neurologic variază foarte mult de la 1 la 33 de ani, 3, 8 sugerând că durata poate să nu fie asociată cu dezvoltarea AHD. Encefalopatia hepatică acută (HE) poate apărea înainte și după debutul AHD. Istoricul de HE acut, care a fost raportat a fi prezent la 24 din 27 de pacienți, 1 a fost sugerat ca un factor de risc pentru dezvoltarea AHD. AHD pare să urmeze un timp prelungit în comă sau mai multe episoade de HE severă 14, dar nu a fost stabilită o relație între severitatea sau frecvența HE și AHD. 13
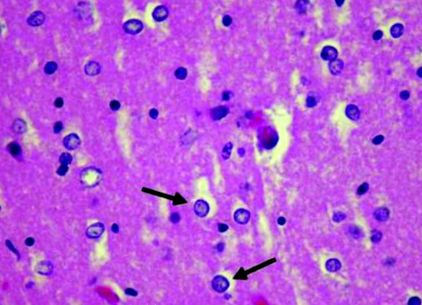
Gradul de implicare patologică în AHD este larg și difuz și include orice zone de la cortexul cerebral la trunchiul cerebral și cerebel. Deși au fost raportate doar 32 de cazuri de autopsie, constatările patologice au fost similare. Caracteristicile patologice nu se corelează neapărat cu constatările clinice. 1 Pierderea celulelor neuronale și degenerarea spongioasă afectează frecvent zonele corticale profunde, în special straturile III - V ale zonelor frontale, parietale și occipitale, în timp ce scutesc cortexul temporal. 15 În cortice, necroze laminar și pseudolaminar sunt trăsături patologice tipice. Pierderea neuronală și atrofia sunt observate în întregul nucleu profund, inclusiv nucleele lenticulare, caudate, talamice și subtalamice și cerebelul. 16 Microscopic, polimicrocavitația se găsește în zonele corticale și ganglionii bazali. Astrocitoza de tip II Alzheimer apare invariabil în zonele afectate de polimicrocavitație, precum și în cele care par macroscopice normale (Figura 1). 12, 13, 15 Examinarea postmortem a pacienților cu HE a relevat mielinoliza pontină centrală și mielinoliza extrapontină combinată cu descoperirile patologice clasice ale AHD. 17, 18 În plus, degenerescența combinată subacută poate fi legată de leziunile de substanță albă la pacienții cu AHD. 19
Patomecanism
Fiziopatologia exactă a AHD nu a fost încă complet elucidată. Printre multiplele ipoteze care au fost propuse, niciuna nu cuprinde toate mecanismele plauzibile despre care se crede că sunt implicate în dezvoltarea sa (Figura 2). Acumularea de substanțe toxice cum ar fi manganul sau amoniacul secundar mecanismelor deficitare de eliminare a ficatului poate facilita dezvoltarea AHD. Deși hiperamonemia a fost centrul atenției în cercetările timpurii asupra AHD, teoria manganului a câștigat mai mult sprijin în ultimele două decenii. Hiperamonemia poate juca un rol în dezvoltarea AHD datorită influenței sale asupra funcției astrocitelor. Astrocitele au o funcție homeostatică în absorbția/eliberarea glutamatului prin glutamină sintetază. 20 Concentrațiile crescute de amoniac în bolile hepatice cronice inhibă îndepărtarea glutamatului de către glutamină sintetază în astrocite, ceea ce duce la acumularea de glutamină și edem cerebral de grad scăzut. 21 O concentrație mai mare de amoniac poate activa transducția semnalului de oxid nitric sintază, ceea ce implică stres nitrosativ în sistemul nervos central (SNC). Efectele unui nivel crescut de amoniac pot sinergiza cu alte acțiuni stimulate de citokine pro-inflamatorii și metale toxice, cum ar fi manganul. 22
Neuroinflamarea poate contribui la dezvoltarea AHD. 22, 31 În faza acută a leziunilor neuronale cauzate de insulte metabolice, inflamația scăzută până la intermediară are efecte pozitive asupra leziunilor neuronale, deoarece facilitează îndepărtarea resturilor. Dimpotrivă, intensitatea scăzută până la mare a inflamației în faza cronică, cum ar fi boala hepatică cronică, duce la o eliberare mai mare de citokine proinflamatorii și specii reactive de oxigen. Acest răspuns inflamator dezadaptativ împiedică recuperarea leziunilor neuronale și a plasticității sinaptice. Neuroinflamarea cronică poate contribui la extinderea neurodegenerării, care întărește o stare inflamatorie cronică. Mecanisme multiple, inclusiv acumularea de substanțe toxice, neuroinflamarea și stresul oxidativ și nitrosativ pot acționa sinergic pentru a provoca neurodegenerare în AHD.
Caracteristici clinice
Vârsta de debut, care poate fi legată de durata bolii hepatobiliare subiacente, este variabilă. Debutul simptomelor este, în general, insidios, în ciuda rapoartelor anterioare care descriu cazuri excepționale cu dezvoltare acută a simptomelor. 32, 33 Spre deosebire de cursul reversibil al HE acut, AHD se caracterizează, în general, printr-un curs cronic, progresiv și ireversibil fără recuperare spontană, 1, 5, 13, cu excepția cazurilor care se recuperează după transplant hepatic (LT) „Tratament ”). 34, 35
Simptomele și semnele neurologice includ următoarele trei caracteristici: 1) tulburări de mișcare, în principal parkinsonism și sindromul de ataxie plus, 2) tulburări cognitive și simptome psihiatrice și 3) mielopatie.
Parkinsonism și alte tulburări de mișcare
- Centrul de neurologie - Penn State Hershey Medical Center - Degenerarea hepatocerebrală - Penn State
- Actualizări de gestionare a performanței dchr
- Fotografie Undertaker-ul își arată slăbirea recentă - Wrestling Inc.
- Abuzul trecut și recent este asociat cu întreruperea timpurie a rezultatelor alăptării
- Producătorul spaniol de alimente pentru animale de companie Visan a achiziționat marca olandeză Trovet